よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況 (54 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31510.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第4回 3/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
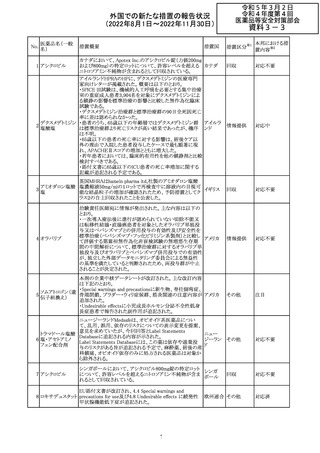
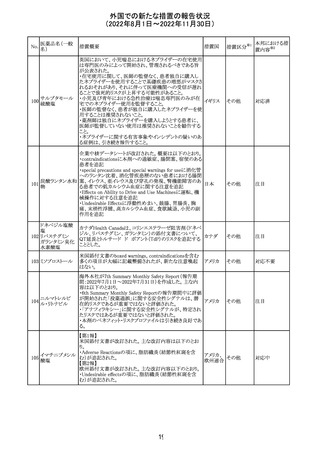
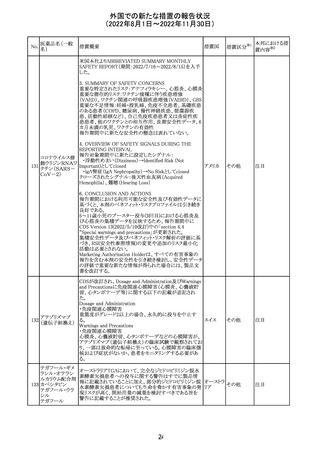
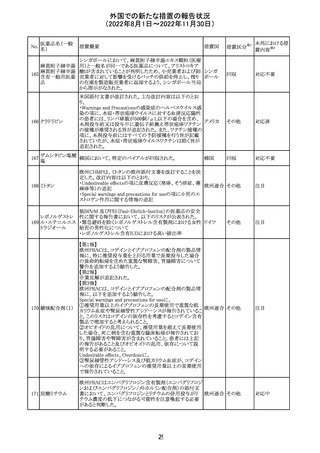
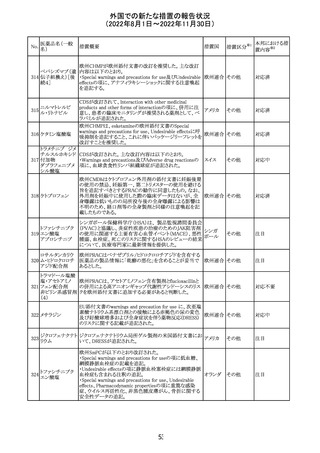
外国での新たな措置の報告状況
(2022年8月1日~2022年11月30日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
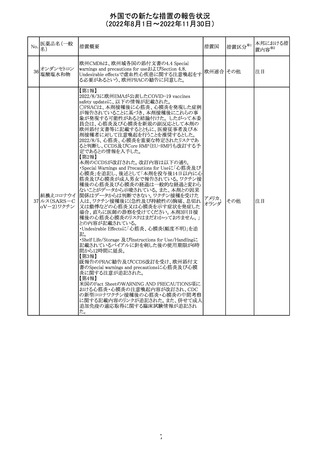
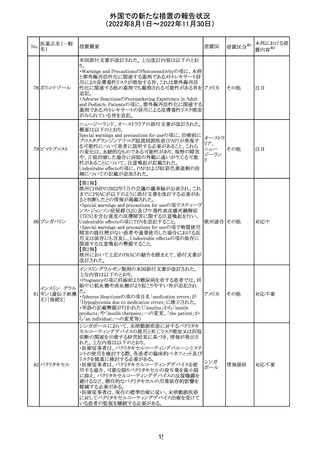
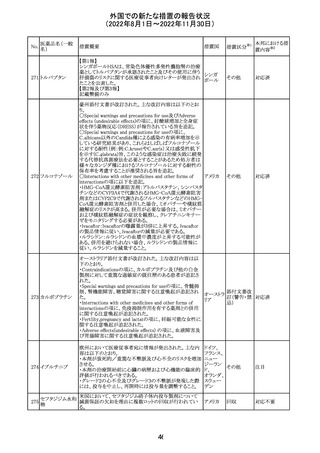
欧州で承認されたため、添付文書及びRMPが公表された。
CCDS及びcoreRMPと比較し、以下の点に差異が認められ
ブトリシランナトリ た。
325
欧州連合 その他
ウム
・Undesirable effectsの項に血中アルカリホスファターゼ上
昇、四肢痛の記載
・RMPの重要な潜在的リスクの項に過敏症反応の記載
本邦における措
置内容※2
注目
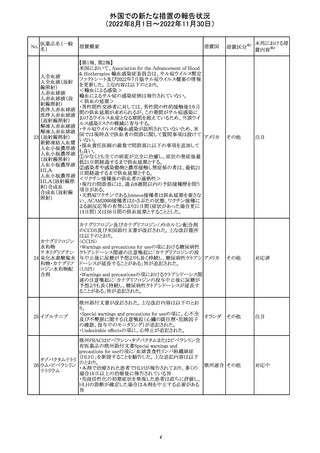
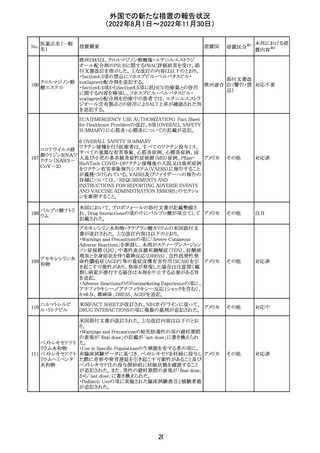
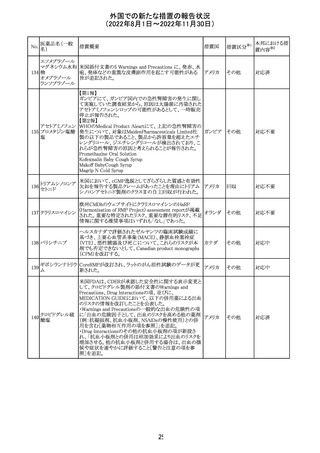
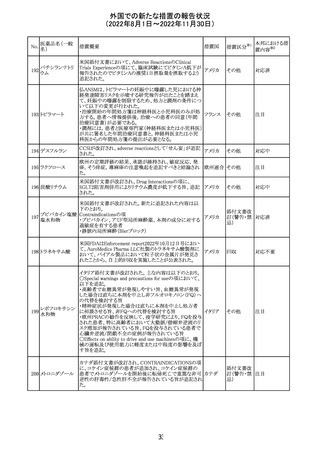
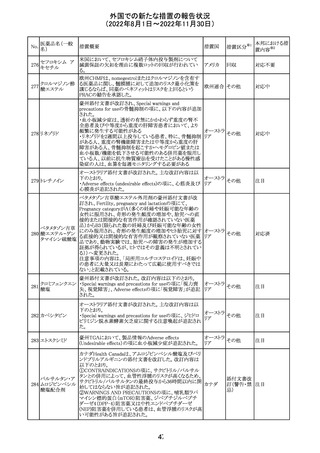
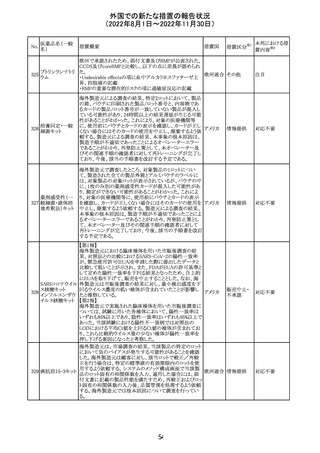
培養同定・一般
細菌キット
海外製造元による調査の結果、特定2ロットにおいて、製品
の箱、パウチに印刷された製品/ロット番号と、内容物であ
るカードの製品/ロット番号が一致していない製品が混入し
ている可能性があり、24時間以上の結果遅延が生じる可能
性があることがわかった。これにより、対象の医療機関等
に、使用前にパウチとカードの表示を確認し、カードが正し
アメリカ
くない場合にはそのカードの使用を中止し、廃棄するよう依
頼する。製造元による調査の結果、本事象の根本原因は、
製造手順が不適切であったことによるオペレーターエラー
であることがわかり、再発防止策として、本オペレーター及
びその関連手順の確認者に対して再トレーニングが完了し
ており、今後、該当の手順書を改訂する予定である。
情報提供
対応不要
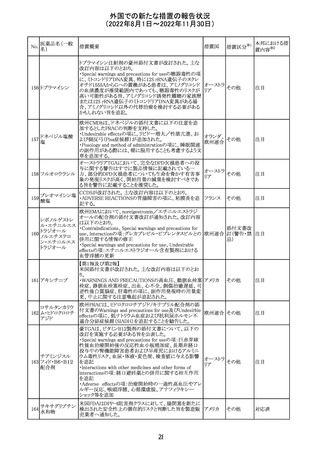
薬剤感受性(一
327 般細菌・液体培
地希釈法)キット
海外製造元で調査したところ、対象製品の1ロットについ
て、製造された全ての製品外箱とアルミパウチのラベルに
は、対象製品の対象ロットが表示されているが、パウチの中
に、1枚のみ別の薬剤感受性カードが混入した可能性があ
り、測定ができない可能性があることがわかった。これによ
り、対象の医療機関等に、使用前にパウチとカードの表示
を確認し、カードが正しくない場合にはそのカードの使用を アメリカ
中止し、廃棄するよう依頼する。製造元による調査の結果、
本事象の根本原因は、製造手順が不適切であったことによ
るオペレーターエラーであることがわかり、再発防止策とし
て、本オペレーター及びその関連手順の確認者に対して
再トレーニングが完了しており、今後、該当の手順書を改訂
する予定である。
情報提供
対応不要
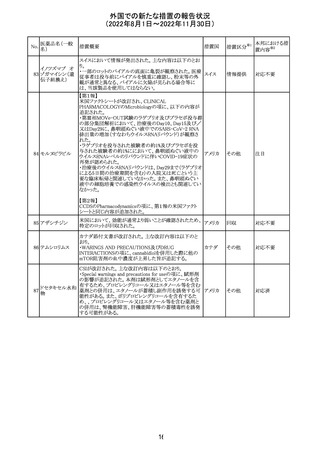
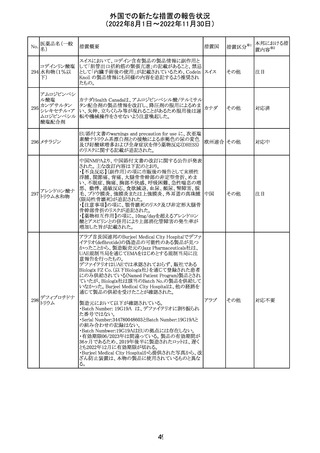
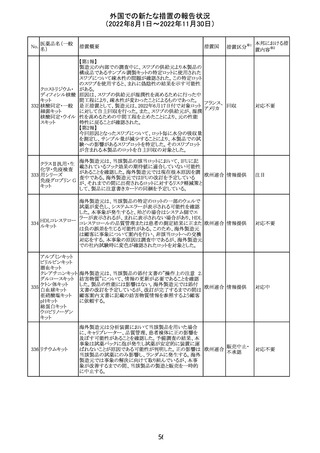
326
SARSコロナウイル
ス核酸キット
328
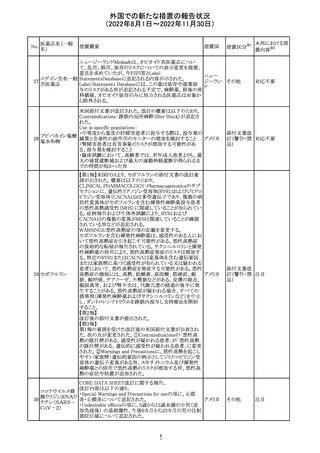
インフルエンザウ
イルス核酸キット
329 癌抗原15-3キット
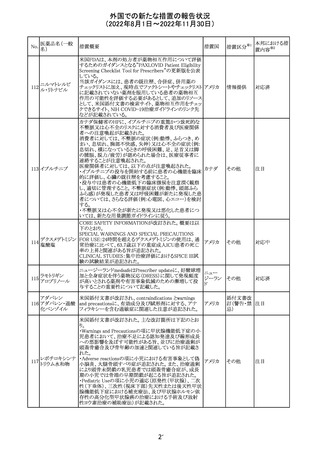
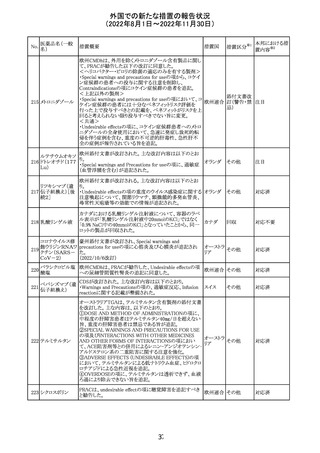
【第1報】
海外製造元における臨床検体を用いた市販後調査の結
果、対照法との比較におけるSARS-CoV-2の陽性一致率
が、緊急使用許可(EUA)を申請した際に提出したデータと
比較して低いことが示され、また、FDAがEUAの許可基準と
して定めた陽性一致率を下回る結果となったため、自主的
にEUAを取り下げて、販売を中止することとした。なお、海
外製造元は市販後調査の結果に対し、最小検出感度を下
回るウイルス濃度の低い検体が含まれていたことが影響し
販売中止・
アメリカ
たと推察している。
不承認
【第2報】
海外製造元で実施された臨床検体を用いた市販後調査に
ついては、試験に用いた各検体において、陽性一致率は
いずれも85%以上であり、陰性一致率はいずれも95%以上で
あった。当該試験における陽性不一致例では対照法の
LODにおける平均Ct値を上回るCt値の検体が含まれてお
り、これら比較的ウイルス量の少ない検体が陽性一致率を
押し下げる要因になったと考察した。
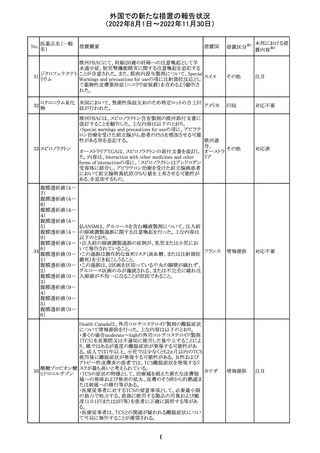
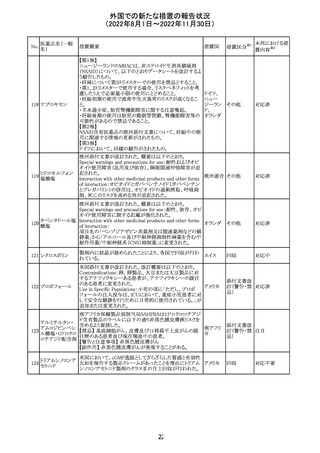
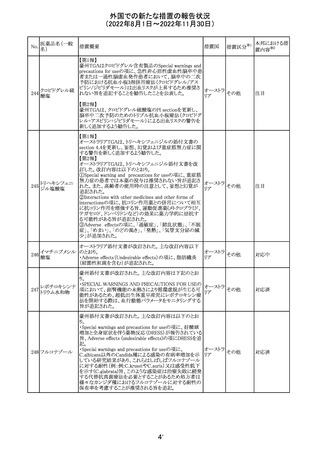
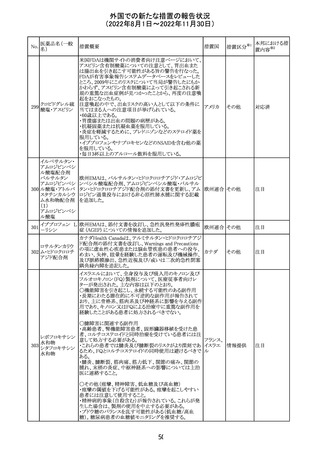
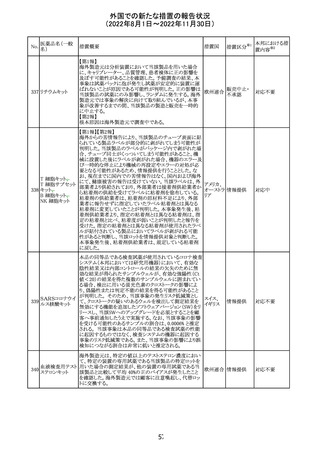
海外製造元は、市場調査の結果、当該製品の特定のロット
において負のバイアスが発生する可能性があることを確認
した。海外製造元は顧客に対し、該当ロットで較正/再較
正を行う場合は、特定の標準液の有効期限内のロットを使
用するよう依頼する。システムのメソッド構成画面で当該製
欧州連合 情報提供
品のロット固有の相関係数を入力、適用した場合には、添
付文書に記載の製品性能を満たすため、再較正およびロッ
ト固有の相関係数の入力後、品質管理を処理するよう依頼
する。海外製造元では根本原因について調査を行ってい
る。
54
対応不要
対応不要
(2022年8月1日~2022年11月30日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
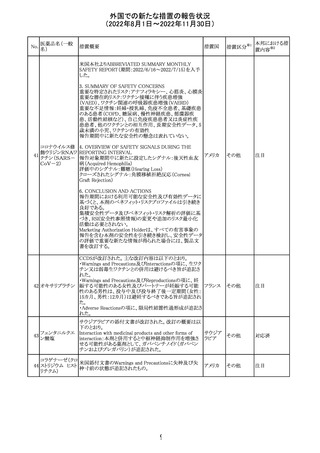
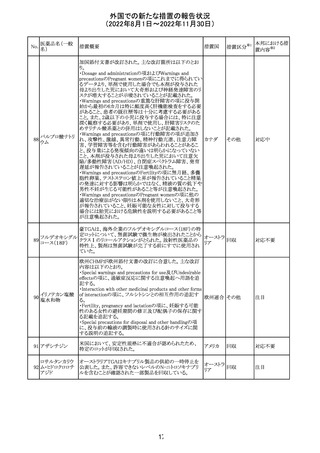
欧州で承認されたため、添付文書及びRMPが公表された。
CCDS及びcoreRMPと比較し、以下の点に差異が認められ
ブトリシランナトリ た。
325
欧州連合 その他
ウム
・Undesirable effectsの項に血中アルカリホスファターゼ上
昇、四肢痛の記載
・RMPの重要な潜在的リスクの項に過敏症反応の記載
本邦における措
置内容※2
注目
培養同定・一般
細菌キット
海外製造元による調査の結果、特定2ロットにおいて、製品
の箱、パウチに印刷された製品/ロット番号と、内容物であ
るカードの製品/ロット番号が一致していない製品が混入し
ている可能性があり、24時間以上の結果遅延が生じる可能
性があることがわかった。これにより、対象の医療機関等
に、使用前にパウチとカードの表示を確認し、カードが正し
アメリカ
くない場合にはそのカードの使用を中止し、廃棄するよう依
頼する。製造元による調査の結果、本事象の根本原因は、
製造手順が不適切であったことによるオペレーターエラー
であることがわかり、再発防止策として、本オペレーター及
びその関連手順の確認者に対して再トレーニングが完了し
ており、今後、該当の手順書を改訂する予定である。
情報提供
対応不要
薬剤感受性(一
327 般細菌・液体培
地希釈法)キット
海外製造元で調査したところ、対象製品の1ロットについ
て、製造された全ての製品外箱とアルミパウチのラベルに
は、対象製品の対象ロットが表示されているが、パウチの中
に、1枚のみ別の薬剤感受性カードが混入した可能性があ
り、測定ができない可能性があることがわかった。これによ
り、対象の医療機関等に、使用前にパウチとカードの表示
を確認し、カードが正しくない場合にはそのカードの使用を アメリカ
中止し、廃棄するよう依頼する。製造元による調査の結果、
本事象の根本原因は、製造手順が不適切であったことによ
るオペレーターエラーであることがわかり、再発防止策とし
て、本オペレーター及びその関連手順の確認者に対して
再トレーニングが完了しており、今後、該当の手順書を改訂
する予定である。
情報提供
対応不要
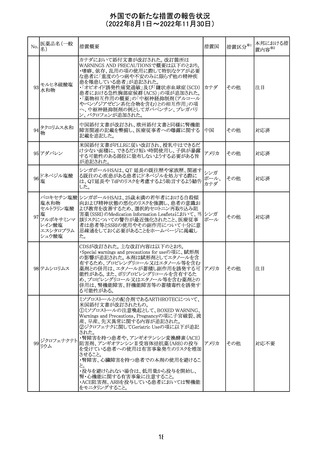
326
SARSコロナウイル
ス核酸キット
328
インフルエンザウ
イルス核酸キット
329 癌抗原15-3キット
【第1報】
海外製造元における臨床検体を用いた市販後調査の結
果、対照法との比較におけるSARS-CoV-2の陽性一致率
が、緊急使用許可(EUA)を申請した際に提出したデータと
比較して低いことが示され、また、FDAがEUAの許可基準と
して定めた陽性一致率を下回る結果となったため、自主的
にEUAを取り下げて、販売を中止することとした。なお、海
外製造元は市販後調査の結果に対し、最小検出感度を下
回るウイルス濃度の低い検体が含まれていたことが影響し
販売中止・
アメリカ
たと推察している。
不承認
【第2報】
海外製造元で実施された臨床検体を用いた市販後調査に
ついては、試験に用いた各検体において、陽性一致率は
いずれも85%以上であり、陰性一致率はいずれも95%以上で
あった。当該試験における陽性不一致例では対照法の
LODにおける平均Ct値を上回るCt値の検体が含まれてお
り、これら比較的ウイルス量の少ない検体が陽性一致率を
押し下げる要因になったと考察した。
海外製造元は、市場調査の結果、当該製品の特定のロット
において負のバイアスが発生する可能性があることを確認
した。海外製造元は顧客に対し、該当ロットで較正/再較
正を行う場合は、特定の標準液の有効期限内のロットを使
用するよう依頼する。システムのメソッド構成画面で当該製
欧州連合 情報提供
品のロット固有の相関係数を入力、適用した場合には、添
付文書に記載の製品性能を満たすため、再較正およびロッ
ト固有の相関係数の入力後、品質管理を処理するよう依頼
する。海外製造元では根本原因について調査を行ってい
る。
54
対応不要
対応不要