よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況 (51 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31510.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第4回 3/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
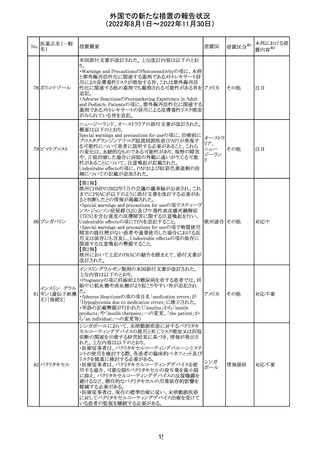
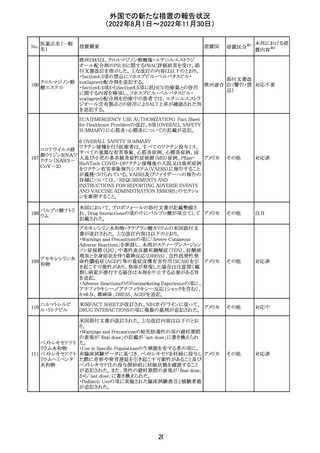
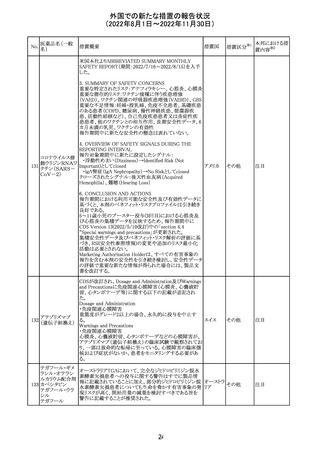
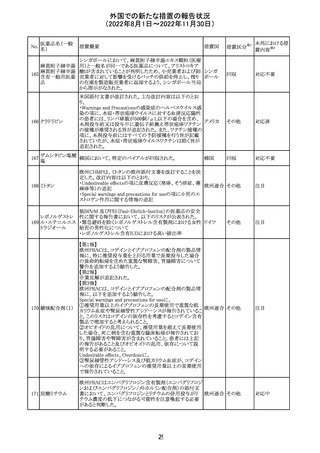
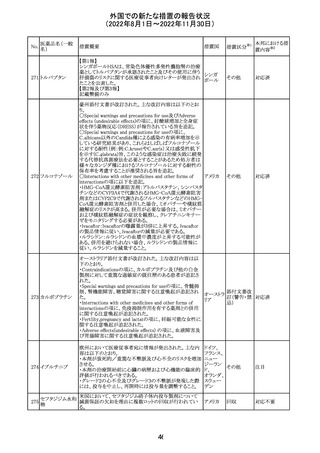
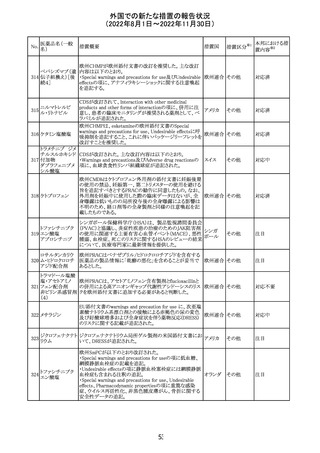
外国での新たな措置の報告状況
(2022年8月1日~2022年11月30日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
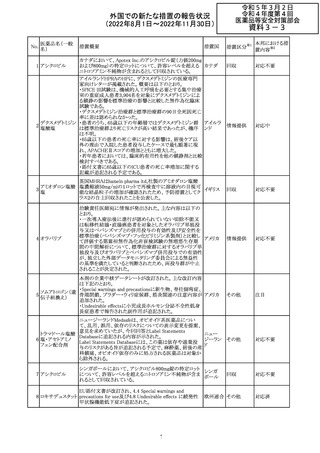
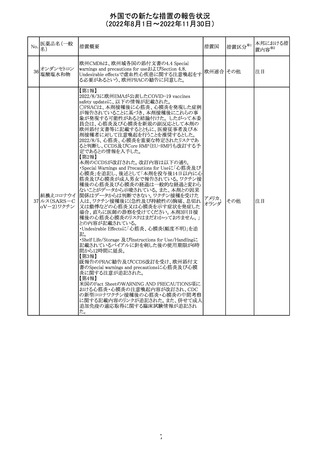
【第1報】
Pharmacovigilance Risk Assessment Committee(PRAC)は
現時点で重度月経出血の評価を完了し、本委員会は、頻
度不明の副作用として重度月経出血をコミナティの製品情
報に追加するよう勧告している(以下抜粋)。
結論は、臨床試験や観察研究、市販後調査強化活動の実
施中に報告された症例、並びに欧州諸国では
EudraVigilanceで報告された症例を含め、患者及び医療従
事者による自発報告症例等のエビデンスに基づくものであ
る。
重度月経出血(月経過多)は、身体的、社会的、精神的及
び物質的な生活の質を妨げる量及び期間又はいずれか一
方の増加を特徴とする出血と定義される。本剤の初回、2回
目及び追加接種後に重度月経出血の症例が報告されてい
る。少数ではあるが、再投与陽性の症例もあった(初回ワク
チン接種後に重度月経出血がみられ、2回目の接種後に
コロナウイルス修 再発した)。再投与陽性により、薬剤が当該副作用を引き起
飾ウリジンRNAワ こした可能性が示唆される。現時点で入手されている検討
304
オランダ その他
クチン(SARS- 済みのデータに含まれる症例はほとんどが非重篤で一時
CoV-2)
的に発現した症例であった。
対応中
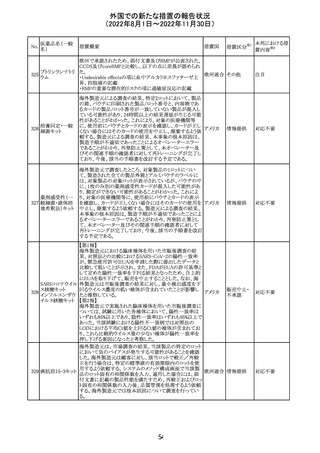
データを検討した結果、本委員会は、少なくとも重度月経
出血は本剤と因果関係があるとする合理的な可能性がある
と結論付けたため、製品情報を更新するよう勧告した。
月経障害は一般に極めて高頻度に認められ、発現する理
由は様々である。これにはいくつかの基礎疾患が該当す
る。
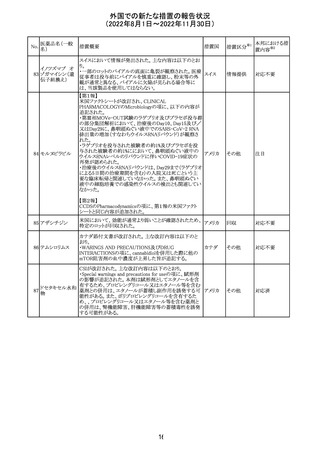
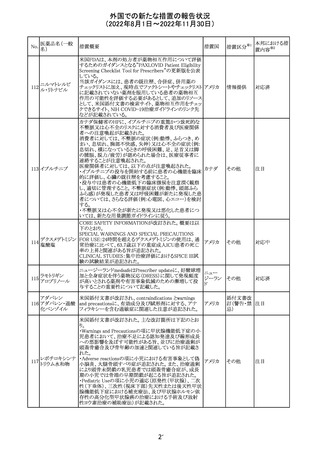
【第2報】
〇コミナティの欧州添付文書に以下の記載が追加された。
・Undesirable effects
生殖器・乳房疾患
頻度不明: 重度月経出血(ほとんどの事例で非重篤かつ一
時的であるとみられる)
〇コミナテイのPackage leafletに以下の記載が追加された。
・Possible side effects
不明(利用可能なデータから推定できない):
重度月経出血 (ほとんどの事例で非重篤かつ一時的であ
るとみられる)
305
ニラパリブトシル
酸塩水和物
ニラパリブトシル酸塩水和物の導入元である
GlaxoSmithKline社が、「プラチナ製剤を含む治療で完全奏
効(CR)又は部分奏効(PR)が得られた再発性上皮性卵巣
癌、卵管癌又は原発性腹膜癌を有する成人患者の維持療
アメリカ
法」の効能又は効果を生殖細胞系列のBRCA遺伝子変異
陽性患者集団のみに限定する旨のDear Health Care
Provider Letterを公表した。関連する添付文書改訂につい
て米国FDAと協議中である。
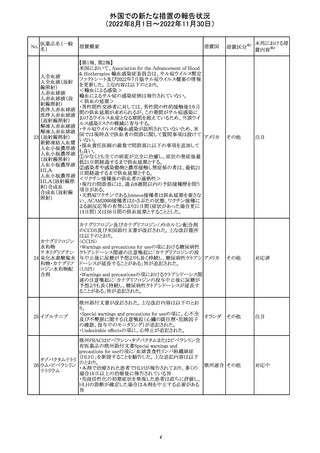
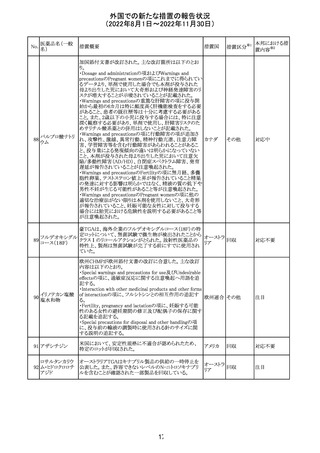
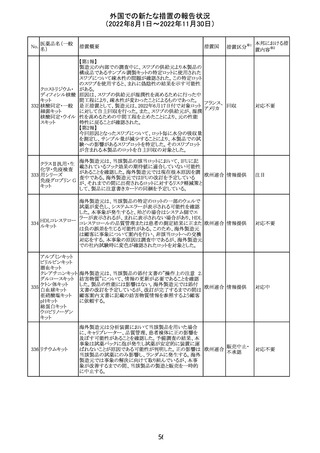
独BfArM及び仏ANSMは、nomegesterolまたはクロルマジノ
ン酢酸エステルを含有する医薬品の髄膜腫リスクについ
て、Direct Healthcare Professional Communication
(DHPC)を公表した。主な内容は以下のとおり。
・高用量クロルマジノン(5 - 10mg)または高用量
nomegesterol(3.75 - 5mg)を含む医薬品は、できるだけ有
クロルマジノン酢 効な最低量と最短期間で、他の介入が適切でない場合に ドイツ、
306
酸エステル
のみ使用すること。
フランス
・低用量・高用量のnomegesterolやクロルマジノン製剤は、
髄膜腫がある人、または既往のある人には使用しないこと。
・臨床診療にしたがって髄膜腫の症状について患者をモニ
ターすること。
・髄膜腫と診断された場合、これらの薬による治療は永久に
中止すること。
51
情報提供
注目
その他
対応中
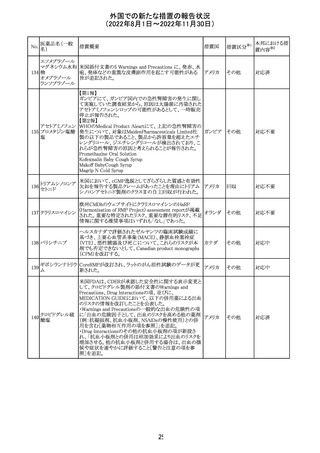
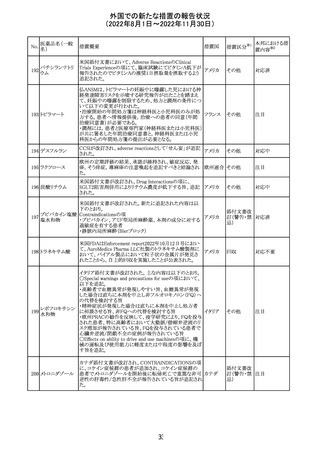
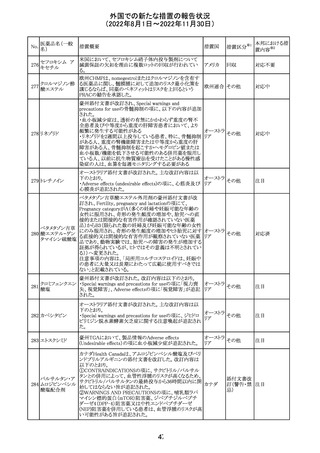
(2022年8月1日~2022年11月30日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
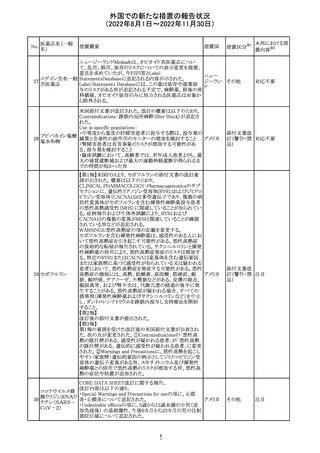
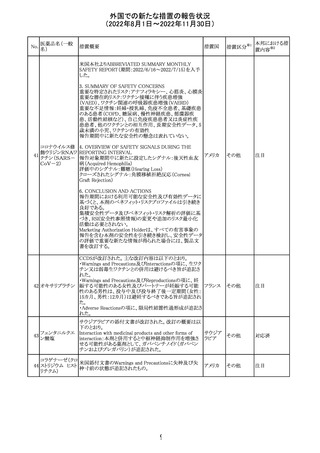
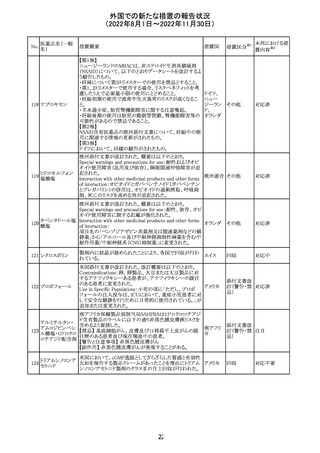
【第1報】
Pharmacovigilance Risk Assessment Committee(PRAC)は
現時点で重度月経出血の評価を完了し、本委員会は、頻
度不明の副作用として重度月経出血をコミナティの製品情
報に追加するよう勧告している(以下抜粋)。
結論は、臨床試験や観察研究、市販後調査強化活動の実
施中に報告された症例、並びに欧州諸国では
EudraVigilanceで報告された症例を含め、患者及び医療従
事者による自発報告症例等のエビデンスに基づくものであ
る。
重度月経出血(月経過多)は、身体的、社会的、精神的及
び物質的な生活の質を妨げる量及び期間又はいずれか一
方の増加を特徴とする出血と定義される。本剤の初回、2回
目及び追加接種後に重度月経出血の症例が報告されてい
る。少数ではあるが、再投与陽性の症例もあった(初回ワク
チン接種後に重度月経出血がみられ、2回目の接種後に
コロナウイルス修 再発した)。再投与陽性により、薬剤が当該副作用を引き起
飾ウリジンRNAワ こした可能性が示唆される。現時点で入手されている検討
304
オランダ その他
クチン(SARS- 済みのデータに含まれる症例はほとんどが非重篤で一時
CoV-2)
的に発現した症例であった。
対応中
データを検討した結果、本委員会は、少なくとも重度月経
出血は本剤と因果関係があるとする合理的な可能性がある
と結論付けたため、製品情報を更新するよう勧告した。
月経障害は一般に極めて高頻度に認められ、発現する理
由は様々である。これにはいくつかの基礎疾患が該当す
る。
【第2報】
〇コミナティの欧州添付文書に以下の記載が追加された。
・Undesirable effects
生殖器・乳房疾患
頻度不明: 重度月経出血(ほとんどの事例で非重篤かつ一
時的であるとみられる)
〇コミナテイのPackage leafletに以下の記載が追加された。
・Possible side effects
不明(利用可能なデータから推定できない):
重度月経出血 (ほとんどの事例で非重篤かつ一時的であ
るとみられる)
305
ニラパリブトシル
酸塩水和物
ニラパリブトシル酸塩水和物の導入元である
GlaxoSmithKline社が、「プラチナ製剤を含む治療で完全奏
効(CR)又は部分奏効(PR)が得られた再発性上皮性卵巣
癌、卵管癌又は原発性腹膜癌を有する成人患者の維持療
アメリカ
法」の効能又は効果を生殖細胞系列のBRCA遺伝子変異
陽性患者集団のみに限定する旨のDear Health Care
Provider Letterを公表した。関連する添付文書改訂につい
て米国FDAと協議中である。
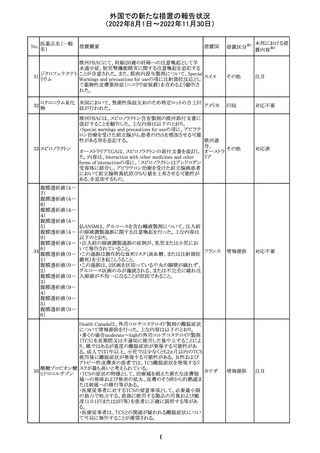
独BfArM及び仏ANSMは、nomegesterolまたはクロルマジノ
ン酢酸エステルを含有する医薬品の髄膜腫リスクについ
て、Direct Healthcare Professional Communication
(DHPC)を公表した。主な内容は以下のとおり。
・高用量クロルマジノン(5 - 10mg)または高用量
nomegesterol(3.75 - 5mg)を含む医薬品は、できるだけ有
クロルマジノン酢 効な最低量と最短期間で、他の介入が適切でない場合に ドイツ、
306
酸エステル
のみ使用すること。
フランス
・低用量・高用量のnomegesterolやクロルマジノン製剤は、
髄膜腫がある人、または既往のある人には使用しないこと。
・臨床診療にしたがって髄膜腫の症状について患者をモニ
ターすること。
・髄膜腫と診断された場合、これらの薬による治療は永久に
中止すること。
51
情報提供
注目
その他
対応中