よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況 (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31510.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第4回 3/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
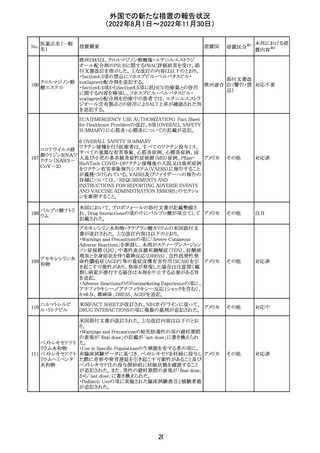
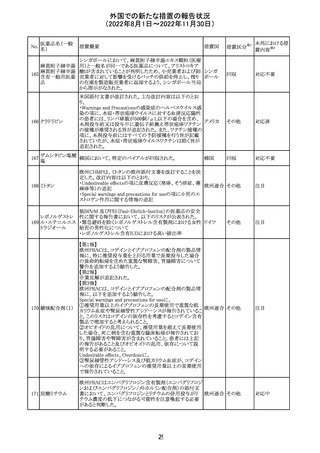
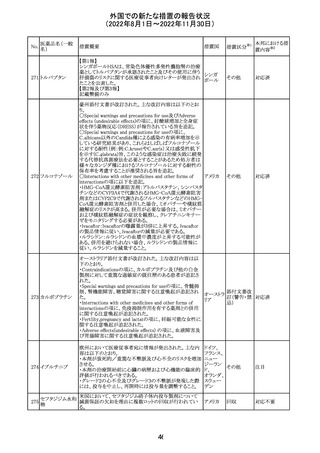
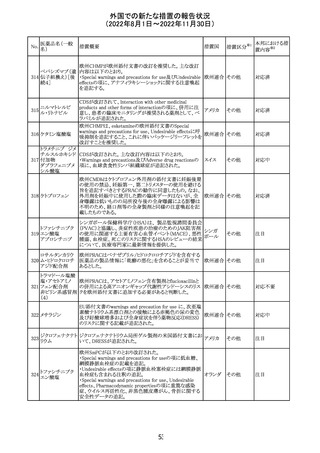
外国での新たな措置の報告状況
(2022年8月1日~2022年11月30日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
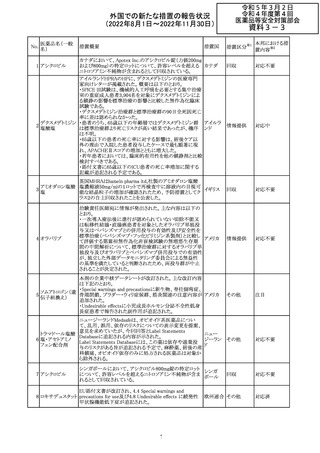
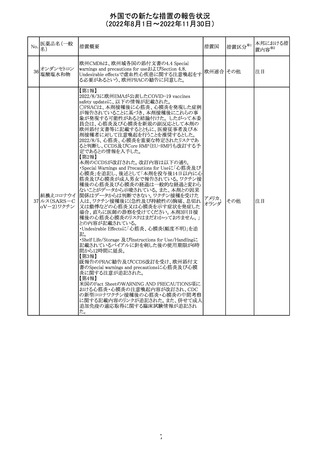
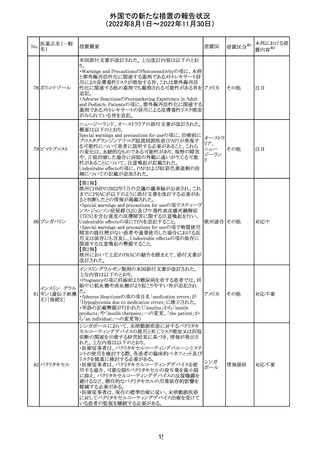
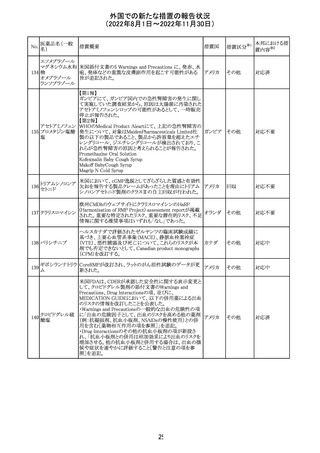
欧州EMAは、クロルマジノン酢酸塩・エチニルエストラジ
オール配合剤のPSURに関するPRAC評価結果を受け、添
付文書改訂を指示した。主な改訂の内容は以下のとおり。
・Section4.3項の禁忌にソホスブビル・ベルパタスビル・
添付文書改
クロルマジノン酢 voxilaprevir配合剤を追記する。
106
欧州連合 訂(警告・禁 対応不要
酸エステル
・Section4.4項からSection4.5項に抗HCV治療薬との併用
忌)
に関する内容を移項し、ソホスブビル・ベルパタスビル・
voxilaprevir配合剤を治療中の患者では、エチニルエストラ
ジオール含有製品との併用によりALT上昇が確認された旨
を追記する。
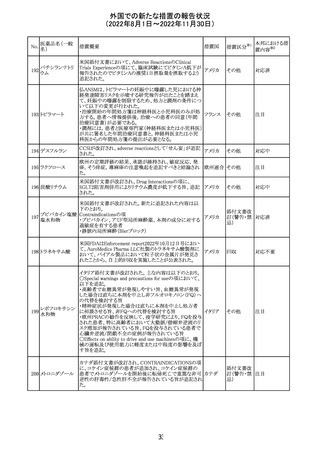
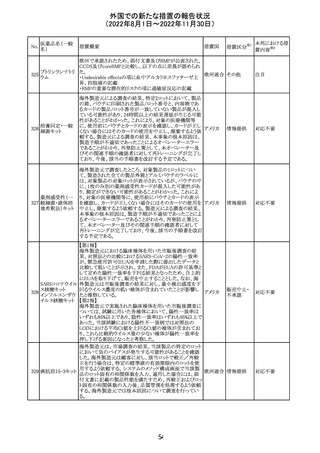
EUA(EMERGENCY USE AUTHORIZATION) Fact Sheet
for Healthcare Providersの改訂。6項(OVERALL SAFETY
SUMMARY)に心筋炎・心膜炎についての記載が追記。
6 OVERALL SAFETY SUMMARY
ワクチン接種を行う医療者は、すべてのワクチン投与ミス、
コロナウイルス修
すべての重篤な有害事象、心筋炎症例、心膜炎症例、成
飾ウリジンRNAワ
107
人及び小児の多系統炎症性症候群(MIS)症例、Pfizerアメリカ
クチン(SARS-
BioNTech COVID-19ワクチン接種後の入院又は致死症例
CoV-2)
をワクチン有害事象報告システム(VAERS)に報告すること
が義務づけられている。VAERS及びファイザーへの報告の
詳細については、「REQUIREMENTS AND
INSTRUCTIONS FOR REPORTING ADVERSE EVENTS
AND VACCINE ADMINISTRATION ERRORS」のセクショ
ンを参照すること。
その他
対応済
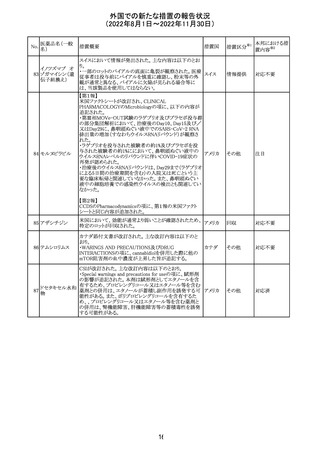
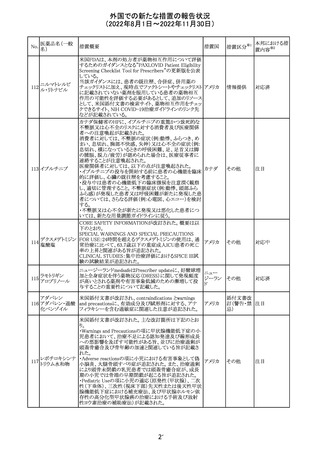
米国において、プロポフォールの添付文書が記載整備さ
バルプロ酸ナトリ
れ、Drug Interactionsの項の中にバルプロ酸が項立てして アメリカ
ウム
記載された。
その他
注目
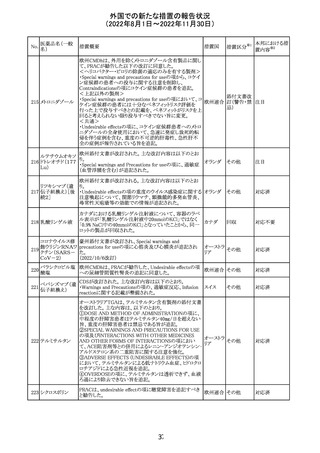
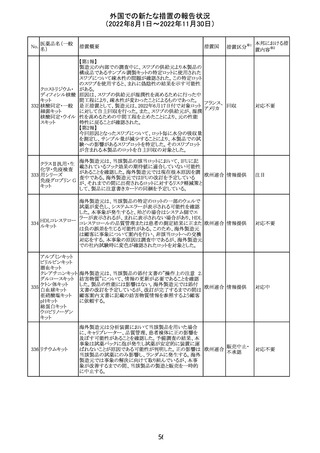
アモキシシリン水和物・クラブラン酸カリウムの米国添付文
書が改訂された。主な改訂内容は以下のとおり。
・Warnings and Precautionsの項に「Severe Cutaneous
Adverse Reactions」を新設し、本剤がスティーヴンス・ジョン
ソン症候群(SJS)、中毒性表皮壊死融解症(TEN)、好酸球
増加と全身症状を伴う薬物反応(DRESS)、急性汎発性発
アモキシシリン水
109
疹性膿疱症(AGEP)等の重症皮膚有害作用(SCAR)を引 アメリカ
和物
き起こす可能性があり、発疹が発現した場合は注意深く観
察し病変が進行する場合は本剤を中止する必要がある旨
を追記。
・Adverse ReactionsののPostmarketing Experienceの項に、
アナフィラキシー/アナフィラキシー反応(ショックを含む)、
かゆみ、蕁麻疹、DRESS、AGEPを追記。
その他
対応済
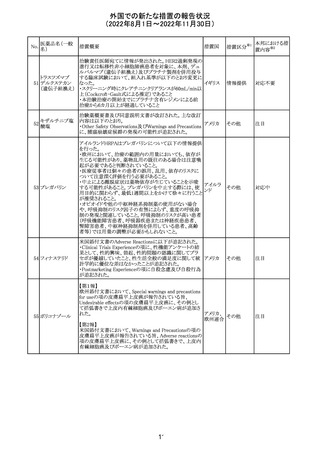
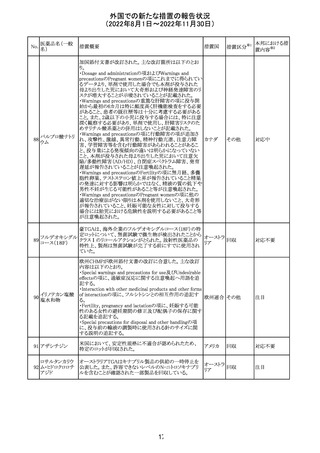
米国FACT SHEETが改訂され、NIHガイドラインに従って、
アメリカ
DRUG INTERACTIONSの項に複数の薬剤が追記された。
その他
対応中
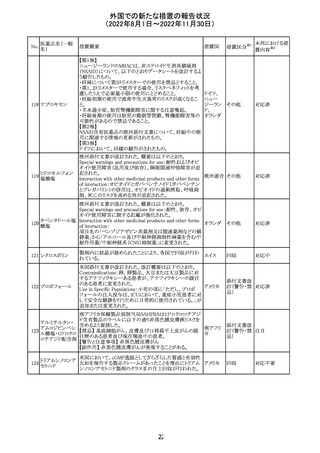
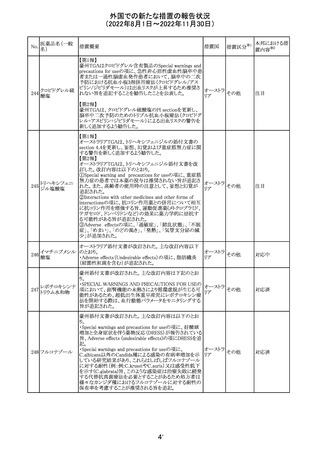
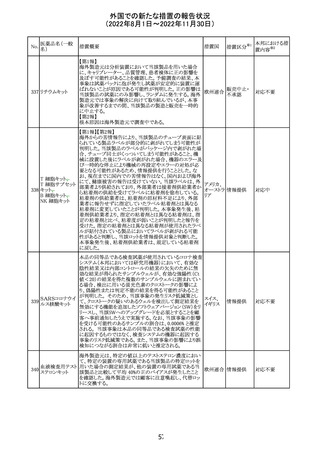
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・Warnings and Precautionsの胎児胚毒性の項の避妊期間
の表現が「final dose」の記載が「last dose」に書き換えられ
ペメトレキセドナト た。
リウム水和物
・Use in Specific Populationsの生殖能を有する者の項に、
111 ペメトレキセドナト 非臨床試験データに基づき、ペメトレキセドを妊婦に投与し アメリカ
リウムヘミペンタ た際に奇形や発育遅延を引き起こす可能性があること及び
水和物
ペメトレキセド注の投与開始前に妊娠状態を確認すること
が追記された。また、男性の避妊期間の表現が「final dose」
から「last dose」に書き換えられた。
・Pediatric Useの項に実施された臨床試験番号と被験者数
が追記された。
その他
対応済
108
110
ニルマトレルビ
ル・リトナビル
20
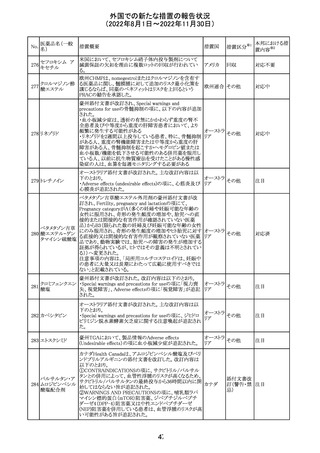
(2022年8月1日~2022年11月30日)
No.
医薬品名(一般
名)
措置概要
措置国
措置区分※1
本邦における措
置内容※2
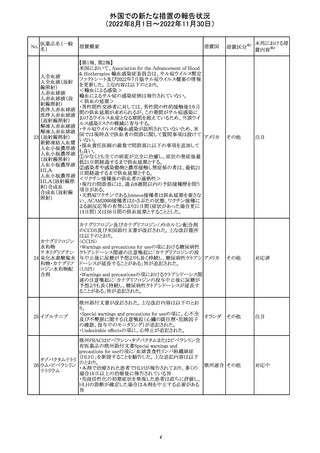
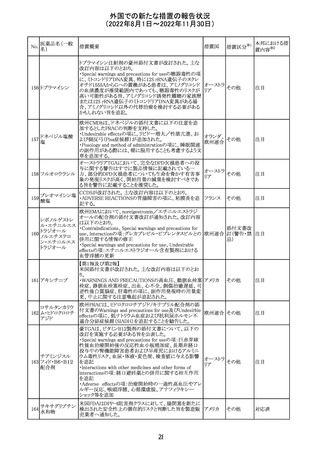
欧州EMAは、クロルマジノン酢酸塩・エチニルエストラジ
オール配合剤のPSURに関するPRAC評価結果を受け、添
付文書改訂を指示した。主な改訂の内容は以下のとおり。
・Section4.3項の禁忌にソホスブビル・ベルパタスビル・
添付文書改
クロルマジノン酢 voxilaprevir配合剤を追記する。
106
欧州連合 訂(警告・禁 対応不要
酸エステル
・Section4.4項からSection4.5項に抗HCV治療薬との併用
忌)
に関する内容を移項し、ソホスブビル・ベルパタスビル・
voxilaprevir配合剤を治療中の患者では、エチニルエストラ
ジオール含有製品との併用によりALT上昇が確認された旨
を追記する。
EUA(EMERGENCY USE AUTHORIZATION) Fact Sheet
for Healthcare Providersの改訂。6項(OVERALL SAFETY
SUMMARY)に心筋炎・心膜炎についての記載が追記。
6 OVERALL SAFETY SUMMARY
ワクチン接種を行う医療者は、すべてのワクチン投与ミス、
コロナウイルス修
すべての重篤な有害事象、心筋炎症例、心膜炎症例、成
飾ウリジンRNAワ
107
人及び小児の多系統炎症性症候群(MIS)症例、Pfizerアメリカ
クチン(SARS-
BioNTech COVID-19ワクチン接種後の入院又は致死症例
CoV-2)
をワクチン有害事象報告システム(VAERS)に報告すること
が義務づけられている。VAERS及びファイザーへの報告の
詳細については、「REQUIREMENTS AND
INSTRUCTIONS FOR REPORTING ADVERSE EVENTS
AND VACCINE ADMINISTRATION ERRORS」のセクショ
ンを参照すること。
その他
対応済
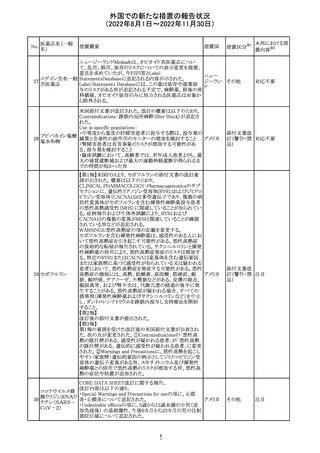
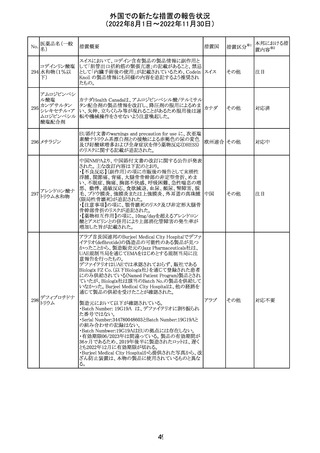
米国において、プロポフォールの添付文書が記載整備さ
バルプロ酸ナトリ
れ、Drug Interactionsの項の中にバルプロ酸が項立てして アメリカ
ウム
記載された。
その他
注目
アモキシシリン水和物・クラブラン酸カリウムの米国添付文
書が改訂された。主な改訂内容は以下のとおり。
・Warnings and Precautionsの項に「Severe Cutaneous
Adverse Reactions」を新設し、本剤がスティーヴンス・ジョン
ソン症候群(SJS)、中毒性表皮壊死融解症(TEN)、好酸球
増加と全身症状を伴う薬物反応(DRESS)、急性汎発性発
アモキシシリン水
109
疹性膿疱症(AGEP)等の重症皮膚有害作用(SCAR)を引 アメリカ
和物
き起こす可能性があり、発疹が発現した場合は注意深く観
察し病変が進行する場合は本剤を中止する必要がある旨
を追記。
・Adverse ReactionsののPostmarketing Experienceの項に、
アナフィラキシー/アナフィラキシー反応(ショックを含む)、
かゆみ、蕁麻疹、DRESS、AGEPを追記。
その他
対応済
米国FACT SHEETが改訂され、NIHガイドラインに従って、
アメリカ
DRUG INTERACTIONSの項に複数の薬剤が追記された。
その他
対応中
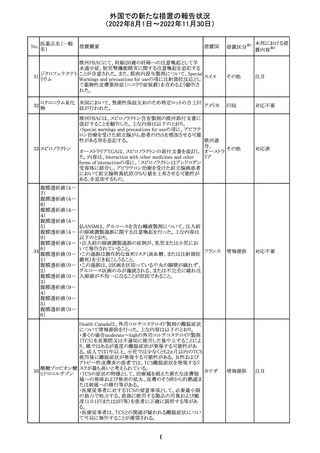
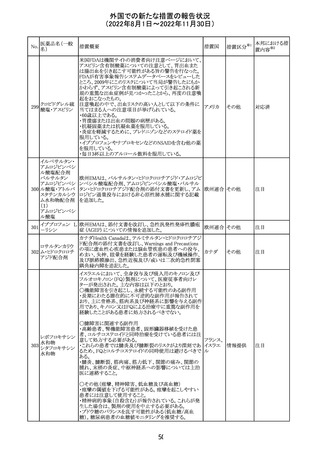
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・Warnings and Precautionsの胎児胚毒性の項の避妊期間
の表現が「final dose」の記載が「last dose」に書き換えられ
ペメトレキセドナト た。
リウム水和物
・Use in Specific Populationsの生殖能を有する者の項に、
111 ペメトレキセドナト 非臨床試験データに基づき、ペメトレキセドを妊婦に投与し アメリカ
リウムヘミペンタ た際に奇形や発育遅延を引き起こす可能性があること及び
水和物
ペメトレキセド注の投与開始前に妊娠状態を確認すること
が追記された。また、男性の避妊期間の表現が「final dose」
から「last dose」に書き換えられた。
・Pediatric Useの項に実施された臨床試験番号と被験者数
が追記された。
その他
対応済
108
110
ニルマトレルビ
ル・リトナビル
20