よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況 (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31510.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第4回 3/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
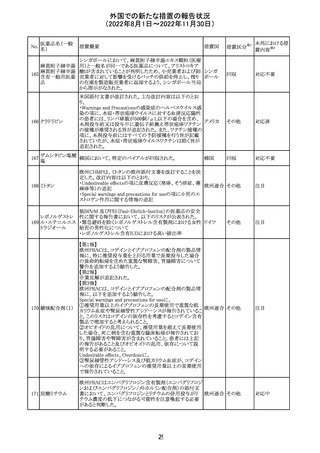
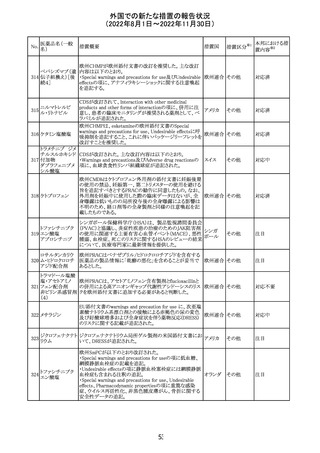
外国での新たな措置の報告状況
(2022年8月1日~2022年11月30日)
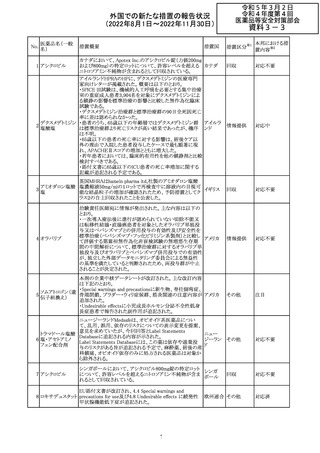
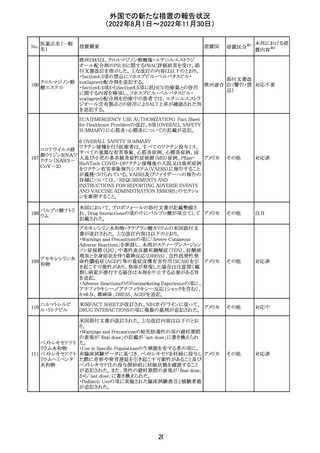
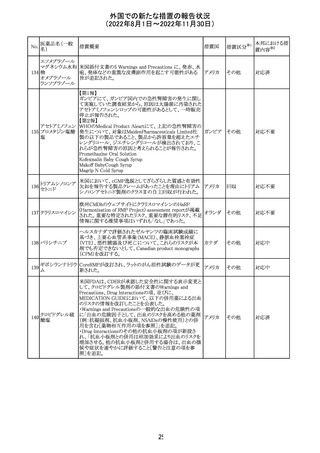
No.
医薬品名(一般
名)
措置国
措置区分※1
本邦における措
置内容※2
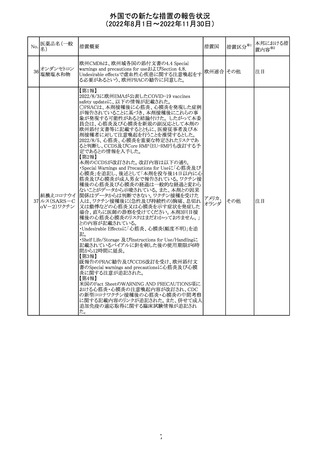
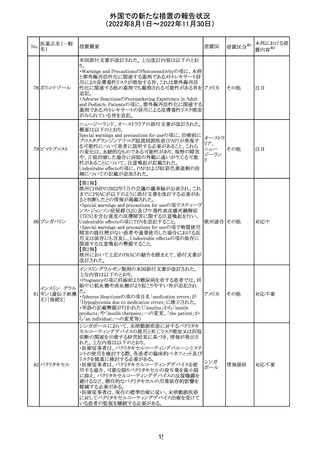
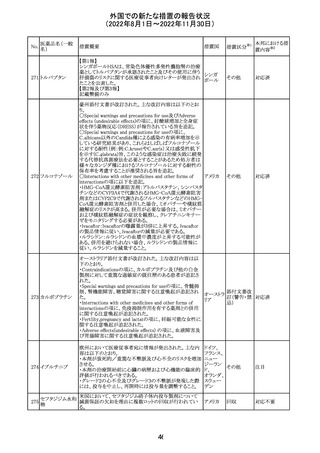
アメリカ
その他
注目
その他
注目
オーストラリアTGAにおいて、完全なジヒドロピリミジン脱水
素酵素欠損患者への投与に関する警告はすでに製品情
報に記載されていることに加え、部分的ジヒドロピリミジン脱 オーストラ
その他
水素酵素欠損患者についても生命を脅かす有害事象の発 リア
現リスクが高く、開始用量の減量を検討すべきである旨を
警告に記載することが推奨された。
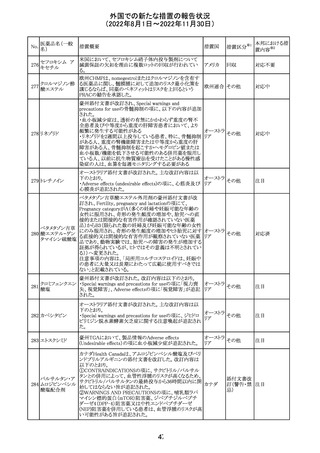
注目
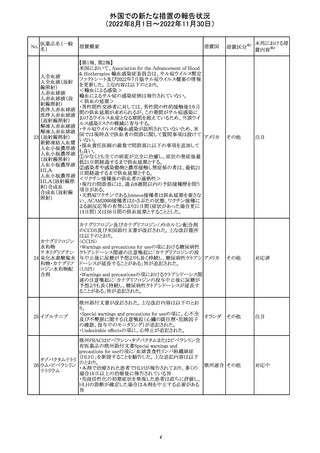
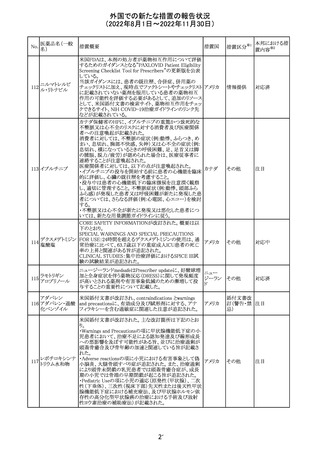
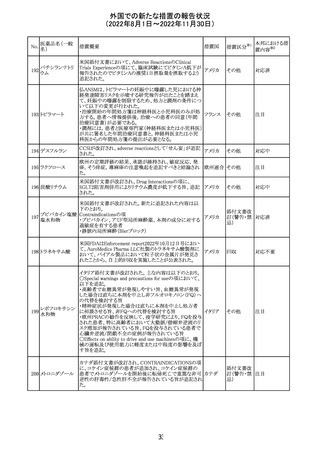
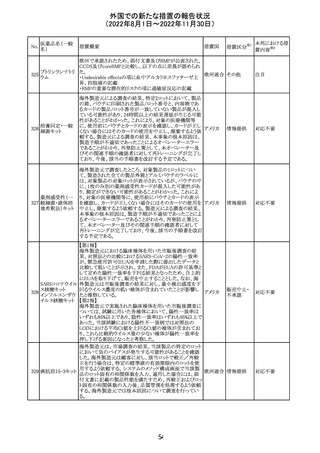
措置概要
米国本社よりABBREVIATED SUMMARY MONTHLY
SAFETY REPORT(期間:2022/7/16~2022/8/15)を入手
した。
3. SUMMARY OF SAFETY CONCERNS
重要な特定されたリスク:アナフィラキシー、心筋炎、心膜炎
重要な潜在的リスク:ワクチン接種に伴う疾患増強
(VAED)、ワクチン関連の呼吸器疾患増強(VAERD)、GBS
重要な不足情報:妊婦・授乳婦、免疫不全患者、基礎疾患
のある患者(COPD、糖尿病、慢性神経疾患、循環器疾
患、活動性結核など)、自己免疫疾患患者又は炎症性疾
患患者、他のワクチンとの相互作用、長期安全性データ、6
カ月未満の乳児、ワクチンの有効性
報告期間中に新たな安全性の懸念は表れていない。
4. OVERVIEW OF SAFETY SIGNALS DURING THE
REPORTING INTERVAL
報告対象期間中に新たに設定したシグナル:
コロナウイルス修
・浮動性めまい(Dizziness)→Identified Risk (Not
飾ウリジンRNAワ
131
Important)としてclosed
クチン(SARS-
・IgA腎症(IgA Nephropathy)→No Riskとしてclosed
CoV-2)
クローズされたシグナル:後天性血友病(Acquired
Hemophilia)、難聴(Hearing Loss)
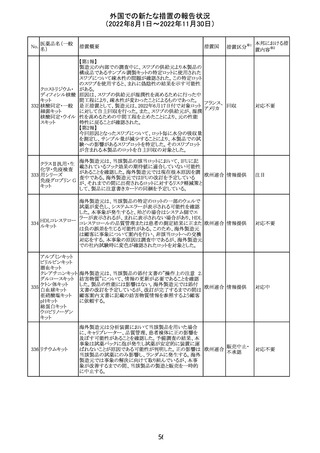
6. CONCLUSION AND ACTIONS
報告期間における利用可能な安全性及び有効性データに
基づくと、本剤のベネフィット・リスクプロファイルは引き続き
良好である。
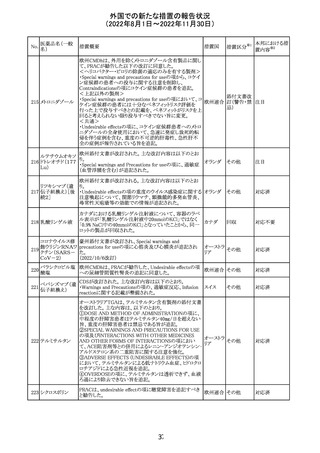
5~11歳小児のブースター投与(3回目)における心筋炎及
び心筋炎の集積データを反映するため、報告期間中に
CDS Version 13(2022/5/10改訂)中の「section 4.4
“Special warnings and precautions」が更新された。
集積安全性データ及びベネフィット・リスク解析の評価に基
づき、RSI(安全性参照情報)の変更や追加のリスク最小化
活動は必要とされない。
Marketing Authorization Holderは、すべての有害事象の
報告を含む本剤の安全性を引き続き検討し、安全性データ
の評価で重要な新たな情報が得られた場合には、製品文
書を改訂する。
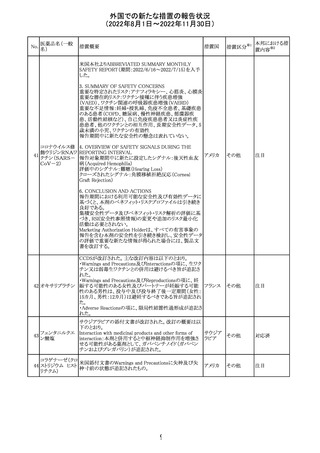
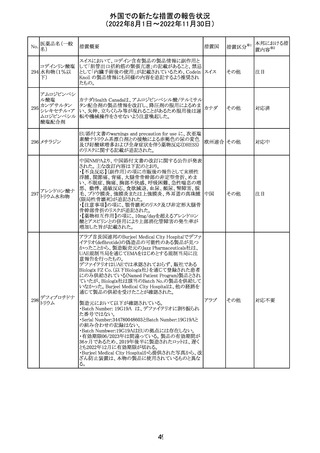
CDSが改訂され、Dosage and Administration及びWarnings
and Precautionsに免疫関連心膜障害(心膜炎、心嚢液貯
留、心タンポナーデ等)に関する以下の記載が追記され
た。
Dosage and Administration
・免疫関連心膜障害
重篤度がグレード2以上の場合、永久的に投与を中止す
アテゾリズマブ
132
る。
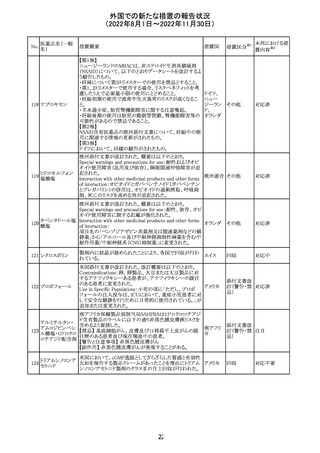
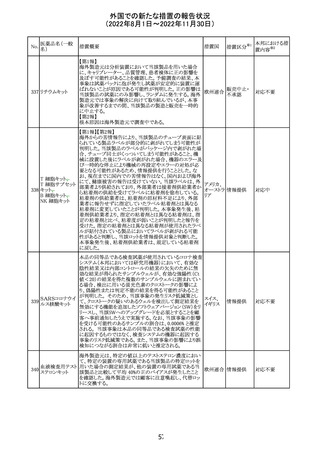
スイス
(遺伝子組換え)
Warnings and Precautions
・免疫関連心膜障害
心膜炎、心嚢液貯留、心タンポナーデなどの心膜障害が、
アテゾリズマブ(遺伝子組換え)の臨床試験で観察されてお
り、一部は致命的な転帰に至っている。心膜障害の臨床徴
候および症状がないか、患者をモニタリングする必要があ
る。
テガフール・ギメ
ラシル・オテラシ
ルカリウム配合剤
133 カペシタビン
テガフール・ウラ
シル
テガフール
24
(2022年8月1日~2022年11月30日)
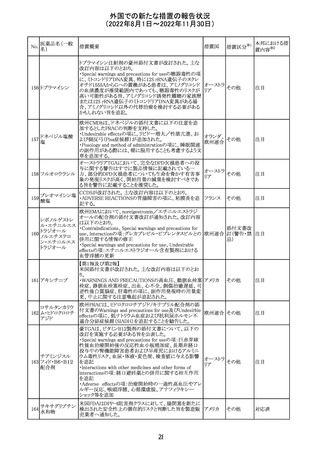
No.
医薬品名(一般
名)
措置国
措置区分※1
本邦における措
置内容※2
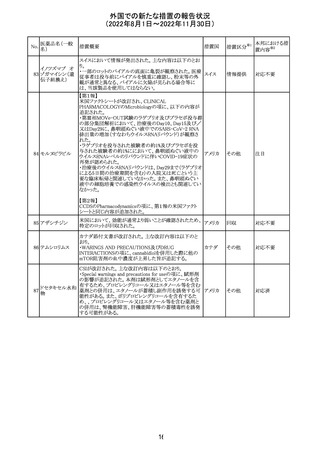
アメリカ
その他
注目
その他
注目
オーストラリアTGAにおいて、完全なジヒドロピリミジン脱水
素酵素欠損患者への投与に関する警告はすでに製品情
報に記載されていることに加え、部分的ジヒドロピリミジン脱 オーストラ
その他
水素酵素欠損患者についても生命を脅かす有害事象の発 リア
現リスクが高く、開始用量の減量を検討すべきである旨を
警告に記載することが推奨された。
注目
措置概要
米国本社よりABBREVIATED SUMMARY MONTHLY
SAFETY REPORT(期間:2022/7/16~2022/8/15)を入手
した。
3. SUMMARY OF SAFETY CONCERNS
重要な特定されたリスク:アナフィラキシー、心筋炎、心膜炎
重要な潜在的リスク:ワクチン接種に伴う疾患増強
(VAED)、ワクチン関連の呼吸器疾患増強(VAERD)、GBS
重要な不足情報:妊婦・授乳婦、免疫不全患者、基礎疾患
のある患者(COPD、糖尿病、慢性神経疾患、循環器疾
患、活動性結核など)、自己免疫疾患患者又は炎症性疾
患患者、他のワクチンとの相互作用、長期安全性データ、6
カ月未満の乳児、ワクチンの有効性
報告期間中に新たな安全性の懸念は表れていない。
4. OVERVIEW OF SAFETY SIGNALS DURING THE
REPORTING INTERVAL
報告対象期間中に新たに設定したシグナル:
コロナウイルス修
・浮動性めまい(Dizziness)→Identified Risk (Not
飾ウリジンRNAワ
131
Important)としてclosed
クチン(SARS-
・IgA腎症(IgA Nephropathy)→No Riskとしてclosed
CoV-2)
クローズされたシグナル:後天性血友病(Acquired
Hemophilia)、難聴(Hearing Loss)
6. CONCLUSION AND ACTIONS
報告期間における利用可能な安全性及び有効性データに
基づくと、本剤のベネフィット・リスクプロファイルは引き続き
良好である。
5~11歳小児のブースター投与(3回目)における心筋炎及
び心筋炎の集積データを反映するため、報告期間中に
CDS Version 13(2022/5/10改訂)中の「section 4.4
“Special warnings and precautions」が更新された。
集積安全性データ及びベネフィット・リスク解析の評価に基
づき、RSI(安全性参照情報)の変更や追加のリスク最小化
活動は必要とされない。
Marketing Authorization Holderは、すべての有害事象の
報告を含む本剤の安全性を引き続き検討し、安全性データ
の評価で重要な新たな情報が得られた場合には、製品文
書を改訂する。
CDSが改訂され、Dosage and Administration及びWarnings
and Precautionsに免疫関連心膜障害(心膜炎、心嚢液貯
留、心タンポナーデ等)に関する以下の記載が追記され
た。
Dosage and Administration
・免疫関連心膜障害
重篤度がグレード2以上の場合、永久的に投与を中止す
アテゾリズマブ
132
る。
スイス
(遺伝子組換え)
Warnings and Precautions
・免疫関連心膜障害
心膜炎、心嚢液貯留、心タンポナーデなどの心膜障害が、
アテゾリズマブ(遺伝子組換え)の臨床試験で観察されてお
り、一部は致命的な転帰に至っている。心膜障害の臨床徴
候および症状がないか、患者をモニタリングする必要があ
る。
テガフール・ギメ
ラシル・オテラシ
ルカリウム配合剤
133 カペシタビン
テガフール・ウラ
シル
テガフール
24