よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況 (48 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31510.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第4回 3/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
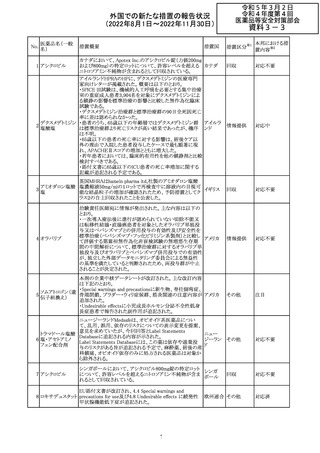
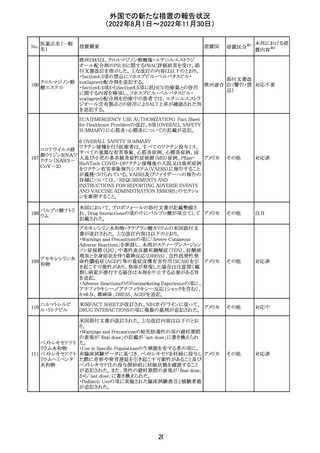
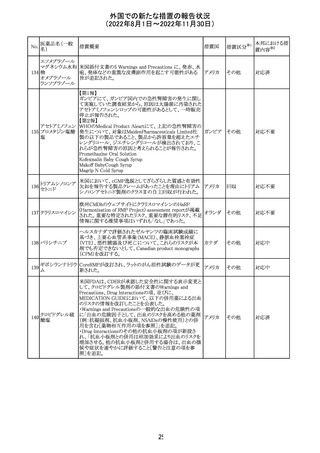
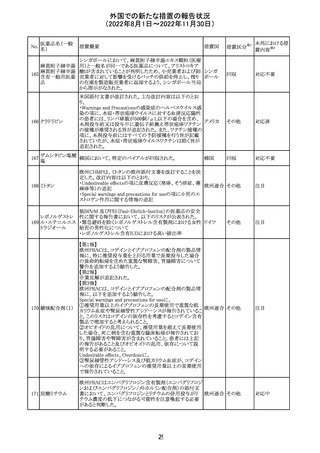
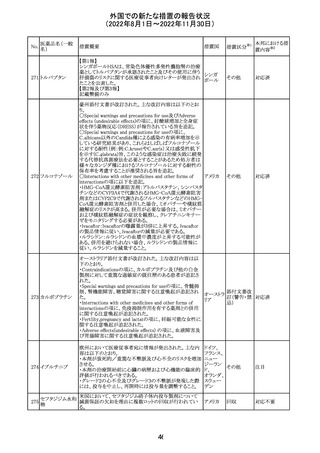
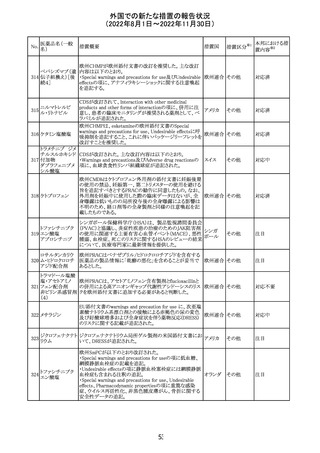
外国での新たな措置の報告状況
(2022年8月1日~2022年11月30日)
措置区分※1
本邦における措
置内容※2
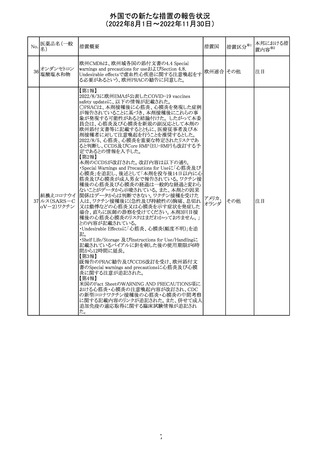
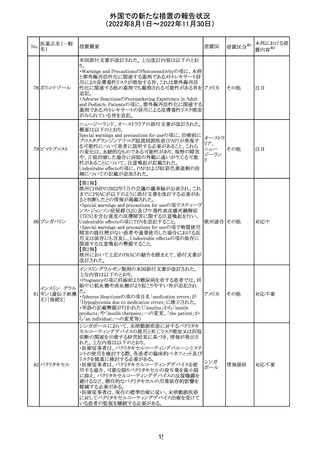
CDSが改訂された。主な改訂内容は以下のとおり。
・Undesirable effectsの項から、「陽性の抗核抗体からなる
狼瘡様症候群」と、その症状を削除。
ミノサイクリン塩酸 ・Special warnings and precautions for useの項に、陽性の
285
アメリカ
塩
抗核抗体、関節痛、関節炎、関節のこわばり、または関節
の腫れからなる狼瘡様症候群が、ミノサイクリンで、特に皮
膚疾患の長期維持療法(例えば、>6カ月)を受けている患
者で報告されている旨を追加。
その他
注目
米国FDAは、ピタバスタチンの添付文書を改訂した。改訂
内容は以下のとおり。
①Warnings and Precautionsの項の、ミオパチー及び横紋
筋融解症、免疫介在性壊死性ミオパチー、肝機能障害が
ピタバスタチンカ
286
記載整備された。
アメリカ
ルシウム
②Adverse Reactionsの項に、Postmarketing Experienceと
して、扁平苔癬が追加された。
③Use in Specific Populationsの項における妊婦、授乳婦、
高齢者、腎障害患者、肝障害患者の記載が整備された。
その他
注目
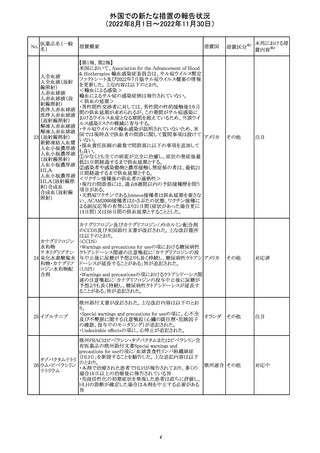
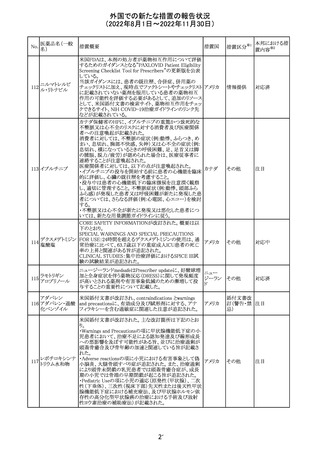
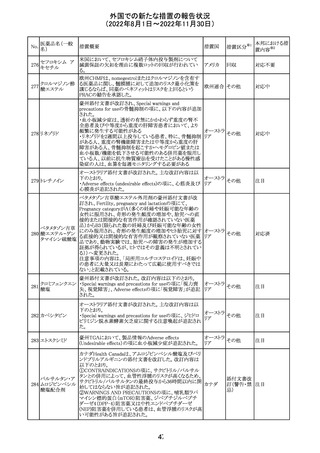
No.
医薬品名(一般
名)
措置概要
措置国
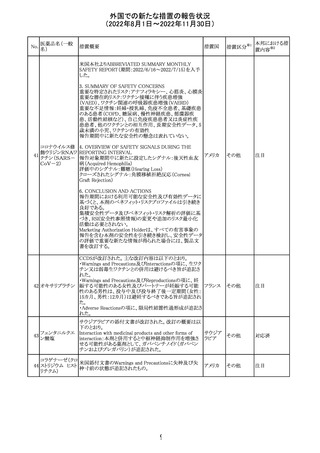
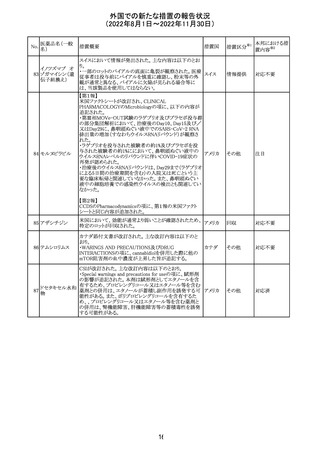
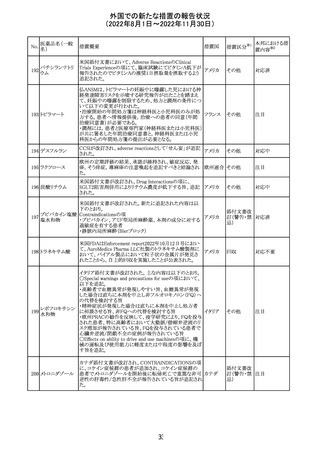
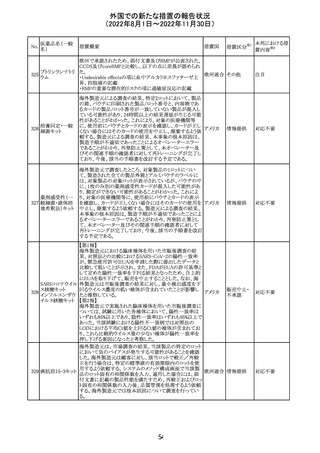
豪州添付文書が改訂された。改訂の概要は以下のとおり。
・Special warnings and precautions for useの項の腎障害の
注意喚起に、本剤による腎障害の病態、成因や、シクロス
ポリンとの切り替え時にあけるべき間隔などより詳しい記載
が追記
・Special warnings and precautions for useの項に血栓性微 オーストラ
その他
小血管症が追記
リア
・Interaction with other medicinal products and other forms
of interactionの項に本剤による血栓性微小血管症のリスク
は哺乳類ラパマイシン標的蛋白質(mTOR)阻害剤(例:シ
ロリムス、エベロリムスなど)との併用で高まる可能性がある
旨が追記
対応中
中国において、輸入されるデュタステリド軟カプセルの検査
が登録基準に準じて実施されていなかったため、微生物汚
中国
染リスクの予防及び管理に不足があることから、輸入、販
売、及び使用を一時停止することとなった。
その他
対応不要
回収
対応不要
米国添付文書が改訂された。主な改訂内容は以下のとお
ベンダムスチン塩 り。
290
アメリカ
酸塩
・Adverse ReactionsのPostmarketing Experienceの項に、腎
性尿崩症が追記された。
その他
注目
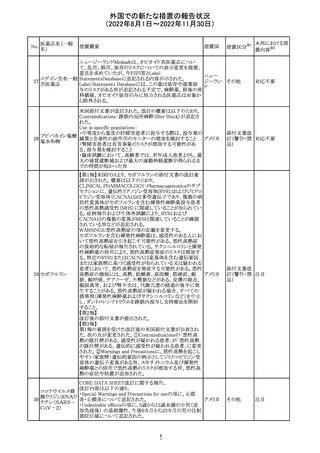
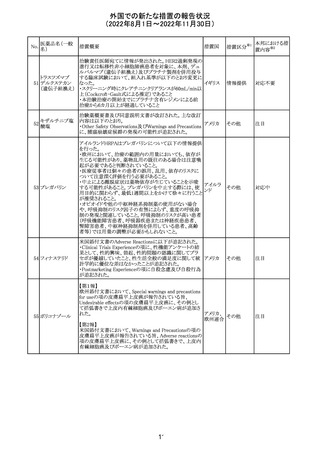
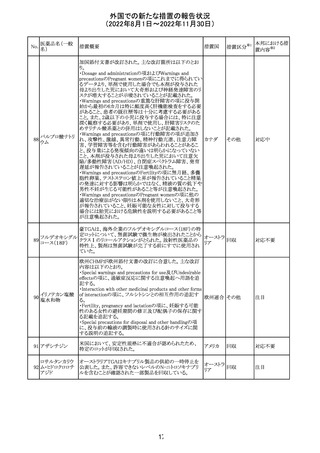
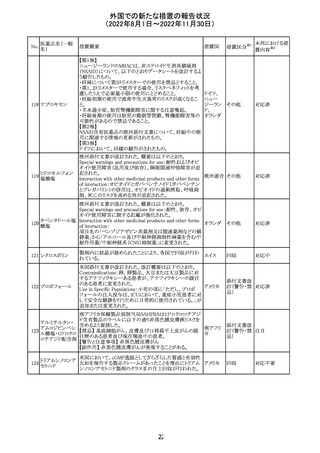
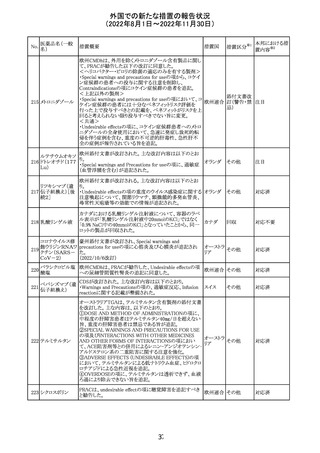
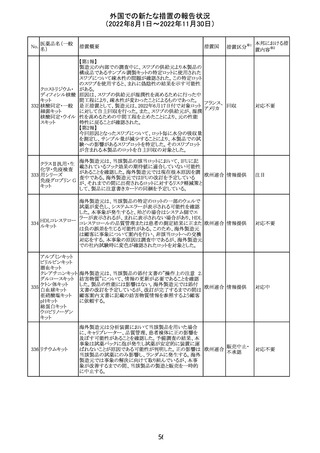
オメプラゾール/炭酸水素ナトリウム配合剤の米国添付文書
炭酸水素ナトリウ のWarningsの項に「オメプラゾールは、皮膚の発赤、水ぶく
291
アメリカ
ム
れ、発疹重度の皮膚反応を引き起こす可能性がある旨が
追記された。
その他
対応不要
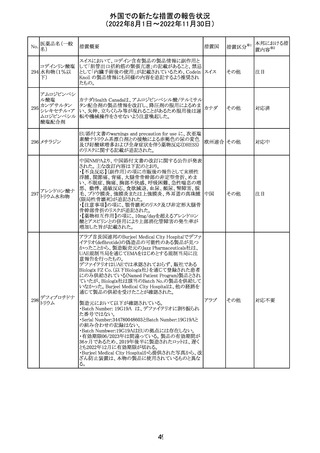
292 デスフルラン
米国添付文書が改訂され、次の点が変更された。Warnings
and Precautionsに①悪性高熱を起こしやすい家族歴・遺伝
的要因の例示としてリアノジン受容体又はジヒドロピリジン
アメリカ
受容体の遺伝子変異が追加され、②スキサメトニウム及び
揮発性麻酔薬との併用で悪性高熱のリスクが増加する旨、
悪性高熱の症状や処置が追加された。
その他
注目
293 アパルタミド
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・Dose Modificationの項に、脳血管障害及び虚血性心疾
患、並びに重度の皮膚障害が発現した際の用量調節基準
が追記された。
アメリカ
・Warning and Precautions及びAdverse Reactionsの項に、
重度の皮膚障害(スティーヴンス・ジョンソン症候群、中毒
性表皮壊死融解症、好酸球増加と全身症状を伴う薬物反
応)が追記された。
その他
対応中
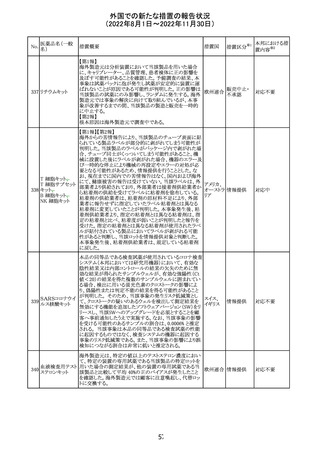
287
タクロリムス水和
物
288 デュタステリド
289
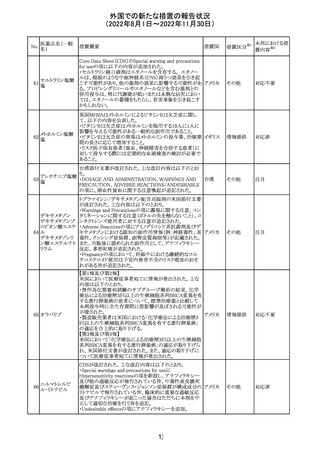
トロピカミド・フェ 米国においてフェニレフリンを含む製品に対する無菌性の
アメリカ
ニレフリン塩酸塩 保証の欠如によるClassⅡの製品回収が行われた。
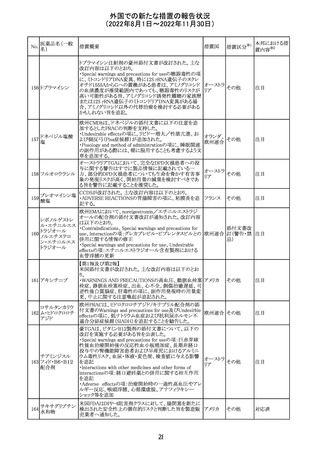
48
(2022年8月1日~2022年11月30日)
措置区分※1
本邦における措
置内容※2
CDSが改訂された。主な改訂内容は以下のとおり。
・Undesirable effectsの項から、「陽性の抗核抗体からなる
狼瘡様症候群」と、その症状を削除。
ミノサイクリン塩酸 ・Special warnings and precautions for useの項に、陽性の
285
アメリカ
塩
抗核抗体、関節痛、関節炎、関節のこわばり、または関節
の腫れからなる狼瘡様症候群が、ミノサイクリンで、特に皮
膚疾患の長期維持療法(例えば、>6カ月)を受けている患
者で報告されている旨を追加。
その他
注目
米国FDAは、ピタバスタチンの添付文書を改訂した。改訂
内容は以下のとおり。
①Warnings and Precautionsの項の、ミオパチー及び横紋
筋融解症、免疫介在性壊死性ミオパチー、肝機能障害が
ピタバスタチンカ
286
記載整備された。
アメリカ
ルシウム
②Adverse Reactionsの項に、Postmarketing Experienceと
して、扁平苔癬が追加された。
③Use in Specific Populationsの項における妊婦、授乳婦、
高齢者、腎障害患者、肝障害患者の記載が整備された。
その他
注目
No.
医薬品名(一般
名)
措置概要
措置国
豪州添付文書が改訂された。改訂の概要は以下のとおり。
・Special warnings and precautions for useの項の腎障害の
注意喚起に、本剤による腎障害の病態、成因や、シクロス
ポリンとの切り替え時にあけるべき間隔などより詳しい記載
が追記
・Special warnings and precautions for useの項に血栓性微 オーストラ
その他
小血管症が追記
リア
・Interaction with other medicinal products and other forms
of interactionの項に本剤による血栓性微小血管症のリスク
は哺乳類ラパマイシン標的蛋白質(mTOR)阻害剤(例:シ
ロリムス、エベロリムスなど)との併用で高まる可能性がある
旨が追記
対応中
中国において、輸入されるデュタステリド軟カプセルの検査
が登録基準に準じて実施されていなかったため、微生物汚
中国
染リスクの予防及び管理に不足があることから、輸入、販
売、及び使用を一時停止することとなった。
その他
対応不要
回収
対応不要
米国添付文書が改訂された。主な改訂内容は以下のとお
ベンダムスチン塩 り。
290
アメリカ
酸塩
・Adverse ReactionsのPostmarketing Experienceの項に、腎
性尿崩症が追記された。
その他
注目
オメプラゾール/炭酸水素ナトリウム配合剤の米国添付文書
炭酸水素ナトリウ のWarningsの項に「オメプラゾールは、皮膚の発赤、水ぶく
291
アメリカ
ム
れ、発疹重度の皮膚反応を引き起こす可能性がある旨が
追記された。
その他
対応不要
292 デスフルラン
米国添付文書が改訂され、次の点が変更された。Warnings
and Precautionsに①悪性高熱を起こしやすい家族歴・遺伝
的要因の例示としてリアノジン受容体又はジヒドロピリジン
アメリカ
受容体の遺伝子変異が追加され、②スキサメトニウム及び
揮発性麻酔薬との併用で悪性高熱のリスクが増加する旨、
悪性高熱の症状や処置が追加された。
その他
注目
293 アパルタミド
米国添付文書が改訂された。主な改訂内容は以下のとお
り。
・Dose Modificationの項に、脳血管障害及び虚血性心疾
患、並びに重度の皮膚障害が発現した際の用量調節基準
が追記された。
アメリカ
・Warning and Precautions及びAdverse Reactionsの項に、
重度の皮膚障害(スティーヴンス・ジョンソン症候群、中毒
性表皮壊死融解症、好酸球増加と全身症状を伴う薬物反
応)が追記された。
その他
対応中
287
タクロリムス水和
物
288 デュタステリド
289
トロピカミド・フェ 米国においてフェニレフリンを含む製品に対する無菌性の
アメリカ
ニレフリン塩酸塩 保証の欠如によるClassⅡの製品回収が行われた。
48