よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況 (47 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31510.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第4回 3/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
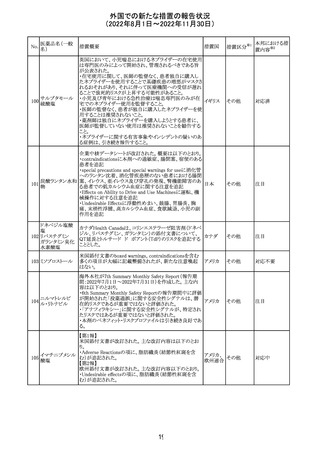
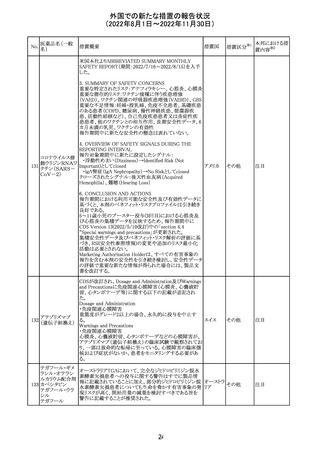
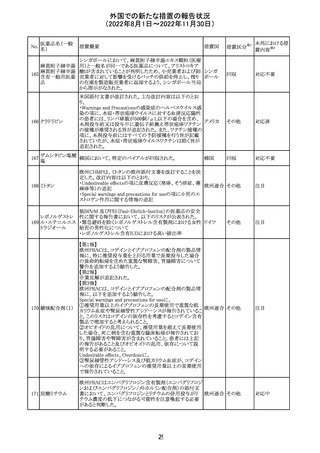
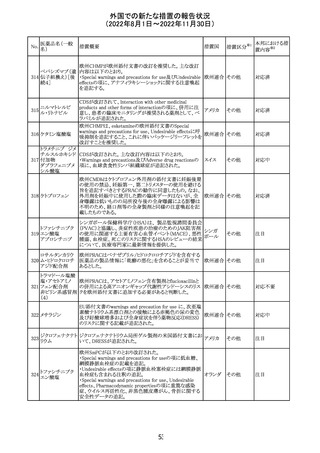
外国での新たな措置の報告状況
(2022年8月1日~2022年11月30日)
措置国
措置区分※1
本邦における措
置内容※2
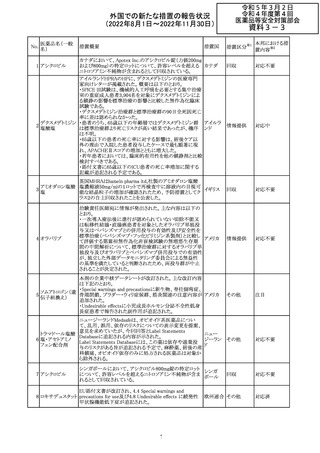
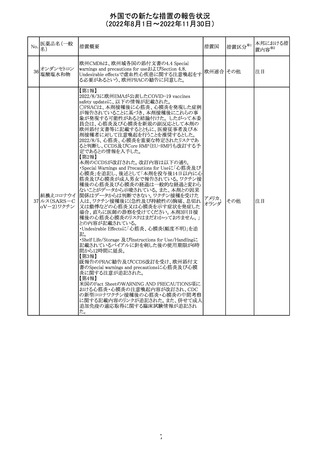
アメリカ
回収
対応不要
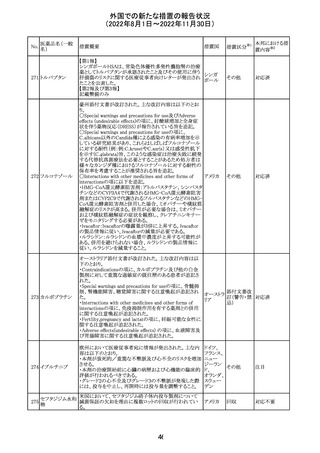
No.
医薬品名(一般
名)
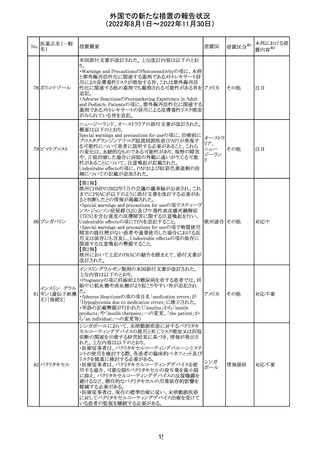
276
米国において、セフロキシム硝子体内投与製剤について
セフロキシム ア
滅菌保証の欠如を理由に複数ロットの回収が行われてい
キセチル
る。
277
欧州CHMPは、nomegestrolまたはクロルマジノンを含有す
クロルマジノン酢 る医薬品に関し、髄膜腫に対して追加のリスク最小化策を
欧州連合 その他
酸エステル
講じるならば、同薬のベネフィットはリスクを上回るという
PRACの勧告を承認した。
対応中
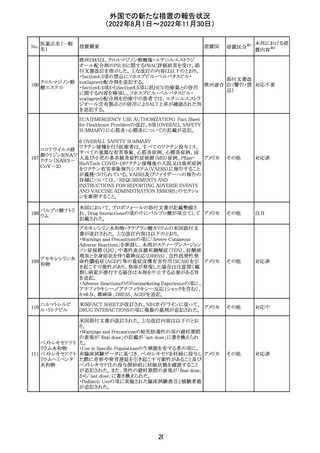
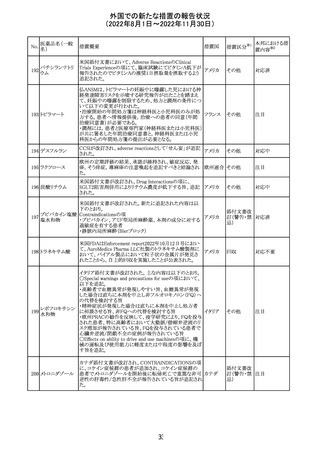
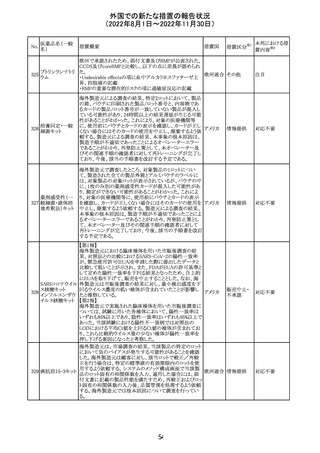
278 リネゾリド
豪州添付文書が改訂され、Special warnings and
precautions for useの骨髄抑制の項に、以下の内容が追加
された。
・血小板減少症は、透析の有無にかかわらず重度の腎不
全患者及び中等度から重度の肝障害患者において、より
頻繁に発生する可能性がある
オーストラ
その他
・リネゾリドを2週間以上投与している患者、特に、骨髄抑制 リア
がある人、重度の腎機能障害または中等度から重度の肝
障害がある人、骨髄抑制を起こすかヘモグロビン値または
血小板数/機能を低下させる可能性のある併用薬を服用し
ている人、以前に抗生物質療法を受けたことがある慢性感
染症の人は、血算を毎週モニタリングする必要がある
対応中
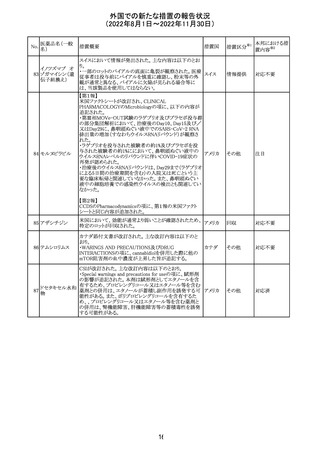
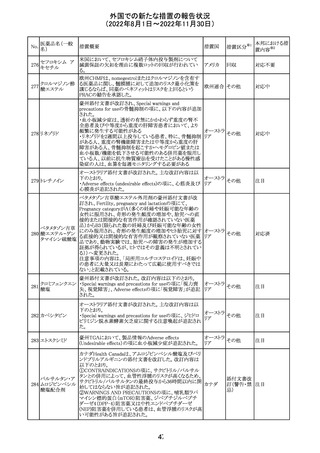
279 トレチノイン
オーストラリア添付文書が改訂された。主な改訂内容は以
下のとおり。
オーストラ
その他
・Adverse effects (undesirable effects)の項に、心筋炎及び リア
心膜炎が追記された。
注目
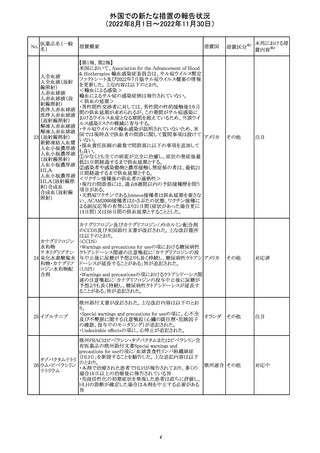
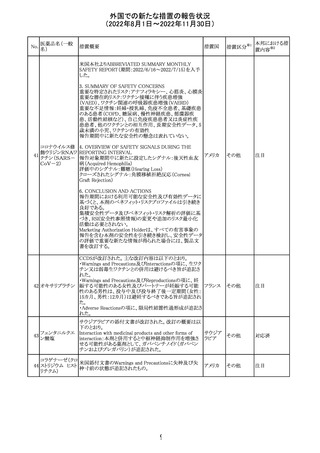
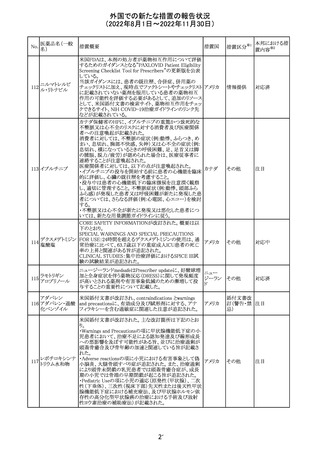
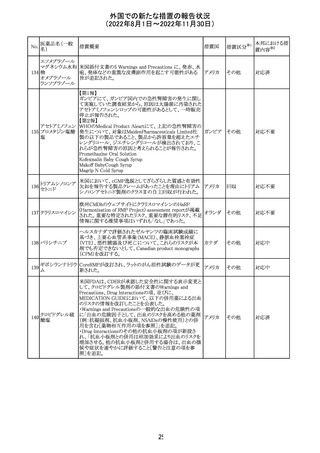
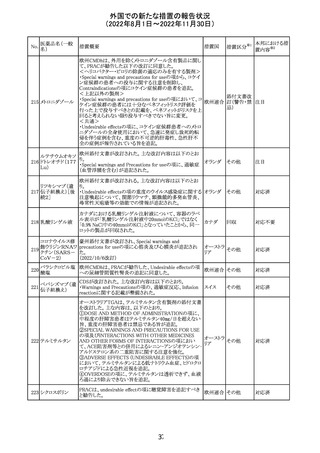
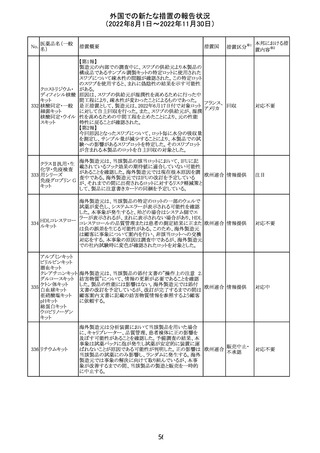
措置概要
ベタメタゾン吉草酸エステル外用剤の豪州添付文書が改
訂され、Fertility, pregnancy and lactationの項にて、
Pregnancy categoryがA(多くの妊婦や妊娠可能な年齢の
女性に服用され、奇形の発生頻度の増加や、胎児への直
接的または間接的な有害作用が確認されていない医薬
品)からB3(限られた数の妊婦及び妊娠可能な年齢の女性
ベタメタゾン吉草
にのみ服用され、奇形の発生頻度の増加やヒト胎児に対す オーストラ
280 酸エステル・ゲン
その他
る直接的又は間接的な有害作用が観察されていない医薬 リア
タマイシン硫酸塩
品であり、動物実験では、胎児への障害の発生が増加する
証拠が得られているが、ヒトではその意義は不明とされてい
る))へ変更された。
注意事項の内容は、「局所用コルチコステロイドは、妊娠中
の患者に大量又は長期にわたって広範に使用すべきでは
ない」と記載されている。
対応済
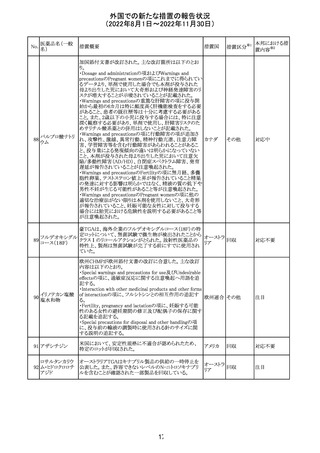
豪州添付文書が改訂された。改訂内容は以下のとおり。
クロミフェンクエン ・Special warnings and precautions for useの項に「視力喪 オーストラ
その他
酸塩
失、視覚障害」、Adverse effectsの項に「視覚障害」が追記 リア
された。
注目
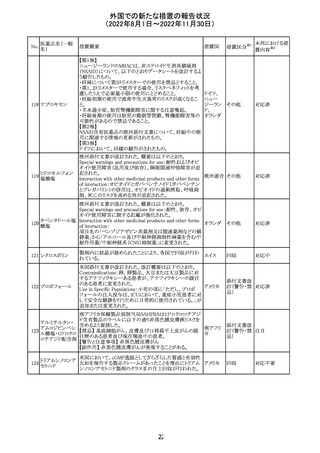
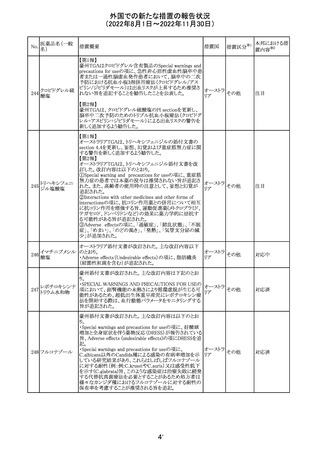
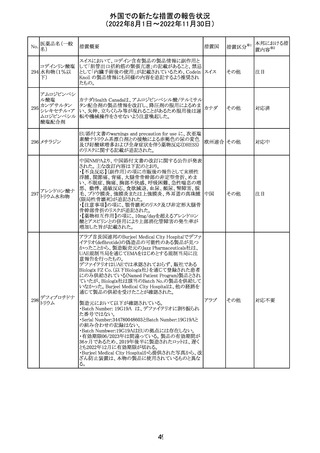
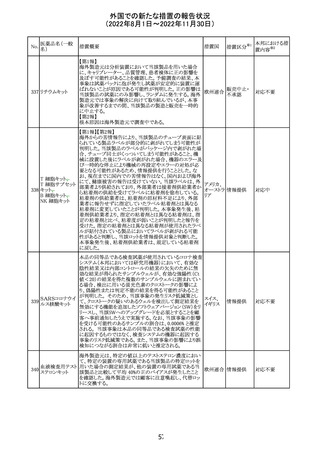
282 カペシタビン
オーストラリア添付文書が改訂された。主な改訂内容は以
下のとおり。
オーストラ
・Special warnings and precautions for useの項に、ジヒドロ
その他
リア
ピリミジン脱水素酵素欠乏症に関する注意喚起が追記され
た。
注目
283 エトスクシミド
豪州TGAにおいて、製品情報のAdverse effects
オーストラ
その他
(Undesirable effects)の項に血小板減少症が追記された。 リア
注目
281
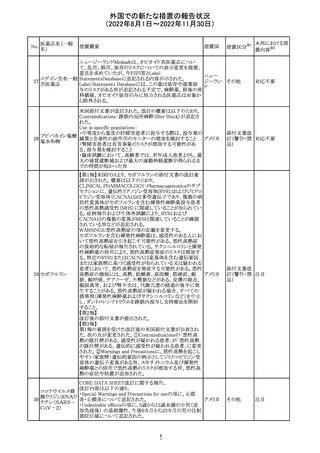
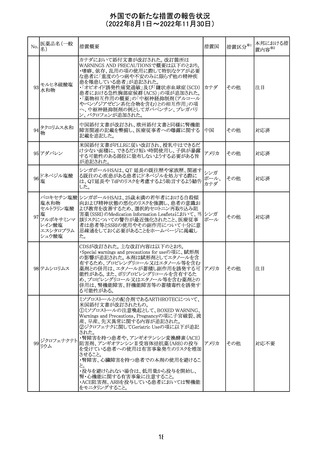
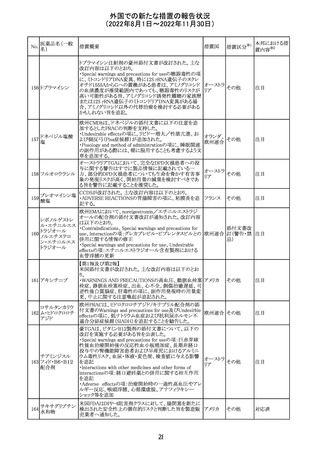
カナダHealth Canadaは、アムロジピンベシル酸塩及びペリ
ンドプリルアルギニンの添付文書を改訂した。改訂内容は
以下のとおり。
①CONTRAINDICATIONSの項に、サクビトリル/バルサル
タンとの併用によって、血管性浮腫のリスクが高くなるため、
バルサルタン・ア
サクビトリル/バルサルタンの最終投与から36時間以内に開
284 ムロジピンベシル
カナダ
始してはならない旨が追記された。
酸塩配合剤
②WARNINGS AND PRECAUTIONSの項に、哺乳類ラパ
マイシン標的蛋白(mTOR)阻害薬、ジペプチジルペプチ
ダーゼ4(DPP‐4)阻害薬又は中性エンドペプチダーゼ
(NEP)阻害薬を併用している患者は、血管浮腫のリスクが高
い可能性がある旨が追記された。
47
添付文書改
訂(警告・禁 注目
忌)
(2022年8月1日~2022年11月30日)
措置国
措置区分※1
本邦における措
置内容※2
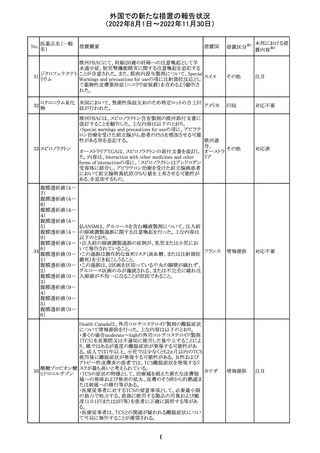
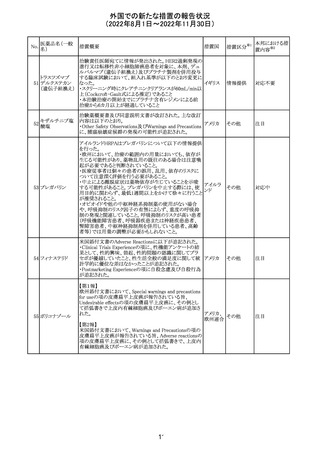
アメリカ
回収
対応不要
No.
医薬品名(一般
名)
276
米国において、セフロキシム硝子体内投与製剤について
セフロキシム ア
滅菌保証の欠如を理由に複数ロットの回収が行われてい
キセチル
る。
277
欧州CHMPは、nomegestrolまたはクロルマジノンを含有す
クロルマジノン酢 る医薬品に関し、髄膜腫に対して追加のリスク最小化策を
欧州連合 その他
酸エステル
講じるならば、同薬のベネフィットはリスクを上回るという
PRACの勧告を承認した。
対応中
278 リネゾリド
豪州添付文書が改訂され、Special warnings and
precautions for useの骨髄抑制の項に、以下の内容が追加
された。
・血小板減少症は、透析の有無にかかわらず重度の腎不
全患者及び中等度から重度の肝障害患者において、より
頻繁に発生する可能性がある
オーストラ
その他
・リネゾリドを2週間以上投与している患者、特に、骨髄抑制 リア
がある人、重度の腎機能障害または中等度から重度の肝
障害がある人、骨髄抑制を起こすかヘモグロビン値または
血小板数/機能を低下させる可能性のある併用薬を服用し
ている人、以前に抗生物質療法を受けたことがある慢性感
染症の人は、血算を毎週モニタリングする必要がある
対応中
279 トレチノイン
オーストラリア添付文書が改訂された。主な改訂内容は以
下のとおり。
オーストラ
その他
・Adverse effects (undesirable effects)の項に、心筋炎及び リア
心膜炎が追記された。
注目
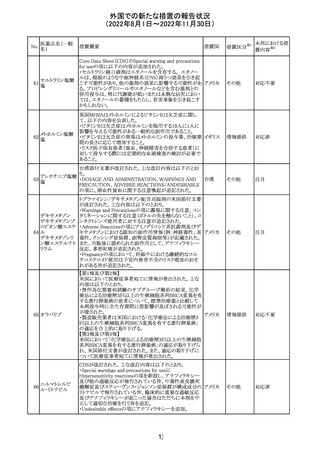
措置概要
ベタメタゾン吉草酸エステル外用剤の豪州添付文書が改
訂され、Fertility, pregnancy and lactationの項にて、
Pregnancy categoryがA(多くの妊婦や妊娠可能な年齢の
女性に服用され、奇形の発生頻度の増加や、胎児への直
接的または間接的な有害作用が確認されていない医薬
品)からB3(限られた数の妊婦及び妊娠可能な年齢の女性
ベタメタゾン吉草
にのみ服用され、奇形の発生頻度の増加やヒト胎児に対す オーストラ
280 酸エステル・ゲン
その他
る直接的又は間接的な有害作用が観察されていない医薬 リア
タマイシン硫酸塩
品であり、動物実験では、胎児への障害の発生が増加する
証拠が得られているが、ヒトではその意義は不明とされてい
る))へ変更された。
注意事項の内容は、「局所用コルチコステロイドは、妊娠中
の患者に大量又は長期にわたって広範に使用すべきでは
ない」と記載されている。
対応済
豪州添付文書が改訂された。改訂内容は以下のとおり。
クロミフェンクエン ・Special warnings and precautions for useの項に「視力喪 オーストラ
その他
酸塩
失、視覚障害」、Adverse effectsの項に「視覚障害」が追記 リア
された。
注目
282 カペシタビン
オーストラリア添付文書が改訂された。主な改訂内容は以
下のとおり。
オーストラ
・Special warnings and precautions for useの項に、ジヒドロ
その他
リア
ピリミジン脱水素酵素欠乏症に関する注意喚起が追記され
た。
注目
283 エトスクシミド
豪州TGAにおいて、製品情報のAdverse effects
オーストラ
その他
(Undesirable effects)の項に血小板減少症が追記された。 リア
注目
281
カナダHealth Canadaは、アムロジピンベシル酸塩及びペリ
ンドプリルアルギニンの添付文書を改訂した。改訂内容は
以下のとおり。
①CONTRAINDICATIONSの項に、サクビトリル/バルサル
タンとの併用によって、血管性浮腫のリスクが高くなるため、
バルサルタン・ア
サクビトリル/バルサルタンの最終投与から36時間以内に開
284 ムロジピンベシル
カナダ
始してはならない旨が追記された。
酸塩配合剤
②WARNINGS AND PRECAUTIONSの項に、哺乳類ラパ
マイシン標的蛋白(mTOR)阻害薬、ジペプチジルペプチ
ダーゼ4(DPP‐4)阻害薬又は中性エンドペプチダーゼ
(NEP)阻害薬を併用している患者は、血管浮腫のリスクが高
い可能性がある旨が追記された。
47
添付文書改
訂(警告・禁 注目
忌)