よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31510.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第4回 3/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
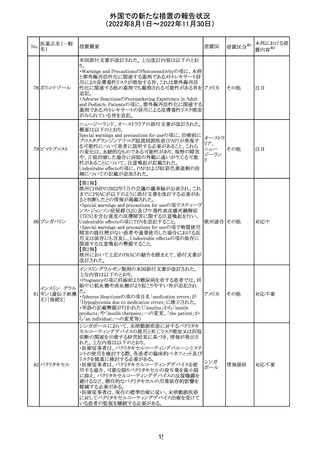
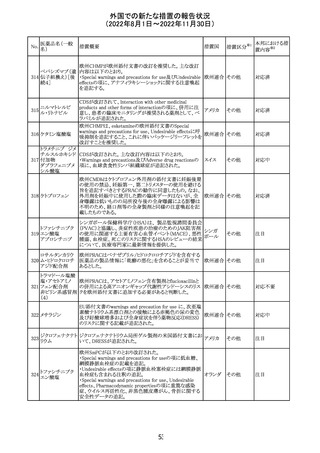
外国での新たな措置の報告状況
(2022年8月1日~2022年11月30日)
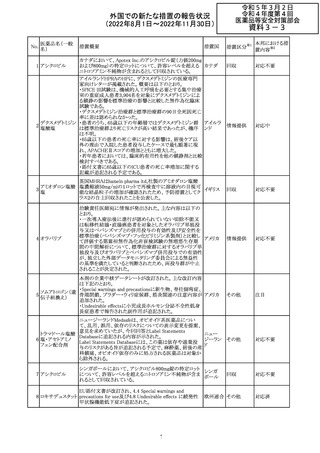
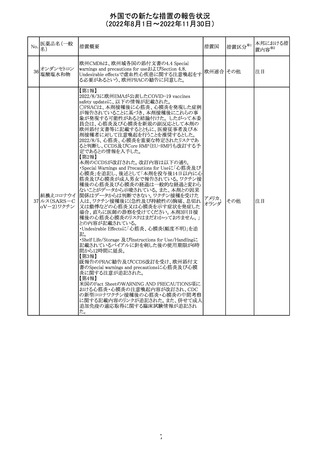
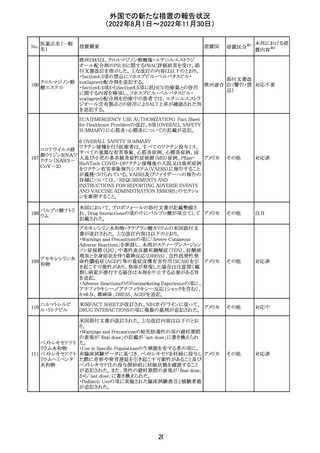
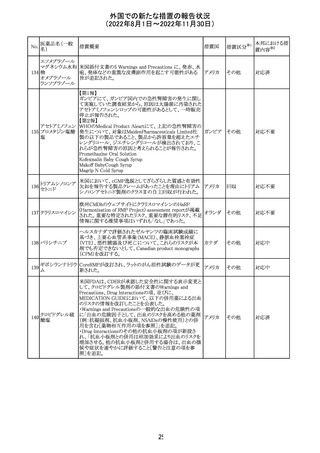
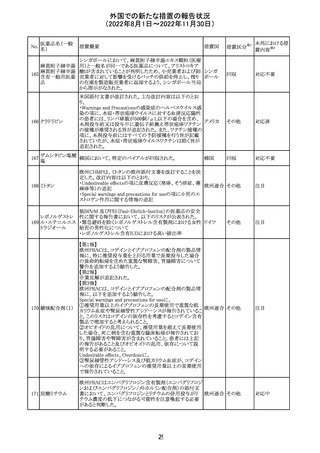
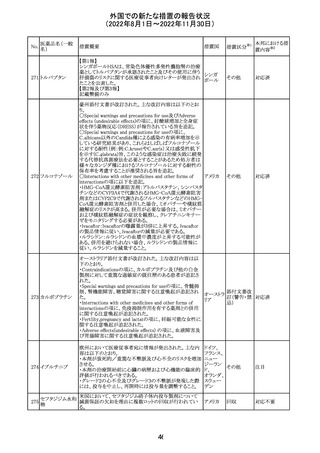
No.
医薬品名(一般
名)
d-クロルフェニラ
ミンマレイン酸塩
クロルフェニラミン
9
マレイン酸塩
プロメタジン塩酸
塩
措置概要
措置国
措置区分※1
豪州TGAにおいて、第1世代抗ヒスタミン薬について、6歳
未満の小児の咳、風邪、インフルエンザ症状の治療に使用 オーストラ
その他
すべきでないこと、2歳未満の小児にはいかなる適応に対し リア
ても投与すべきでないことが勧告された。
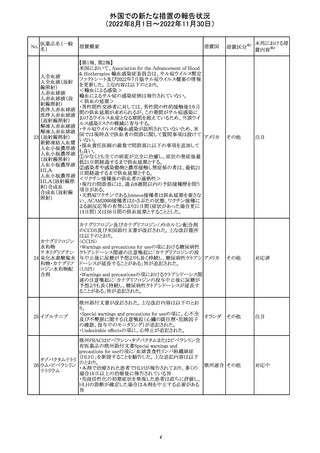
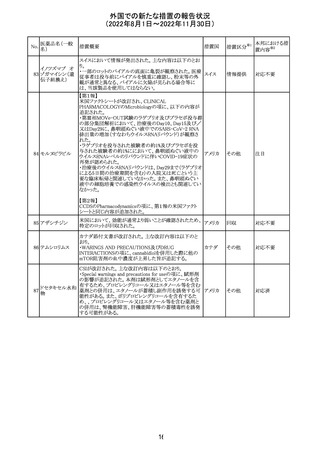
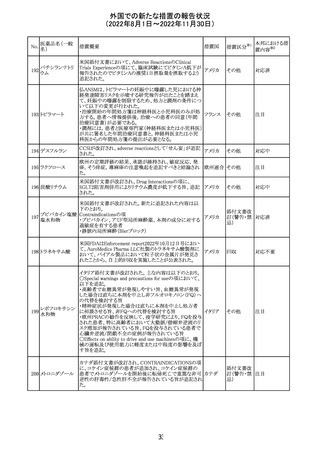
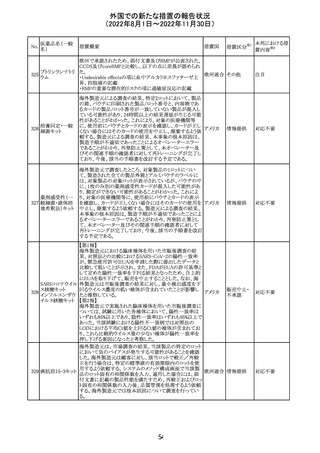
CCDSが改訂された。主な改訂内容は以下のとおり。
・PHARMACODYNAMIC PROPERTIESの項において、オミ
クロン株の下位系統であるBA.2、BA.2.12.1及び
BA.4/BA.5系統に対して中和活性が低下したとのin vitro
データを追記。
・DOSAGE AND ADMINISTRATIONの項において、オミク
ロン株の下位系統であるBA.2、BA.2.12.1及びBA.4/BA.5
カシリビマブ(遺
系統の流行地における用量は4800mg(カシリビマブ2,400
伝子組換え)・イ
10
mg、イムデビマブ2,400 mg)である旨を追記。
スイス
ムデビマブ(遺伝
・WARNINGS AND PRECAUTIONSのHypersensitivity
子組換え)
including Anaphylaxis and Infusion-Related Reactionsの項
に、米国での緊急時使用において痙攣性失神の症例が認
められている旨、痙攣性失神は、発作と区別して臨床的に
適切な管理を行う必要がある旨を追記。
・UNDESIRABLE EFFECTS のEmergency Use Experience
の項に、米国での緊急時使用において、静脈内投与及び
皮下投与により痙攣性失神の症例が認められた旨を追記。
その他
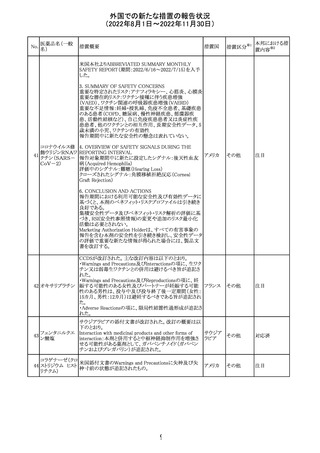
本邦における措
置内容※2
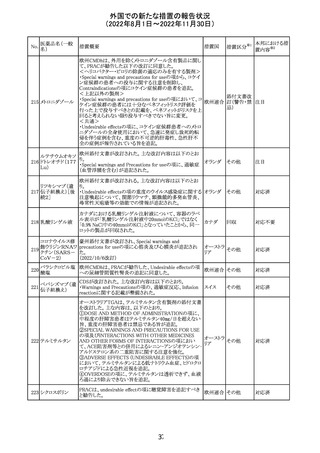
注目
注目
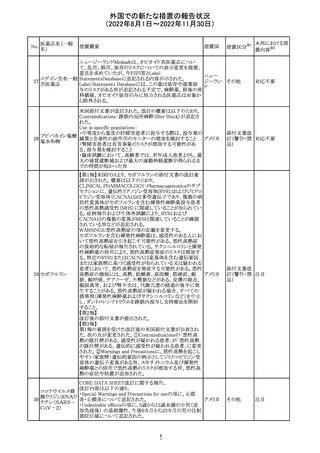
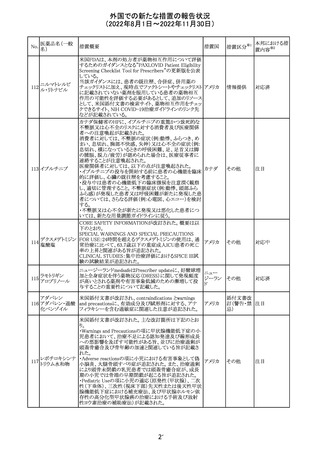
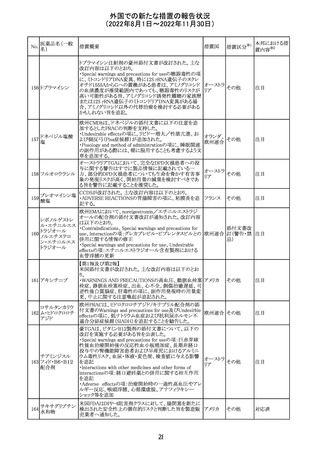
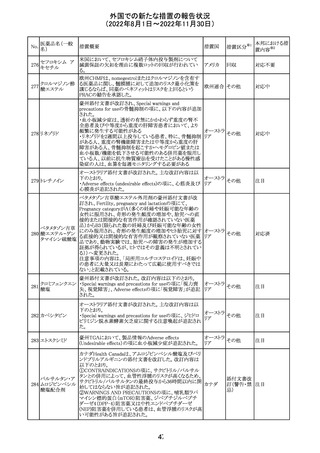
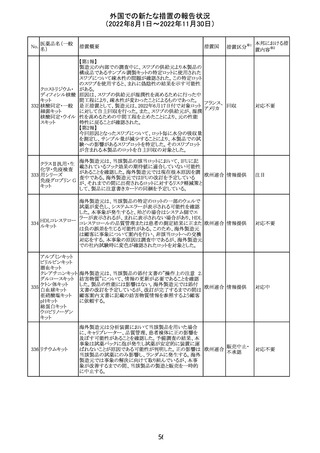
欧州PRACはエムガルティの添付文書の改訂を勧告し、4.4
Special warnings and precautions for useの項のSerious
ガルカネズマブ
11
hypersensitivityに、投与後1日~4週間に発現する可能性 オランダ その他
(遺伝子組換え)
があること、患者には遅発性過敏症反応の可能性を説明し
医師に連絡するよう指示することが追記された。
対応済
欧州PRACにより臨床試験・自発報告において得られた情
報及び作用機序を踏まえて、Special warnings and
シポニモド フマ
12
precautions for useに、ヘルペスウイルス感染症についての オランダ その他
ル酸
注意記載が新たに追加され、Undesirable effectsの項にクリ
プトコッカス髄膜炎及び扁平上皮癌が追加された。
注目
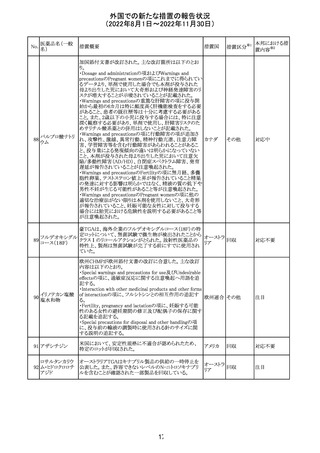
13 メトトレキサート
仏国ANSMにて、メトトレキサートの過量投与が時に死亡に
つながるおそれがあるとして、過量投与防止のための患者 フランス
カード及び医療従事者向け資材を作成している。
その他
対応済
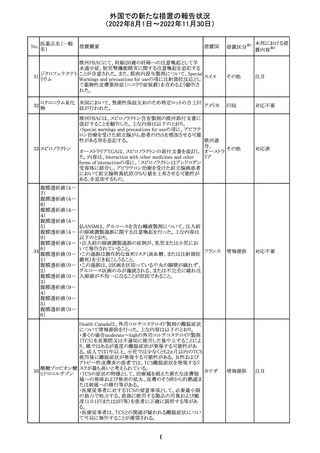
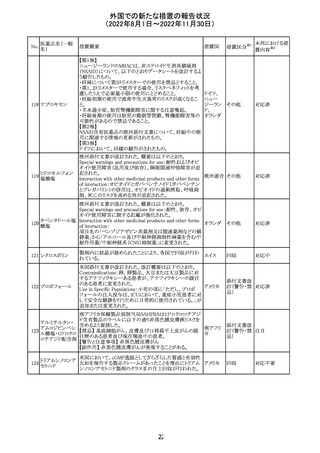
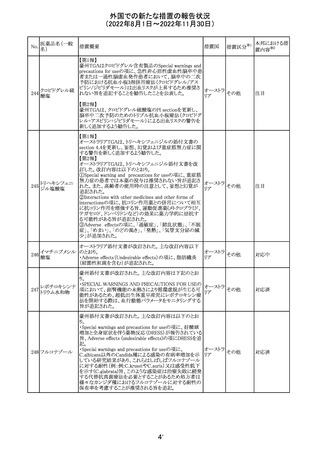
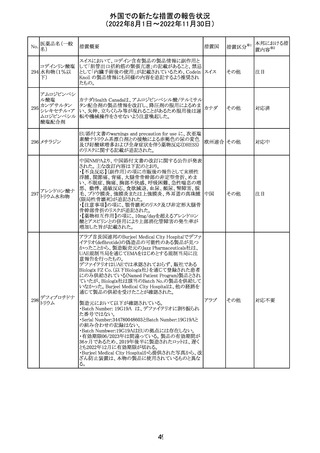
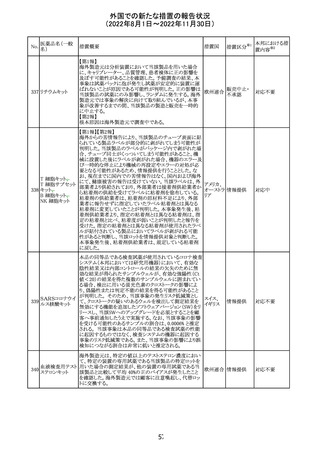
豪州において添付文書が改訂された。改訂内容は以下の
とおり。
・Special warnings and precautions for use、Fertility,
フェノバルビター
オーストラ
14
pregnancy and lactation及びPreclinical safety dataの項
その他
ルナトリウム
リア
に、非臨床試験成績を含む妊娠中に本剤が投与された場
合のリスク情報が更新され、妊娠前に必須なケア(避妊を含
む)に関する注意喚起がなされた。
注目
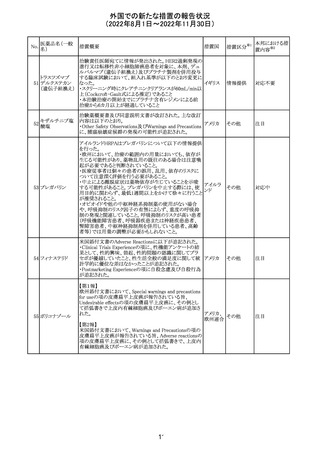
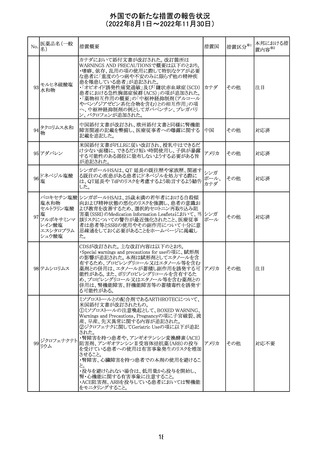
精製ヒアルロン酸
ナトリウム
ドイツにおいて、ヒアルロン酸ナトリウム眼粘弾剤製品の滅
精製ヒアルロン酸
15
菌工程に逸脱が確認され、製品の無菌性が保証されない ドイツ
ナトリウム・コンド
ため、期限切れでない製品を対象として回収が行われた。
ロイチン硫酸エス
テルナトリウム(1)
回収
対応不要
その他
注目
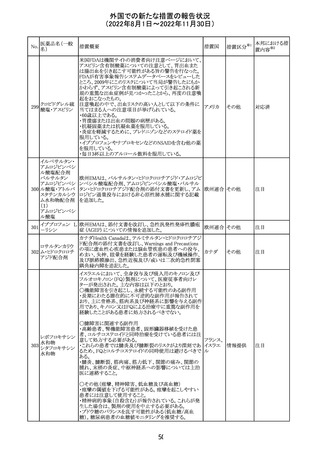
16 炭酸リチウム
加国の添付文書が改訂された。改訂内容は以下のとおり。
・Warnings and precautionsのうち、skinの項に、リチウムに
カナダ
よると疑われる好酸球増加と全身症状を伴う薬物反応
(DRESS)の症例が報告されている旨が記載された。
2
(2022年8月1日~2022年11月30日)
No.
医薬品名(一般
名)
d-クロルフェニラ
ミンマレイン酸塩
クロルフェニラミン
9
マレイン酸塩
プロメタジン塩酸
塩
措置概要
措置国
措置区分※1
豪州TGAにおいて、第1世代抗ヒスタミン薬について、6歳
未満の小児の咳、風邪、インフルエンザ症状の治療に使用 オーストラ
その他
すべきでないこと、2歳未満の小児にはいかなる適応に対し リア
ても投与すべきでないことが勧告された。
CCDSが改訂された。主な改訂内容は以下のとおり。
・PHARMACODYNAMIC PROPERTIESの項において、オミ
クロン株の下位系統であるBA.2、BA.2.12.1及び
BA.4/BA.5系統に対して中和活性が低下したとのin vitro
データを追記。
・DOSAGE AND ADMINISTRATIONの項において、オミク
ロン株の下位系統であるBA.2、BA.2.12.1及びBA.4/BA.5
カシリビマブ(遺
系統の流行地における用量は4800mg(カシリビマブ2,400
伝子組換え)・イ
10
mg、イムデビマブ2,400 mg)である旨を追記。
スイス
ムデビマブ(遺伝
・WARNINGS AND PRECAUTIONSのHypersensitivity
子組換え)
including Anaphylaxis and Infusion-Related Reactionsの項
に、米国での緊急時使用において痙攣性失神の症例が認
められている旨、痙攣性失神は、発作と区別して臨床的に
適切な管理を行う必要がある旨を追記。
・UNDESIRABLE EFFECTS のEmergency Use Experience
の項に、米国での緊急時使用において、静脈内投与及び
皮下投与により痙攣性失神の症例が認められた旨を追記。
その他
本邦における措
置内容※2
注目
注目
欧州PRACはエムガルティの添付文書の改訂を勧告し、4.4
Special warnings and precautions for useの項のSerious
ガルカネズマブ
11
hypersensitivityに、投与後1日~4週間に発現する可能性 オランダ その他
(遺伝子組換え)
があること、患者には遅発性過敏症反応の可能性を説明し
医師に連絡するよう指示することが追記された。
対応済
欧州PRACにより臨床試験・自発報告において得られた情
報及び作用機序を踏まえて、Special warnings and
シポニモド フマ
12
precautions for useに、ヘルペスウイルス感染症についての オランダ その他
ル酸
注意記載が新たに追加され、Undesirable effectsの項にクリ
プトコッカス髄膜炎及び扁平上皮癌が追加された。
注目
13 メトトレキサート
仏国ANSMにて、メトトレキサートの過量投与が時に死亡に
つながるおそれがあるとして、過量投与防止のための患者 フランス
カード及び医療従事者向け資材を作成している。
その他
対応済
豪州において添付文書が改訂された。改訂内容は以下の
とおり。
・Special warnings and precautions for use、Fertility,
フェノバルビター
オーストラ
14
pregnancy and lactation及びPreclinical safety dataの項
その他
ルナトリウム
リア
に、非臨床試験成績を含む妊娠中に本剤が投与された場
合のリスク情報が更新され、妊娠前に必須なケア(避妊を含
む)に関する注意喚起がなされた。
注目
精製ヒアルロン酸
ナトリウム
ドイツにおいて、ヒアルロン酸ナトリウム眼粘弾剤製品の滅
精製ヒアルロン酸
15
菌工程に逸脱が確認され、製品の無菌性が保証されない ドイツ
ナトリウム・コンド
ため、期限切れでない製品を対象として回収が行われた。
ロイチン硫酸エス
テルナトリウム(1)
回収
対応不要
その他
注目
16 炭酸リチウム
加国の添付文書が改訂された。改訂内容は以下のとおり。
・Warnings and precautionsのうち、skinの項に、リチウムに
カナダ
よると疑われる好酸球増加と全身症状を伴う薬物反応
(DRESS)の症例が報告されている旨が記載された。
2