よむ、つかう、まなぶ。
資料3-3 外国での新たな措置の報告状況 (31 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31510.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第4回 3/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
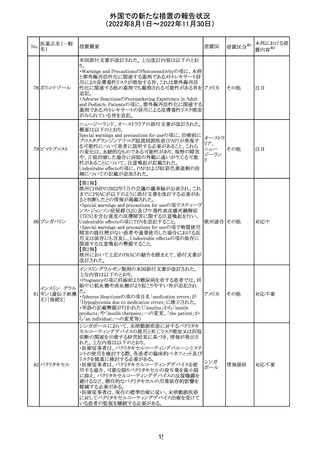
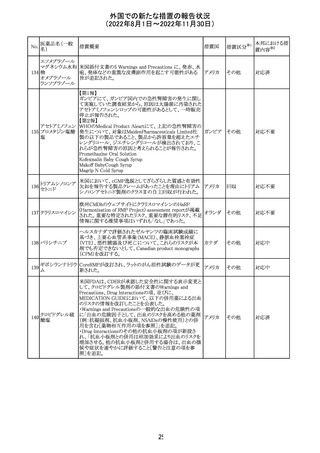
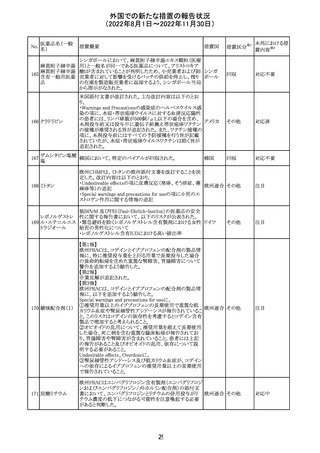
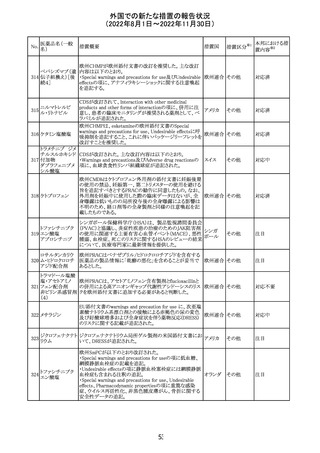
外国での新たな措置の報告状況
(2022年8月1日~2022年11月30日)
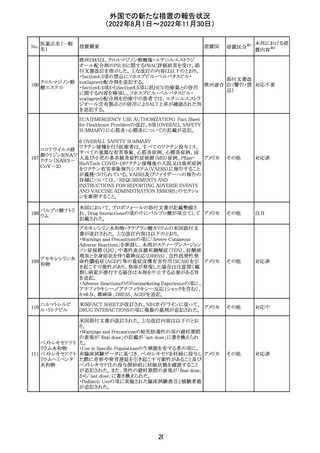
措置区分※1
本邦における措
置内容※2
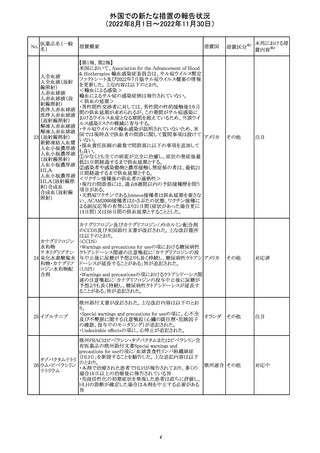
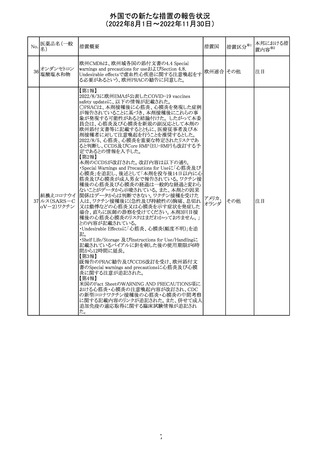
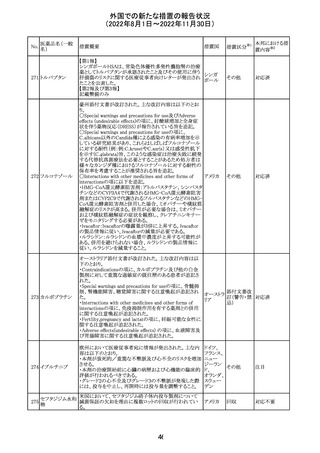
カナダにおいて添付文書が改訂された。主な改訂箇所は
以下のとおり。
・Warnings and precautionsの項に、QT延長の項が新設さ
れ、以下の内容が追記された。
パロキセチン塩酸
181
市販後にQT延長が報告されているが、パロキセチンとの因 カナダ
塩水和物
果関係は確立されていない。QT間隔延長の既往歴のある
患者、抗不整脈薬やQT間隔を延長させる可能性のある他
の薬剤を服用している患者、関連する既存心疾患がある患
者ではパロキセチンは慎重に使用されるべきである 。
その他
対応中
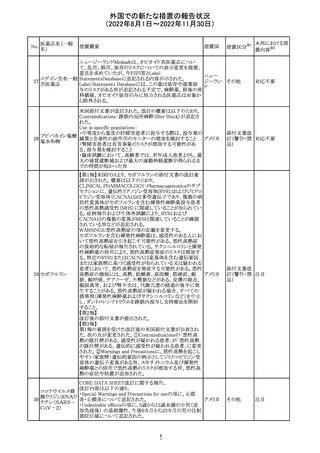
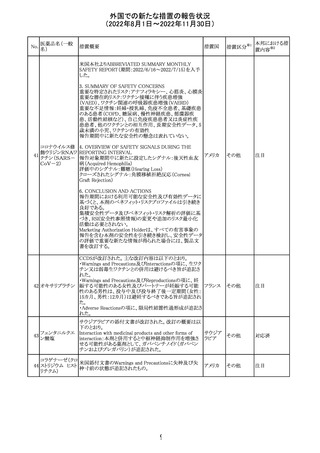
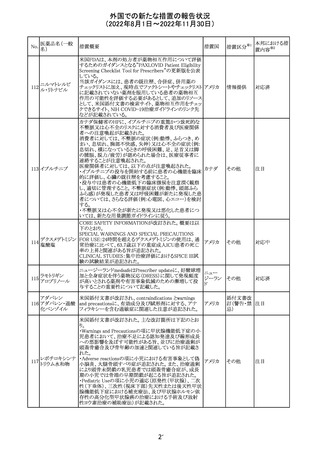
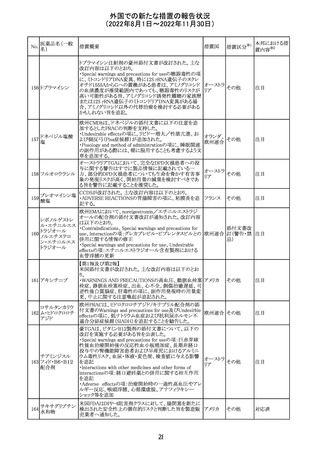
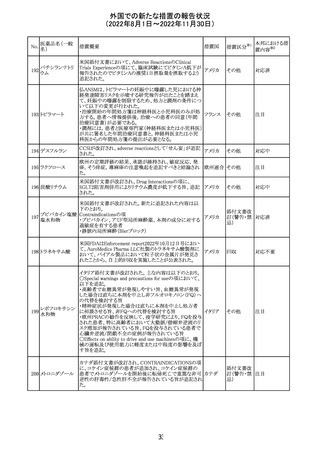
インドネシア添付文書が改訂された。主な改訂内容は以下
のとおり。
・米国添付文書を反映して、WARNINGS BOXの項に、フル
オロキノロンの重篤副作用には腱炎及び腱断裂、末梢神経
障害、中枢神経系への影響が含まれ、これらの副作用を経
験した場合は直ちに投与を中止しフルオロキノロンの使用
を避ける旨、重症筋無力症の筋力低下を悪化させる可能
レボフロキサシン
インドネ
182
性があるので重症筋無力症の既往歴のある患者は使用を
水和物
シア
避ける旨を追記。
・米国添付文書を反映して、PRECAUTIONSの項に、フル
オロキノロンが腱炎及び腱断裂、末梢神経障害のリスク増
加と関連している旨を追記。
・本邦添付文書を反映して、PRECAUTIONSの項に慎重に
投与する患者の追記、ADVERSE REACTIONSに複数の事
象の追記が行われた。
添付文書改
訂(警告・禁 対応済
忌)
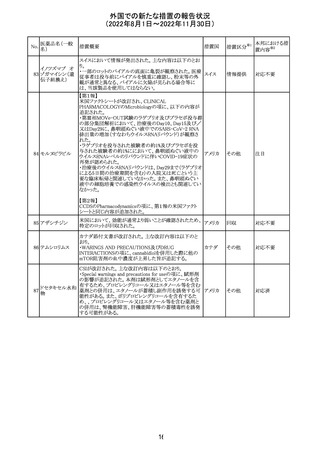
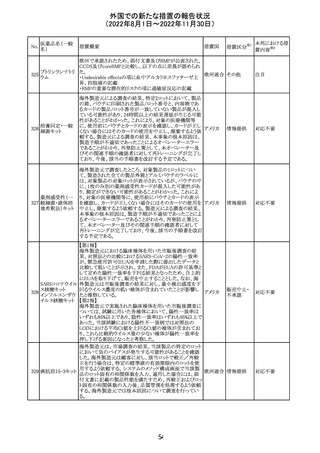
No.
医薬品名(一般
名)
措置概要
措置国
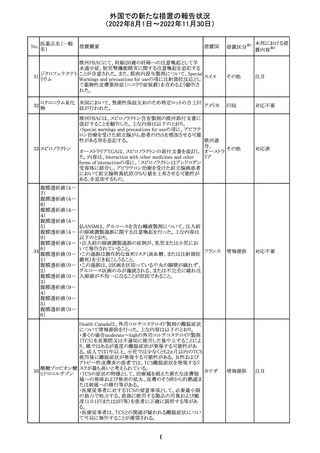
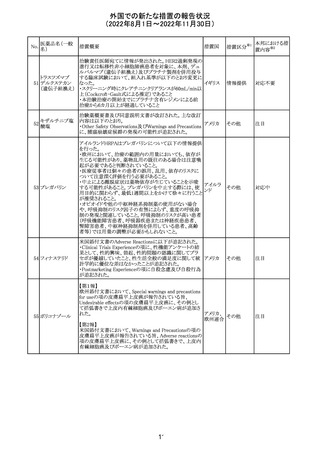
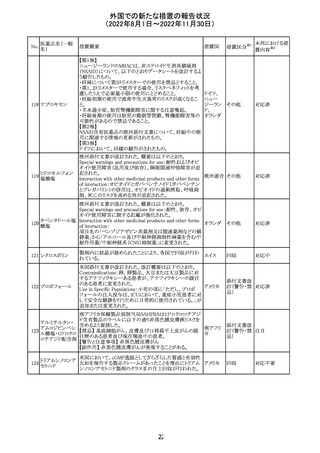
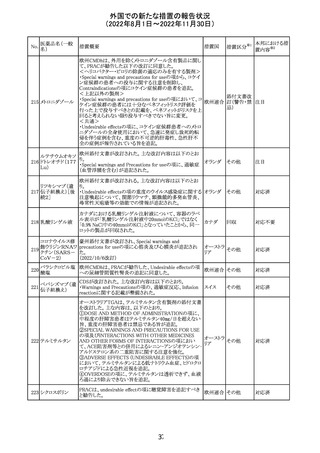
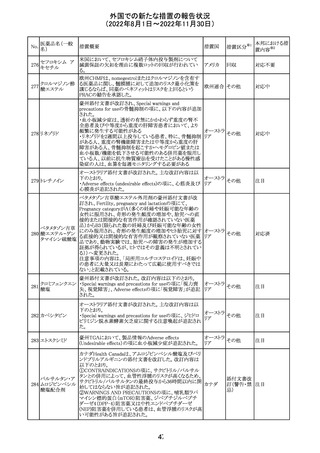
米国本社よりABBREVIATED SUMMARY MONTHLY
SAFETY REPORT(期間:2022/8/16~2022/9/15)を入
手。
3. SUMMARY OF SAFETY CONCERNS
重要な特定されたリスク:アナフィラキシー、心筋炎、心膜炎
重要な潜在的リスク:ワクチン接種に伴う疾患増強
(VAED)、ワクチン関連の呼吸器疾患増強(VAERD)、ギラ
ン・バレー症候群(GBS)
重要な不足情報:妊婦・授乳婦、免疫不全者、基礎疾患の
ある者(慢性閉塞性肺疾患(COPD)、糖尿病、慢性神経疾
患、循環器疾患、活動性結核など)、自己免疫性疾患患者
又は免疫性疾患患者、他のワクチンとの相互作用、長期安
全性データ、6カ月未満の乳児、ワクチンの有効性
コロナウイルス修 報告期間中に新たな安全性の懸念は確認されていない。
飾ウリジンRNAワ
183
アメリカ
クチン(SARS- 4. OVERVIEW OF SAFETY SIGNALS DURING THE
CoV-2)
REPORTING INTERVAL Overview of Signal
報告対象期間中新たに設定したシグナル
・組織球性壊死性リンパ節炎(Histiocytic Necrotizing
Lymphadenitis)→No Riskとしてclosed
・陰部潰瘍(Genital Ulceration)→No Riskとしてclosed
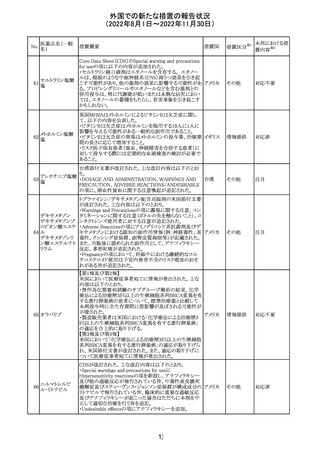
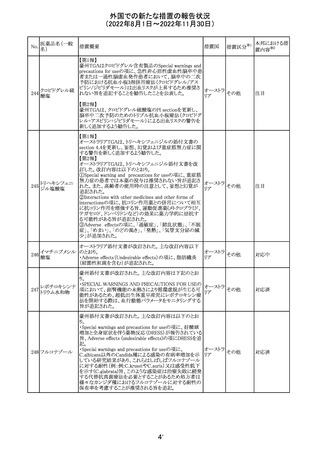
6. CONCLUSION AND ACTIONS
報告期間における利用可能な安全性及び有効性データに
基づくと、本剤のベネフィット・リスクプロファイルは引き続き
良好であり、RSI(安全性参照情報)の変更や追加のリスク最
小化活動は必要とされない。
Marketing Authorization Holderは、すべての有害事象の
報告を含む本剤の安全性を引き続き検討し、安全性データ
の評価で重要な新たな情報が得られた場合には、製品文
書を改訂する。
31
その他
注目
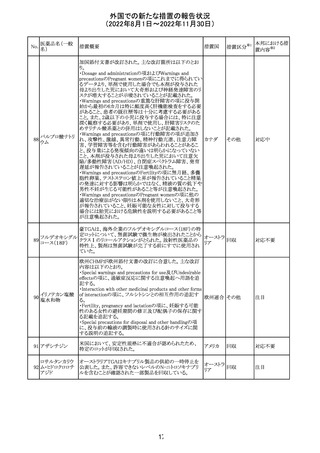
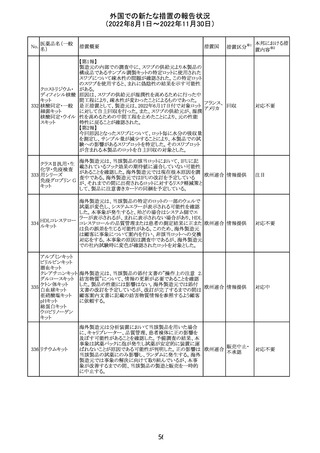
(2022年8月1日~2022年11月30日)
措置区分※1
本邦における措
置内容※2
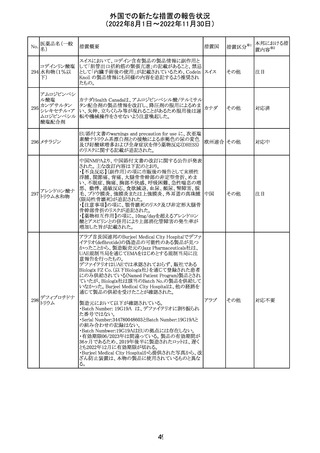
カナダにおいて添付文書が改訂された。主な改訂箇所は
以下のとおり。
・Warnings and precautionsの項に、QT延長の項が新設さ
れ、以下の内容が追記された。
パロキセチン塩酸
181
市販後にQT延長が報告されているが、パロキセチンとの因 カナダ
塩水和物
果関係は確立されていない。QT間隔延長の既往歴のある
患者、抗不整脈薬やQT間隔を延長させる可能性のある他
の薬剤を服用している患者、関連する既存心疾患がある患
者ではパロキセチンは慎重に使用されるべきである 。
その他
対応中
インドネシア添付文書が改訂された。主な改訂内容は以下
のとおり。
・米国添付文書を反映して、WARNINGS BOXの項に、フル
オロキノロンの重篤副作用には腱炎及び腱断裂、末梢神経
障害、中枢神経系への影響が含まれ、これらの副作用を経
験した場合は直ちに投与を中止しフルオロキノロンの使用
を避ける旨、重症筋無力症の筋力低下を悪化させる可能
レボフロキサシン
インドネ
182
性があるので重症筋無力症の既往歴のある患者は使用を
水和物
シア
避ける旨を追記。
・米国添付文書を反映して、PRECAUTIONSの項に、フル
オロキノロンが腱炎及び腱断裂、末梢神経障害のリスク増
加と関連している旨を追記。
・本邦添付文書を反映して、PRECAUTIONSの項に慎重に
投与する患者の追記、ADVERSE REACTIONSに複数の事
象の追記が行われた。
添付文書改
訂(警告・禁 対応済
忌)
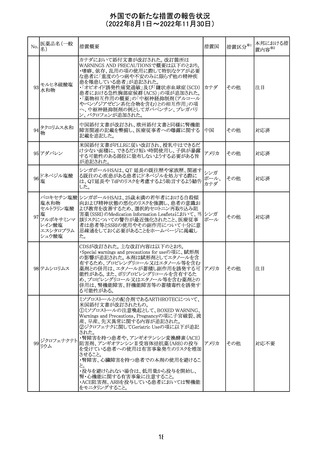
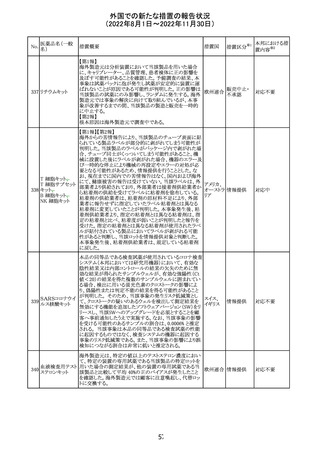
No.
医薬品名(一般
名)
措置概要
措置国
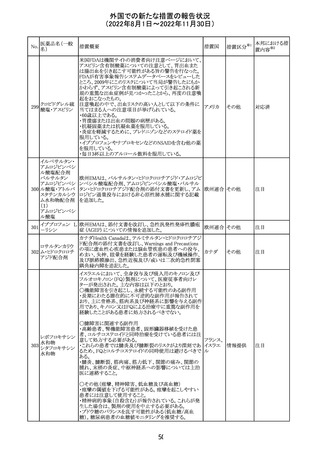
米国本社よりABBREVIATED SUMMARY MONTHLY
SAFETY REPORT(期間:2022/8/16~2022/9/15)を入
手。
3. SUMMARY OF SAFETY CONCERNS
重要な特定されたリスク:アナフィラキシー、心筋炎、心膜炎
重要な潜在的リスク:ワクチン接種に伴う疾患増強
(VAED)、ワクチン関連の呼吸器疾患増強(VAERD)、ギラ
ン・バレー症候群(GBS)
重要な不足情報:妊婦・授乳婦、免疫不全者、基礎疾患の
ある者(慢性閉塞性肺疾患(COPD)、糖尿病、慢性神経疾
患、循環器疾患、活動性結核など)、自己免疫性疾患患者
又は免疫性疾患患者、他のワクチンとの相互作用、長期安
全性データ、6カ月未満の乳児、ワクチンの有効性
コロナウイルス修 報告期間中に新たな安全性の懸念は確認されていない。
飾ウリジンRNAワ
183
アメリカ
クチン(SARS- 4. OVERVIEW OF SAFETY SIGNALS DURING THE
CoV-2)
REPORTING INTERVAL Overview of Signal
報告対象期間中新たに設定したシグナル
・組織球性壊死性リンパ節炎(Histiocytic Necrotizing
Lymphadenitis)→No Riskとしてclosed
・陰部潰瘍(Genital Ulceration)→No Riskとしてclosed
6. CONCLUSION AND ACTIONS
報告期間における利用可能な安全性及び有効性データに
基づくと、本剤のベネフィット・リスクプロファイルは引き続き
良好であり、RSI(安全性参照情報)の変更や追加のリスク最
小化活動は必要とされない。
Marketing Authorization Holderは、すべての有害事象の
報告を含む本剤の安全性を引き続き検討し、安全性データ
の評価で重要な新たな情報が得られた場合には、製品文
書を改訂する。
31
その他
注目