よむ、つかう、まなぶ。
資料No.1-1~1-5_第十八改正日本薬局方第二追補(案) (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00008.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和5年度第1回 1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
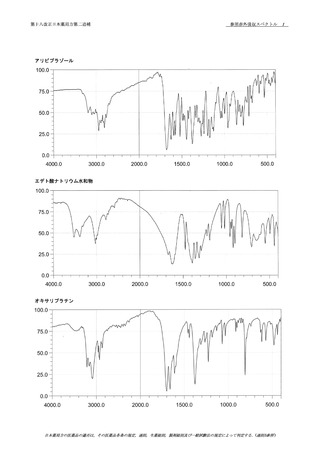
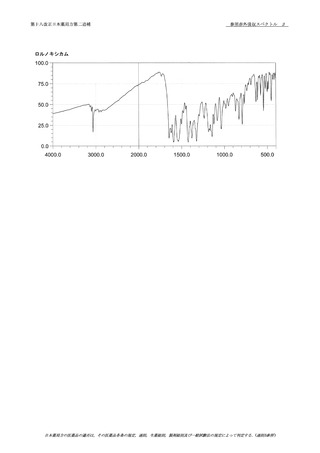
10 一般試験法 2.66 元素不純物
1
2
多岐にわたる.
・原薬,添加剤又はその他の構成成分の製造時に意図的に添
第十八改正日本薬局方第二追補
55
56
液剤及び半固形製剤について考慮すべき要素を以下に示すが,
一例であり,これらに限定するものではない.
3
加された元素(金属触媒など)が不純物として残留したもの.
57
・親水性/疎水性,イオン含量,pH,温度(低温対室温及び
4
原薬のリスクアセスメントでは,製剤中に元素不純物が混
58
製造条件),接触面積,容器/資材の組成・材質,最終滅
5
入する可能性について検討しなければならない.
59
菌,包装工程,資材の滅菌,保存期間
6
・製剤の製造に用いられる原薬,水又は添加剤に意図的には
60
表2.66-2は,リスクアセスメントにおける元素不純物の考
7
添加されないが,それらの中に存在する可能性がある元素
61
慮に関する推奨事項を示している.これは,製剤中の元素不純
不純物.
62
物の起源の全てに適用することができるものである.
63
表2.66-2 リスクアセスメントにおいて考慮すべき元素
8
9
10
11
12
・製造設備・器具から原薬や製剤中に移行する可能性がある
元素不純物.
・容器及び施栓系から原薬や製剤中に溶出する可能性がある
元素 クラス
元素不純物.
13
リスクアセスメントでは,潜在的な個々の混入起源からの元
14
素不純物の量は,製剤の元素不純物の総量に影響することを考
15
慮すべきである.
16
4.3.
潜在的な元素不純物の特定
17
意図的に添加した触媒又は無機試薬に由来する可能性がある
18
元素不純物:元素が意図的に添加された場合,リスクアセスメ
19
ントの対象に含めなければならない.
20
原薬や添加剤の中に存在する可能性がある元素不純物:意図
21
的に添加しなくても,元素不純物が原薬や添加剤中に存在する
22
可能性がある.これらの元素が製剤中に混入する可能性をリス
23
クアセスメントに反映させるべきである.
24
製造設備・器具由来の潜在的元素不純物:製造設備・器具由
25
来の元素不純物の混入は限定的なものであることがあり,リス
26
クアセスメントにおいて考慮すべき元素不純物の範囲は,製剤
27
の製造に使用される設備・器具に依存する.懸念のある特定の
28
元素不純物については,製剤構成成分に接触する製造設備・器
29
具の構成要素の組成に関する知識に基づき評価すべきである.
30
製造設備・器具由来の元素不純物についてのリスクアセスメン
31
トは,類似した一連の,あるいは複数の製造プロセス及び工程
32
を用いるその他多くの製剤に係るリスクアセスメントにおいて
33
活用することができる.
64
Cd
Pb
As
Hg
Co
V
Ni
Tl
Au
Pd
Ir
Os
Rh
Ru
Se
Ag
Pt
Li
Sb
Ba
Mo
Cu
Sn
Cr
1
1
1
1
2A
2A
2A
2B
2B
2B
2B
2B
2B
2B
2B
2B
2B
3
3
3
3
3
3
3
4.4.
評価
意図的に添加
された場合
意図的に添加されない場合
(全ての
投与経路)
経口製剤
注射剤
吸入剤
皮膚適用
製剤
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
要
要
要
要
要
要
要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
要
要
不要
不要
要
不要
不要
要
要
要
要
要
要
要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
34
製造設備・器具からの元素不純物の溶出又は移行の可能性に
65
35
関して評価を行った場合,一般的に,原薬の製造工程は製剤の
66
36
製造工程よりも溶出・移行の可能性がより高いものである.製
67
37
剤の製造設備・器具由来の元素不純物の影響は,原薬製造設
68
38
備・器具由来の元素不純物の影響よりも低いと予想される.し
69
2) リスクアセスメントプロセスにより,一つ以上の潜在的
39
かし,工程の知識又は理解を踏まえるとこの予想があてはまら
70
元素不純物が特定される.当該プロセスにおいて特定され
40
ない場合には,リスクアセスメントにおいて製剤製造設備・器
71
た元素不純物に関しては,リスクアセスメントにより当該
41
具由来の元素不純物の混入の可能性を考慮すべきである(例え
72
42
ば,溶融押出工程).
73
潜在的元素不純物を特定するプロセスの結論としては,以下
の二通りがある.
1) リスクアセスメントプロセスにより,いかなる潜在的元
素不純物も特定されない.
不純物のあらゆる起源の有無を考察すべきである.
リスクアセスメントにおいては,製剤中の潜在的元素不純物
容器施栓系から溶出する元素不純物:容器施栓系から混入す
74
の量に影響を及ぼしうる多くの要因を考慮すべきである.
44
る可能性がある元素不純物の特定は,剤形ごとの包装との間で
75
4.5.
45
生じ得る相互作用に関する科学的理解に基づくべきである.容
76
リスクアセスメントは,製剤中に認められる可能性の高い元
46
器施栓系が元素不純物を含まないことを,容器施栓系を構成す
77
素不純物を特定するために,関連する製品又は構成成分に特有
47
る資材類の評価により実証できる場合には,更なるリスクアセ
78
のデータと,製品又は製造プロセスから横断的に得られた情報
48
スメントの実施は不要である.また,固形製剤では,元素が溶
79
と知識を結びつけて評価することにより,要約される.
49
出する確率が非常に低いため,更なるアセスメントは不要であ
80
設定PDE値と関連づけて元素不純物の実測値又は予測値の
50
る.液剤及び半固形製剤に関しては,製剤の有効期間中に容器
81
有意性を考察すべきである.元素不純物の実測値の有意性の指
51
施栓系から元素不純物が溶出する可能性がより高い.容器施栓
82
標として,設定PDE値(及びCo及びNiの場合はCTCL)の30%
52
系から溶出する潜在的な元素不純物(例えば,洗浄後,滅菌後, 83
のレベルを管理閾値と定義する.更なる管理の要否の決定に管
53
照射後などにおけるもの)を把握するための調査を行うべきで
84
54
ある.
85
43
リスクアセスメントプロセスの概要
理閾値を用いることができる.
あらゆる起源に由来する製剤中元素不純物の合計が一貫して
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する. (通則5参照 )
1
2
多岐にわたる.
・原薬,添加剤又はその他の構成成分の製造時に意図的に添
第十八改正日本薬局方第二追補
55
56
液剤及び半固形製剤について考慮すべき要素を以下に示すが,
一例であり,これらに限定するものではない.
3
加された元素(金属触媒など)が不純物として残留したもの.
57
・親水性/疎水性,イオン含量,pH,温度(低温対室温及び
4
原薬のリスクアセスメントでは,製剤中に元素不純物が混
58
製造条件),接触面積,容器/資材の組成・材質,最終滅
5
入する可能性について検討しなければならない.
59
菌,包装工程,資材の滅菌,保存期間
6
・製剤の製造に用いられる原薬,水又は添加剤に意図的には
60
表2.66-2は,リスクアセスメントにおける元素不純物の考
7
添加されないが,それらの中に存在する可能性がある元素
61
慮に関する推奨事項を示している.これは,製剤中の元素不純
不純物.
62
物の起源の全てに適用することができるものである.
63
表2.66-2 リスクアセスメントにおいて考慮すべき元素
8
9
10
11
12
・製造設備・器具から原薬や製剤中に移行する可能性がある
元素不純物.
・容器及び施栓系から原薬や製剤中に溶出する可能性がある
元素 クラス
元素不純物.
13
リスクアセスメントでは,潜在的な個々の混入起源からの元
14
素不純物の量は,製剤の元素不純物の総量に影響することを考
15
慮すべきである.
16
4.3.
潜在的な元素不純物の特定
17
意図的に添加した触媒又は無機試薬に由来する可能性がある
18
元素不純物:元素が意図的に添加された場合,リスクアセスメ
19
ントの対象に含めなければならない.
20
原薬や添加剤の中に存在する可能性がある元素不純物:意図
21
的に添加しなくても,元素不純物が原薬や添加剤中に存在する
22
可能性がある.これらの元素が製剤中に混入する可能性をリス
23
クアセスメントに反映させるべきである.
24
製造設備・器具由来の潜在的元素不純物:製造設備・器具由
25
来の元素不純物の混入は限定的なものであることがあり,リス
26
クアセスメントにおいて考慮すべき元素不純物の範囲は,製剤
27
の製造に使用される設備・器具に依存する.懸念のある特定の
28
元素不純物については,製剤構成成分に接触する製造設備・器
29
具の構成要素の組成に関する知識に基づき評価すべきである.
30
製造設備・器具由来の元素不純物についてのリスクアセスメン
31
トは,類似した一連の,あるいは複数の製造プロセス及び工程
32
を用いるその他多くの製剤に係るリスクアセスメントにおいて
33
活用することができる.
64
Cd
Pb
As
Hg
Co
V
Ni
Tl
Au
Pd
Ir
Os
Rh
Ru
Se
Ag
Pt
Li
Sb
Ba
Mo
Cu
Sn
Cr
1
1
1
1
2A
2A
2A
2B
2B
2B
2B
2B
2B
2B
2B
2B
2B
3
3
3
3
3
3
3
4.4.
評価
意図的に添加
された場合
意図的に添加されない場合
(全ての
投与経路)
経口製剤
注射剤
吸入剤
皮膚適用
製剤
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
要
要
要
要
要
要
要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
要
要
不要
不要
要
不要
不要
要
要
要
要
要
要
要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
要
要
要
要
要
要
要
要
要
要
要
要
要
要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
不要
34
製造設備・器具からの元素不純物の溶出又は移行の可能性に
65
35
関して評価を行った場合,一般的に,原薬の製造工程は製剤の
66
36
製造工程よりも溶出・移行の可能性がより高いものである.製
67
37
剤の製造設備・器具由来の元素不純物の影響は,原薬製造設
68
38
備・器具由来の元素不純物の影響よりも低いと予想される.し
69
2) リスクアセスメントプロセスにより,一つ以上の潜在的
39
かし,工程の知識又は理解を踏まえるとこの予想があてはまら
70
元素不純物が特定される.当該プロセスにおいて特定され
40
ない場合には,リスクアセスメントにおいて製剤製造設備・器
71
た元素不純物に関しては,リスクアセスメントにより当該
41
具由来の元素不純物の混入の可能性を考慮すべきである(例え
72
42
ば,溶融押出工程).
73
潜在的元素不純物を特定するプロセスの結論としては,以下
の二通りがある.
1) リスクアセスメントプロセスにより,いかなる潜在的元
素不純物も特定されない.
不純物のあらゆる起源の有無を考察すべきである.
リスクアセスメントにおいては,製剤中の潜在的元素不純物
容器施栓系から溶出する元素不純物:容器施栓系から混入す
74
の量に影響を及ぼしうる多くの要因を考慮すべきである.
44
る可能性がある元素不純物の特定は,剤形ごとの包装との間で
75
4.5.
45
生じ得る相互作用に関する科学的理解に基づくべきである.容
76
リスクアセスメントは,製剤中に認められる可能性の高い元
46
器施栓系が元素不純物を含まないことを,容器施栓系を構成す
77
素不純物を特定するために,関連する製品又は構成成分に特有
47
る資材類の評価により実証できる場合には,更なるリスクアセ
78
のデータと,製品又は製造プロセスから横断的に得られた情報
48
スメントの実施は不要である.また,固形製剤では,元素が溶
79
と知識を結びつけて評価することにより,要約される.
49
出する確率が非常に低いため,更なるアセスメントは不要であ
80
設定PDE値と関連づけて元素不純物の実測値又は予測値の
50
る.液剤及び半固形製剤に関しては,製剤の有効期間中に容器
81
有意性を考察すべきである.元素不純物の実測値の有意性の指
51
施栓系から元素不純物が溶出する可能性がより高い.容器施栓
82
標として,設定PDE値(及びCo及びNiの場合はCTCL)の30%
52
系から溶出する潜在的な元素不純物(例えば,洗浄後,滅菌後, 83
のレベルを管理閾値と定義する.更なる管理の要否の決定に管
53
照射後などにおけるもの)を把握するための調査を行うべきで
84
54
ある.
85
43
リスクアセスメントプロセスの概要
理閾値を用いることができる.
あらゆる起源に由来する製剤中元素不純物の合計が一貫して
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する. (通則5参照 )