よむ、つかう、まなぶ。
資料No.1-1~1-5_第十八改正日本薬局方第二追補(案) (49 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00008.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和5年度第1回 1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
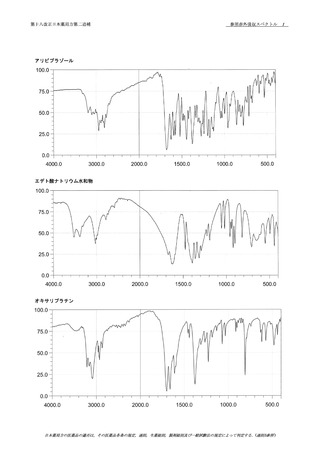
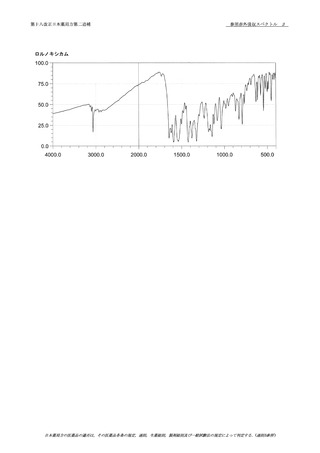
第十八改正日本薬局方第二追補
1
MS:フェブキソスタット標準品の秤取量(mg)
2
C :1錠中のフェブキソスタット(C16H16N2O3S)の表示量
3
4
ポリスチレンスルホン酸ナトリウム
21 .
(mg)
本品10個をとり,アセトニトリル/水混液(3:2) 3V
定量法
5
/4 mLを加え,完全に崩壊するまで30分間激しく振り混ぜ
6
た後,アセトニトリル/水混液(3:2)を加えて正確にV mL
7
とする.この液を遠心分離し,フェブキソスタット
48
8
(C16H16N2O3S)約4 mgに対応する容量の上澄液を正確に量り,
9
アセトニトリル/水混液(3:2)を加えて正確に50 mLとする.
49
医薬品各条の部
10
更にこの液2.5 mLを正確に量り,アセトニトリル/水混液
50
以降を繰り上げる.
11
(3:2)を加えて正確に20 mLとした液をろ過し,ろ液を試料
12
溶液とする.別にフェブキソスタット標準品約10 mgを精密
13
に量り,アセトニトリル/水混液(3:2)に溶かし,正確に
14
200 mLとする.この液5 mLを正確に量り,アセトニトリル
15
/水混液(3:2)を加えて正確に25 mLとし,標準溶液とする.
16
試料溶液及び標準溶液20 μLにつき,次の条件で液体クロマ
17
トグラフィー 〈2.01〉 により試験を行い,それぞれの液のフ
18
ェブキソスタットのピーク面積AT及びASを測定する.
19
本品1個中のフェブキソスタット(C16H16N2O3S)の量(mg)
20
=MS × AT/AS × C /10
21
MS:フェブキソスタット標準品の秤取量(mg)
22
C :1錠中のフェブキソスタット(C16H16N2O3S)の表示量
23
(mg)
24
試験条件
25
検出器:紫外吸光光度計(測定波長:317 nm)
26
カラム:内径4.6 mm,長さ15 cmのステンレス管に5
27
μmの液体クロマトグラフィー用オクタデシルシリル
28
化シリカゲルを充塡する.
29
カラム温度:40℃付近の一定温度
30
移動相:酢酸(100)の液体クロマトグラフィー用アセト
31
ニトリル溶液(1→500)/薄めた酢酸(100) (1→500)混
32
液(3:2)
33
流量:フェブキソスタットの保持時間が約6分になるよ
34
うに調整する.
35
システム適合性
36
システムの性能:標準溶液20 μLにつき,上記の条件で
37
操作するとき,フェブキソスタットのピークの理論段
38
数及びシンメトリー係数は,それぞれ1500段以上,
39
51
52
53
医薬品各条の部
ブドウ糖の条純度試験の項ヒ素の目を削り,
プロピレングリコールの条純度試験の項ヒ
素の目を削り,以降を繰り上げる.
医薬品各条の部
ベクロメタゾンプロピオン酸エステルの条
54
性状の項及び純度試験の項(2)の目を次のように改める.
55
ベクロメタゾンプロピオン酸エステル
56
性状 本品は白色~微黄色の粉末である.
57
本品は,メタノール又は酢酸エチルにやや溶けやすく,エ
58
タノール(99.5)にやや溶けにくく,水にほとんど溶けない.
59
融点:約208℃(分解).
60
本品は結晶多形が認められる.
61
純度試験
62
(2)
63
試料溶液とする.この液1 mLを正確に量り,酢酸エチルを
64
加えて正確に50 mLとし,標準溶液とする.これらの液につ
65
き,薄層クロマトグラフィー〈2.03〉 により試験を行う.試
66
料溶液及び標準溶液5 μLずつを薄層クロマトグラフィー用
67
シリカゲルを用いて調製した薄層板にスポットする.次に酢
類縁物質
本品20 mgを酢酸エチル5 mLに溶かし,
68
酸エチル/ペンタン(3:2)を展開溶媒として約15 cm展開し
69
た後,薄層板を風乾する.これにアルカリ性ブルーテトラゾ
70
リウム試液を均等に噴霧するとき,試料溶液から得た主スポ
71
ット以外のスポットは,標準溶液から得たスポットより濃く
72
ない.
0.9 ~ 1.4である.
40
システムの再現性:標準溶液20 μLにつき,上記の条件
41
で試験を6回繰り返すとき,フェブキソスタットのピ
42
ーク面積の相対標準偏差は1.0%以下である.
43
貯法
44
その他
容器 気密容器.
73
医薬品各条の部
ポリスチレンスルホン酸ナトリウムの条基
74
原の項,性状の項及び定量法の項を次のように改める.
75
ポリスチレンスルホン酸ナトリウム
45
類縁物質TA:
76
本品はスチレンとジビニルベンゼンとの共重合体にスルホ
46
2-[3-Carbamoyl-4-(2-methylpropoxy)phenyl]-4-methyl-1,3-
ン酸基を結合させ,ナトリウム型とした陽イオン交換樹脂で
47
77
thiazole-5-carboxylic acid
78
ある.
79
80
81
82
本品は定量するとき,換算した脱水物に対し,ナトリウム
(Na:22.99) 9.4 ~ 11.5%を含む.
本品の換算した脱水物1 gは0.110 ~ 0.135 gのカリウム
(K:39.10)と交換する.
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する.(通則5参照 )
1
MS:フェブキソスタット標準品の秤取量(mg)
2
C :1錠中のフェブキソスタット(C16H16N2O3S)の表示量
3
4
ポリスチレンスルホン酸ナトリウム
21 .
(mg)
本品10個をとり,アセトニトリル/水混液(3:2) 3V
定量法
5
/4 mLを加え,完全に崩壊するまで30分間激しく振り混ぜ
6
た後,アセトニトリル/水混液(3:2)を加えて正確にV mL
7
とする.この液を遠心分離し,フェブキソスタット
48
8
(C16H16N2O3S)約4 mgに対応する容量の上澄液を正確に量り,
9
アセトニトリル/水混液(3:2)を加えて正確に50 mLとする.
49
医薬品各条の部
10
更にこの液2.5 mLを正確に量り,アセトニトリル/水混液
50
以降を繰り上げる.
11
(3:2)を加えて正確に20 mLとした液をろ過し,ろ液を試料
12
溶液とする.別にフェブキソスタット標準品約10 mgを精密
13
に量り,アセトニトリル/水混液(3:2)に溶かし,正確に
14
200 mLとする.この液5 mLを正確に量り,アセトニトリル
15
/水混液(3:2)を加えて正確に25 mLとし,標準溶液とする.
16
試料溶液及び標準溶液20 μLにつき,次の条件で液体クロマ
17
トグラフィー 〈2.01〉 により試験を行い,それぞれの液のフ
18
ェブキソスタットのピーク面積AT及びASを測定する.
19
本品1個中のフェブキソスタット(C16H16N2O3S)の量(mg)
20
=MS × AT/AS × C /10
21
MS:フェブキソスタット標準品の秤取量(mg)
22
C :1錠中のフェブキソスタット(C16H16N2O3S)の表示量
23
(mg)
24
試験条件
25
検出器:紫外吸光光度計(測定波長:317 nm)
26
カラム:内径4.6 mm,長さ15 cmのステンレス管に5
27
μmの液体クロマトグラフィー用オクタデシルシリル
28
化シリカゲルを充塡する.
29
カラム温度:40℃付近の一定温度
30
移動相:酢酸(100)の液体クロマトグラフィー用アセト
31
ニトリル溶液(1→500)/薄めた酢酸(100) (1→500)混
32
液(3:2)
33
流量:フェブキソスタットの保持時間が約6分になるよ
34
うに調整する.
35
システム適合性
36
システムの性能:標準溶液20 μLにつき,上記の条件で
37
操作するとき,フェブキソスタットのピークの理論段
38
数及びシンメトリー係数は,それぞれ1500段以上,
39
51
52
53
医薬品各条の部
ブドウ糖の条純度試験の項ヒ素の目を削り,
プロピレングリコールの条純度試験の項ヒ
素の目を削り,以降を繰り上げる.
医薬品各条の部
ベクロメタゾンプロピオン酸エステルの条
54
性状の項及び純度試験の項(2)の目を次のように改める.
55
ベクロメタゾンプロピオン酸エステル
56
性状 本品は白色~微黄色の粉末である.
57
本品は,メタノール又は酢酸エチルにやや溶けやすく,エ
58
タノール(99.5)にやや溶けにくく,水にほとんど溶けない.
59
融点:約208℃(分解).
60
本品は結晶多形が認められる.
61
純度試験
62
(2)
63
試料溶液とする.この液1 mLを正確に量り,酢酸エチルを
64
加えて正確に50 mLとし,標準溶液とする.これらの液につ
65
き,薄層クロマトグラフィー〈2.03〉 により試験を行う.試
66
料溶液及び標準溶液5 μLずつを薄層クロマトグラフィー用
67
シリカゲルを用いて調製した薄層板にスポットする.次に酢
類縁物質
本品20 mgを酢酸エチル5 mLに溶かし,
68
酸エチル/ペンタン(3:2)を展開溶媒として約15 cm展開し
69
た後,薄層板を風乾する.これにアルカリ性ブルーテトラゾ
70
リウム試液を均等に噴霧するとき,試料溶液から得た主スポ
71
ット以外のスポットは,標準溶液から得たスポットより濃く
72
ない.
0.9 ~ 1.4である.
40
システムの再現性:標準溶液20 μLにつき,上記の条件
41
で試験を6回繰り返すとき,フェブキソスタットのピ
42
ーク面積の相対標準偏差は1.0%以下である.
43
貯法
44
その他
容器 気密容器.
73
医薬品各条の部
ポリスチレンスルホン酸ナトリウムの条基
74
原の項,性状の項及び定量法の項を次のように改める.
75
ポリスチレンスルホン酸ナトリウム
45
類縁物質TA:
76
本品はスチレンとジビニルベンゼンとの共重合体にスルホ
46
2-[3-Carbamoyl-4-(2-methylpropoxy)phenyl]-4-methyl-1,3-
ン酸基を結合させ,ナトリウム型とした陽イオン交換樹脂で
47
77
thiazole-5-carboxylic acid
78
ある.
79
80
81
82
本品は定量するとき,換算した脱水物に対し,ナトリウム
(Na:22.99) 9.4 ~ 11.5%を含む.
本品の換算した脱水物1 gは0.110 ~ 0.135 gのカリウム
(K:39.10)と交換する.
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する.(通則5参照 )