よむ、つかう、まなぶ。
資料No.1-1~1-5_第十八改正日本薬局方第二追補(案) (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00008.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和5年度第1回 1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2 エデト酸ナトリウム水和物
20 ~ 25
1
2
10
第十八改正日本薬局方第二追補
90
医薬品各条の部
アンレキサノクスの条を削る.
32
医薬品各条の部
アンレキサノクス錠の条を削る.
医薬品各条の部
エデト酸ナトリウム水和物の条確認試験の
流量:毎分1.2 mL
システム適合性
3
システムの性能:アリピプラゾール標準品及びシステム
4
適合性試験用アリピプラゾールN-オキシド標準品5
5
mgずつを溶解液100 mLに溶かす.この液1 mLを量
6
り,溶解液を加えて50 mLとする.この液20 μLにつ
7
き,上記の条件で操作するとき,アリピプラゾール,
8
アリピプラゾールN-オキシドの順に溶出し,その分
9
離度は2.0以上であり,アリピプラゾールのピークの
10
シンメトリー係数は1.5以下である.
11
システムの再現性:標準溶液20 μLにつき,上記の条件
12
で試験を6回繰り返すとき,アリピプラゾールのピー
13
ク面積の相対標準偏差は1.0%以下である.
14
貯法 容器 気密容器.
15
その他
16
類縁物質A:
17
7-Hydroxy-3,4-dihydroquinolin-2(1H)-one
H
N
HO
O
18
19
類縁物質B:
20
7-{4-[4-(3-Chlorophenyl)piperazin-1-yl]butoxy}-3,4-
21
dihydroquinolin-2(1H)-one
N
O
H
N
O
N
22
31
33
34
項を次のように改める.
35
エデト酸ナトリウム水和物
36
確認試験
37
(1)
38
とき,白色の沈殿を生じる.沈殿をろ取し,水50 mLで洗い,
本品0.5 gを水20 mLに溶かし,希塩酸1 mLを加える
39
105 ℃ で 1 時 間 乾 燥 す る と き , そ の 融 点 〈 2.60 〉 は 240 ~
40
244℃(分解)である.
41
(2)
42
化カリウム錠剤法により試験を行い,本品のスペクトルと本
43
品の参照スペクトルを比較するとき,両者のスペクトルは同
44
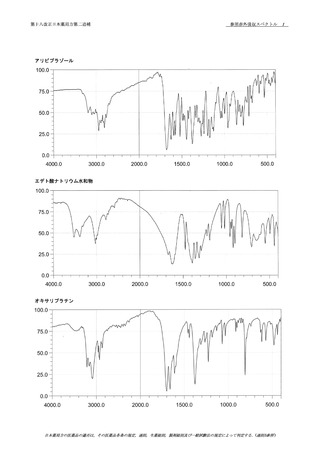
一波数のところに同様の強度の吸収を認める.
45
(3)
46
〈1.09〉を呈する.
47
医薬品各条の部
本品につき,赤外吸収スペクトル測定法〈2.25〉 の臭
本品の水溶液(1→20)はナトリウム塩の定性反応(1)
オキサプロジンの条の次に次の二条を加え
48
る.
49
オキサリプラチン
50
Oxaliplatin
Cl
51
23
アリピプラゾールN-オキシド:
24
4-(2,3-Dichlorophenyl)-1-{4-[(2-oxo-1,2,3,4-tetrahydroquinolin-7-
52
C8H14N2O4Pt:397.29
25
yl)oxy]butyl}piperazine 1-oxide
53
(SP-4-2)-[(1R,2R)-Cyclohexane-1,2-diamine-
54
N,N'][ethanedioato (2-)-O1,O2]platinum
55
[61825-94-3]
56
57
58
26
59
60
61
27
28
29
30
医薬品各条の部
亜硫酸水素ナトリウムの条純度試験の項ヒ
素の目を削る.
医薬品各条の部
素の目を削る.
乾燥亜硫酸ナトリウムの条純度試験の項ヒ
62
本品は定量するとき,換算した乾燥物に対し,オキサリプ
ラチン(C8H14N2O4Pt) 98.0 ~ 102.0%を含む.
性状 本品は白色の結晶性の粉末である.
本品は水に溶けにくく,メタノールに極めて溶けにくく,
エタノール(99.5)にほとんど溶けない.
20
旋光度〔α〕D :+74.5 ~ +78.0°(乾燥物に換算したもの
0.25 g,水,50 mL,100 mm).
63
確認試験
64
(1)
65
液(1→15) 2 ~ 3滴を加えて30分間放置するとき,黄色~橙
本品の水溶液(1→500) 2 mLに薄めた塩化スズ(Ⅱ)試
66
黄色の沈殿を生じる.
67
(2)
68
定法 〈2.24〉 により吸収スペクトルを測定し,本品のスペク
69
トルと本品の参照スペクトル又はオキサリプラチン標準品に
70
ついて同様に操作して得られたスペクトルを比較するとき,
本品の水溶液(1→10000)につき,紫外可視吸光度測
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する.(通則5参照 )
20 ~ 25
1
2
10
第十八改正日本薬局方第二追補
90
医薬品各条の部
アンレキサノクスの条を削る.
32
医薬品各条の部
アンレキサノクス錠の条を削る.
医薬品各条の部
エデト酸ナトリウム水和物の条確認試験の
流量:毎分1.2 mL
システム適合性
3
システムの性能:アリピプラゾール標準品及びシステム
4
適合性試験用アリピプラゾールN-オキシド標準品5
5
mgずつを溶解液100 mLに溶かす.この液1 mLを量
6
り,溶解液を加えて50 mLとする.この液20 μLにつ
7
き,上記の条件で操作するとき,アリピプラゾール,
8
アリピプラゾールN-オキシドの順に溶出し,その分
9
離度は2.0以上であり,アリピプラゾールのピークの
10
シンメトリー係数は1.5以下である.
11
システムの再現性:標準溶液20 μLにつき,上記の条件
12
で試験を6回繰り返すとき,アリピプラゾールのピー
13
ク面積の相対標準偏差は1.0%以下である.
14
貯法 容器 気密容器.
15
その他
16
類縁物質A:
17
7-Hydroxy-3,4-dihydroquinolin-2(1H)-one
H
N
HO
O
18
19
類縁物質B:
20
7-{4-[4-(3-Chlorophenyl)piperazin-1-yl]butoxy}-3,4-
21
dihydroquinolin-2(1H)-one
N
O
H
N
O
N
22
31
33
34
項を次のように改める.
35
エデト酸ナトリウム水和物
36
確認試験
37
(1)
38
とき,白色の沈殿を生じる.沈殿をろ取し,水50 mLで洗い,
本品0.5 gを水20 mLに溶かし,希塩酸1 mLを加える
39
105 ℃ で 1 時 間 乾 燥 す る と き , そ の 融 点 〈 2.60 〉 は 240 ~
40
244℃(分解)である.
41
(2)
42
化カリウム錠剤法により試験を行い,本品のスペクトルと本
43
品の参照スペクトルを比較するとき,両者のスペクトルは同
44
一波数のところに同様の強度の吸収を認める.
45
(3)
46
〈1.09〉を呈する.
47
医薬品各条の部
本品につき,赤外吸収スペクトル測定法〈2.25〉 の臭
本品の水溶液(1→20)はナトリウム塩の定性反応(1)
オキサプロジンの条の次に次の二条を加え
48
る.
49
オキサリプラチン
50
Oxaliplatin
Cl
51
23
アリピプラゾールN-オキシド:
24
4-(2,3-Dichlorophenyl)-1-{4-[(2-oxo-1,2,3,4-tetrahydroquinolin-7-
52
C8H14N2O4Pt:397.29
25
yl)oxy]butyl}piperazine 1-oxide
53
(SP-4-2)-[(1R,2R)-Cyclohexane-1,2-diamine-
54
N,N'][ethanedioato (2-)-O1,O2]platinum
55
[61825-94-3]
56
57
58
26
59
60
61
27
28
29
30
医薬品各条の部
亜硫酸水素ナトリウムの条純度試験の項ヒ
素の目を削る.
医薬品各条の部
素の目を削る.
乾燥亜硫酸ナトリウムの条純度試験の項ヒ
62
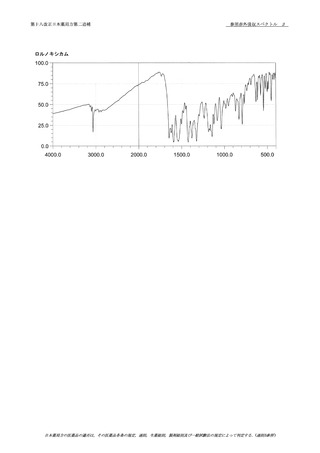
本品は定量するとき,換算した乾燥物に対し,オキサリプ
ラチン(C8H14N2O4Pt) 98.0 ~ 102.0%を含む.
性状 本品は白色の結晶性の粉末である.
本品は水に溶けにくく,メタノールに極めて溶けにくく,
エタノール(99.5)にほとんど溶けない.
20
旋光度〔α〕D :+74.5 ~ +78.0°(乾燥物に換算したもの
0.25 g,水,50 mL,100 mm).
63
確認試験
64
(1)
65
液(1→15) 2 ~ 3滴を加えて30分間放置するとき,黄色~橙
本品の水溶液(1→500) 2 mLに薄めた塩化スズ(Ⅱ)試
66
黄色の沈殿を生じる.
67
(2)
68
定法 〈2.24〉 により吸収スペクトルを測定し,本品のスペク
69
トルと本品の参照スペクトル又はオキサリプラチン標準品に
70
ついて同様に操作して得られたスペクトルを比較するとき,
本品の水溶液(1→10000)につき,紫外可視吸光度測
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する.(通則5参照 )