よむ、つかう、まなぶ。
資料No.1-1~1-5_第十八改正日本薬局方第二追補(案) (46 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00008.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和5年度第1回 1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
18 フェブキソスタット
1
2
医薬品各条の部
フェノールスルホンフタレイン注射液の条
の次に次の二条を加える.
第十八改正日本薬局方第二追補
47
類縁物質の量(%)=MS/MT × AT/AS × 1/2
48
MS:フェブキソスタット標準品の秤取量(mg)
MT:本品の秤取量(mg)
試験条件
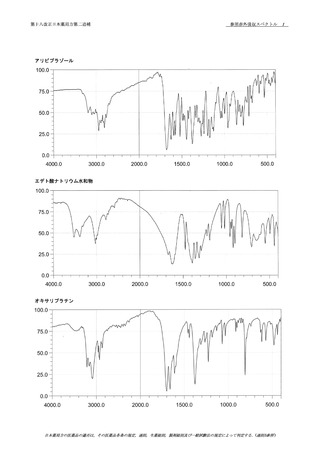
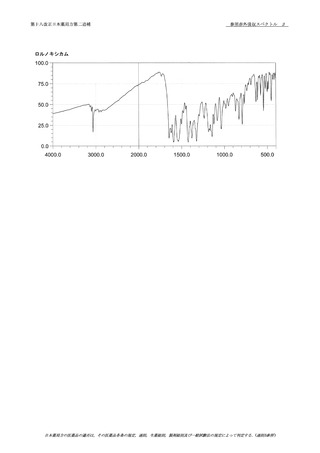
3
フェブキソスタット
49
4
Febuxostat
50
5
51
検出器:紫外吸光光度計(測定波長:217 nm)
52
カラム:内径4.6 mm,長さ25 cmのステンレス管に5
53
μmの液体クロマトグラフィー用オクタデシルシリル
54
化シリカゲルを充塡する.
55
カラム温度:40℃付近の一定温度
56
移動相A:薄めた酢酸(100) (1→5000)
57
移動相B:酢酸(100)の液体クロマトグラフィー用アセ
6
C16H16N2O3S:316.37
7
58
2-[3-Cyano-4-(2-methylpropoxy)phenyl]-4-methyl-1,3-thiazole-5-
8
59
carboxylic acid
9
[144060-53-7]
60
10
11
12
13
トニトリル溶液(1→5000)
移動相の送液:移動相A及び移動相Bの混合比を次のよ
うに変えて濃度勾配制御する.
注入後の時間
(分)
0 ~ 40
本品は定量するとき,フェブキソスタット(C16H16N2O3S)
98.0 ~ 102.0%を含む.
性状
本品は白色の結晶又は結晶性の粉末である.
本品はエタノール(99.5)にやや溶けにくく,アセトニトリ
移動相A
(vol%)
60 →
0
移動相B
(vol%)
40 → 100
61
流量:毎分0.7 mL
62
面積測定範囲:試料溶液注入後40分間
14
ルに溶けにくく,水にほとんど溶けない.
63
15
融点:約209℃(分解,ただし乾燥後).
64
検出の確認:標準溶液1 mLを正確に量り,アセトニト
本品は結晶多形が認められる.
65
リルを加えて正確に10 mLとする.この液40 μLから
66
得たフェブキソスタットのピーク面積が,標準溶液の
67
フェブキソスタットのピーク面積の7 ~ 13%になる
16
システム適合性
17
確認試験
18
(1)
19
外可視吸光度測定法〈2.24〉 により吸収スペクトルを測定し,
68
20
本品のスペクトルと本品の参照スペクトル又はフェブキソス
69
システムの性能:システム適合性試験用フェブキソスタ
21
タット標準品について同様に操作して得られたスペクトルを
70
ット類縁物質A標準品1 mgをアセトニトリルに溶かし
22
比較するとき,両者のスペクトルは同一波長のところに同様
71
100 mLとした液2 mL及びフェブキソスタット原液1
23
の強度の吸収を認める.
72
mLを正確に量り,アセトニトリルを加えて正確に20
本品のエタノール(99.5)溶液(1→100000)につき,紫
ことを確認する.
24
(2)
本品につき,赤外吸収スペクトル測定法〈2.25〉 の臭
73
mLとする.この液40 μLにつき,上記の条件で操作
25
化カリウム錠剤法により試験を行い,本品のスペクトルと本
74
するとき,フェブキソスタット,類縁物質Aの順に溶
26
品の参照スペクトル又はフェブキソスタット標準品のスペク
75
27
トルを比較するとき,両者のスペクトルは同一波数のところ
76
28
に同様の強度の吸収を認める.もし,これらのスペクトルに
77
で試験を6回繰り返すとき,フェブキソスタットのピ
差を認めるときは,別に規定する方法により再結晶し,結晶
78
ーク面積の相対標準偏差は2.0%以下である.
をろ取し,乾燥したものにつき,同様の試験を行う.
79
(ⅱ)
80
正 確 に 50 mL と す る . こ の 液 10 mL を 正 確 に 量 り , 40
81
mmol/L酢酸アンモニウム試液を加えて正確に100 mLとし,
正確に50 mLとし,試料溶液とする.別にフェブキソスタッ
82
試料溶液とする.別にフェブキソスタット標準品約50 mgを
ト標準品約50 mgを精密に量り,アセトニトリルに溶かし,
83
精密に量り,アセトニトリルを加えて正確に50 mLとする.
35
正確に50 mLとする.この液10 mLを正確に量り,アセトニ
84
この液10 mLを正確に量り,アセトニトリルを加えて正確に
36
トリルを加えて正確に100 mLとした液をフェブキソスタッ
85
100 mLとし,フェブキソスタット原液とする.この液10
ト原液とする.フェブキソスタット原液10 mLを正確に量り,
86
mLを正確に量り,アセトニトリルを加えて正確に200 mL
38
アセトニトリルを加えて正確に200 mLとし,標準溶液とす
87
とする.更にこの液10 mLを正確に量り,40 mmol/L酢酸ア
39
る.試料溶液及び標準溶液40 μLずつを正確にとり,次の条
88
ンモニウム試液を加えて正確に100 mLとし,標準溶液とす
40
件で液体クロマトグラフィー〈2.01〉 により,試験を行う.
89
る.試料溶液及び標準溶液20 μLずつを正確にとり,次の条
41
試料溶液の類縁物質のピーク面積 AT 及び標準溶液のフェブ
90
件で液体クロマトグラフィー〈2.01〉 により,試験を行う.
42
キソスタットのピーク面積 AS を自動積分法により測定し,
91
試料溶液のフェブキソスタットに対する相対保持時間約1.1
43
次式により,類縁物質の量を求める.ただし,フェブキソス
92
の類縁物質Bのピーク面積AT及び標準溶液のフェブキソスタ
44
タットに対する相対保持時間約1.2の類縁物質Aのピーク面
93
ットのピーク面積 AS を自動積分法により測定し,次式によ
45
積は自動積分法で求めた面積に感度係数1.8を乗じた値とす
94
り類縁物質Bの量を求める.
46
る.
95
類縁物質Bの量(%)=MS/MT × AT/AS × 1/2
29
30
31
純度試験
32
(ⅰ)
33
34
37
類縁物質
本品約50 mgを精密に量り,アセトニトリルに溶かし,
出し,その分離度は5以上である.
システムの再現性:標準溶液40 μLにつき,上記の条件
本品約50 mgを精密に量り,アセトニトリルに溶かし,
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する.(通則5参照 )
1
2
医薬品各条の部
フェノールスルホンフタレイン注射液の条
の次に次の二条を加える.
第十八改正日本薬局方第二追補
47
類縁物質の量(%)=MS/MT × AT/AS × 1/2
48
MS:フェブキソスタット標準品の秤取量(mg)
MT:本品の秤取量(mg)
試験条件
3
フェブキソスタット
49
4
Febuxostat
50
5
51
検出器:紫外吸光光度計(測定波長:217 nm)
52
カラム:内径4.6 mm,長さ25 cmのステンレス管に5
53
μmの液体クロマトグラフィー用オクタデシルシリル
54
化シリカゲルを充塡する.
55
カラム温度:40℃付近の一定温度
56
移動相A:薄めた酢酸(100) (1→5000)
57
移動相B:酢酸(100)の液体クロマトグラフィー用アセ
6
C16H16N2O3S:316.37
7
58
2-[3-Cyano-4-(2-methylpropoxy)phenyl]-4-methyl-1,3-thiazole-5-
8
59
carboxylic acid
9
[144060-53-7]
60
10
11
12
13
トニトリル溶液(1→5000)
移動相の送液:移動相A及び移動相Bの混合比を次のよ
うに変えて濃度勾配制御する.
注入後の時間
(分)
0 ~ 40
本品は定量するとき,フェブキソスタット(C16H16N2O3S)
98.0 ~ 102.0%を含む.
性状
本品は白色の結晶又は結晶性の粉末である.
本品はエタノール(99.5)にやや溶けにくく,アセトニトリ
移動相A
(vol%)
60 →
0
移動相B
(vol%)
40 → 100
61
流量:毎分0.7 mL
62
面積測定範囲:試料溶液注入後40分間
14
ルに溶けにくく,水にほとんど溶けない.
63
15
融点:約209℃(分解,ただし乾燥後).
64
検出の確認:標準溶液1 mLを正確に量り,アセトニト
本品は結晶多形が認められる.
65
リルを加えて正確に10 mLとする.この液40 μLから
66
得たフェブキソスタットのピーク面積が,標準溶液の
67
フェブキソスタットのピーク面積の7 ~ 13%になる
16
システム適合性
17
確認試験
18
(1)
19
外可視吸光度測定法〈2.24〉 により吸収スペクトルを測定し,
68
20
本品のスペクトルと本品の参照スペクトル又はフェブキソス
69
システムの性能:システム適合性試験用フェブキソスタ
21
タット標準品について同様に操作して得られたスペクトルを
70
ット類縁物質A標準品1 mgをアセトニトリルに溶かし
22
比較するとき,両者のスペクトルは同一波長のところに同様
71
100 mLとした液2 mL及びフェブキソスタット原液1
23
の強度の吸収を認める.
72
mLを正確に量り,アセトニトリルを加えて正確に20
本品のエタノール(99.5)溶液(1→100000)につき,紫
ことを確認する.
24
(2)
本品につき,赤外吸収スペクトル測定法〈2.25〉 の臭
73
mLとする.この液40 μLにつき,上記の条件で操作
25
化カリウム錠剤法により試験を行い,本品のスペクトルと本
74
するとき,フェブキソスタット,類縁物質Aの順に溶
26
品の参照スペクトル又はフェブキソスタット標準品のスペク
75
27
トルを比較するとき,両者のスペクトルは同一波数のところ
76
28
に同様の強度の吸収を認める.もし,これらのスペクトルに
77
で試験を6回繰り返すとき,フェブキソスタットのピ
差を認めるときは,別に規定する方法により再結晶し,結晶
78
ーク面積の相対標準偏差は2.0%以下である.
をろ取し,乾燥したものにつき,同様の試験を行う.
79
(ⅱ)
80
正 確 に 50 mL と す る . こ の 液 10 mL を 正 確 に 量 り , 40
81
mmol/L酢酸アンモニウム試液を加えて正確に100 mLとし,
正確に50 mLとし,試料溶液とする.別にフェブキソスタッ
82
試料溶液とする.別にフェブキソスタット標準品約50 mgを
ト標準品約50 mgを精密に量り,アセトニトリルに溶かし,
83
精密に量り,アセトニトリルを加えて正確に50 mLとする.
35
正確に50 mLとする.この液10 mLを正確に量り,アセトニ
84
この液10 mLを正確に量り,アセトニトリルを加えて正確に
36
トリルを加えて正確に100 mLとした液をフェブキソスタッ
85
100 mLとし,フェブキソスタット原液とする.この液10
ト原液とする.フェブキソスタット原液10 mLを正確に量り,
86
mLを正確に量り,アセトニトリルを加えて正確に200 mL
38
アセトニトリルを加えて正確に200 mLとし,標準溶液とす
87
とする.更にこの液10 mLを正確に量り,40 mmol/L酢酸ア
39
る.試料溶液及び標準溶液40 μLずつを正確にとり,次の条
88
ンモニウム試液を加えて正確に100 mLとし,標準溶液とす
40
件で液体クロマトグラフィー〈2.01〉 により,試験を行う.
89
る.試料溶液及び標準溶液20 μLずつを正確にとり,次の条
41
試料溶液の類縁物質のピーク面積 AT 及び標準溶液のフェブ
90
件で液体クロマトグラフィー〈2.01〉 により,試験を行う.
42
キソスタットのピーク面積 AS を自動積分法により測定し,
91
試料溶液のフェブキソスタットに対する相対保持時間約1.1
43
次式により,類縁物質の量を求める.ただし,フェブキソス
92
の類縁物質Bのピーク面積AT及び標準溶液のフェブキソスタ
44
タットに対する相対保持時間約1.2の類縁物質Aのピーク面
93
ットのピーク面積 AS を自動積分法により測定し,次式によ
45
積は自動積分法で求めた面積に感度係数1.8を乗じた値とす
94
り類縁物質Bの量を求める.
46
る.
95
類縁物質Bの量(%)=MS/MT × AT/AS × 1/2
29
30
31
純度試験
32
(ⅰ)
33
34
37
類縁物質
本品約50 mgを精密に量り,アセトニトリルに溶かし,
出し,その分離度は5以上である.
システムの再現性:標準溶液40 μLにつき,上記の条件
本品約50 mgを精密に量り,アセトニトリルに溶かし,
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する.(通則5参照 )