よむ、つかう、まなぶ。
参考資料1 コスタイベ筋注用 審議結果報告書 (41 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43635.html |
| 出典情報 | 薬事審議会 血液事業部会安全技術調査会(令和6年度第2回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(修正反映版)
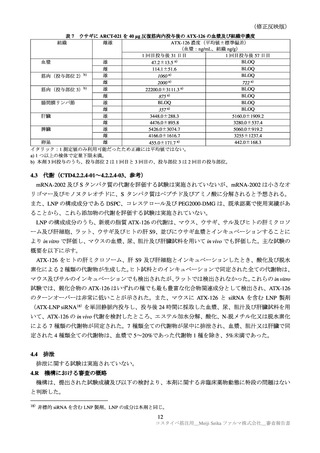
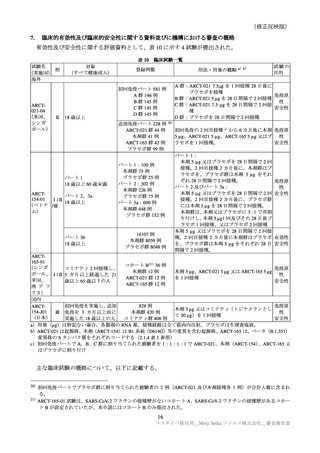
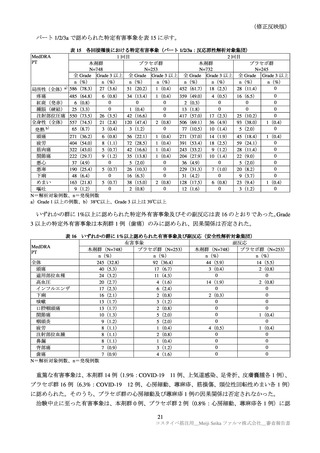
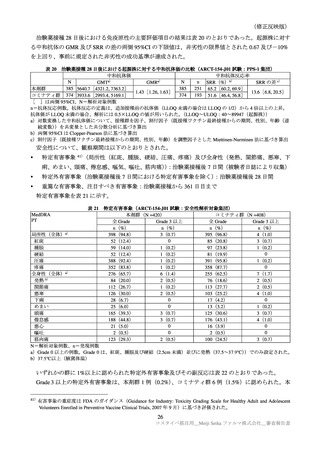
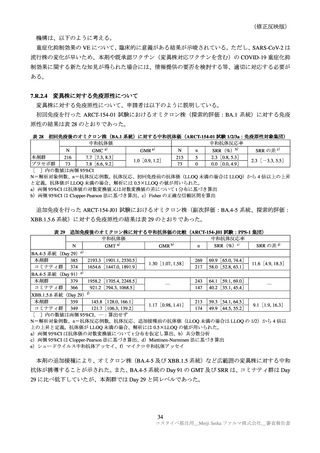
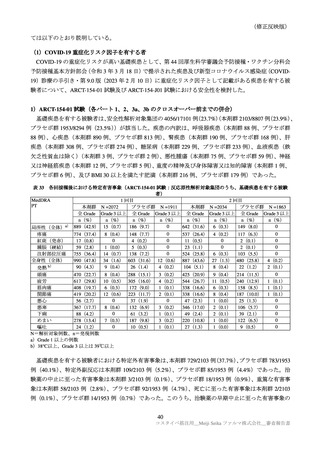
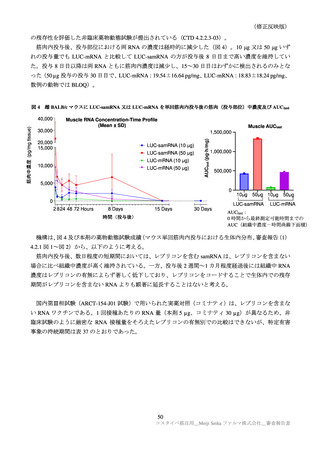
表 30
ARCT-154-01 試験パート 3b 及び ARCT-154-J01 試験における有害事象発現状況の概要(安全性解析対象集団)
ARCT-154-01 試験
ARCT-154-J01 試験
初回 1 回目
初回 2 回目
追加 1 回目
本剤群
プラセボ群
本剤群
プラセボ群
本剤群
コミナティ群
N=8059
N=8041
N=8059
N=8041
N=420
N=408
n(%)
n(%)
n(%)
n(%)
n(%)
n(%)
3474(43.8)
858(10.9) 2401(31.2)
585( 7.7)
398(94.8)
395(96.8)
局所の特定有害事象 a)
0
Grade 3 以上
40( 0.5)
10( 0.1)
1( 0.0)
3( 0.7)
4( 1.0)
3816(48.1) 2499(31.7) 3214(41.7) 1796(23.5)
276(65.7)
255(62.5)
全身の特定有害事象 b)
Grade 3 以上
115( 1.5)
35( 0.4)
113( 1.5)
23( 0.3)
6( 1.4)
7( 1.7)
特定外有害事象
1125(14.0) 1001(13.7) 1096(13.9) 1241(15.9)
81(19.3)
111(27.2)
Grade 3 以上
10( 0.1)
18( 0.2)
13( 0.2)
17( 0.2)
1( 0.2)
6( 1.5)
0
0
0
死亡に至った有害事象
2( 0.0)
5( 0.1)
4( 0.1)
0
重篤な有害事象
38( 0.5)
48( 0.6)
40( 0.5)
61( 0.8)
1( 0.2)
0
―
―
中止に至った有害事象
3( 0.0)
5( 0.1)
4( 0.1)
N=解析対象例数、n=発現例数
a)ARCT-154-01 試験は Grade 1 以上の例数、ARCT-154-J01 試験 Grade 0 以上の例数。Grade 0 は、紅斑、腫脹及び硬結
(2.5cm 未満)でのみ設定された。
b)ARCT-154-01 試験は 38℃以上(測定部位の規定なし)
、ARCT-154-J01 試験は 37.5℃以上(腋窩体温)とされた。
(1)初回免疫について
1)特定有害事象
特定有害事象(7 日間まで観察)の発現状況は表 18(7.2.1.2 参照)のとおりであり、多くが軽度又は
中等症の有害事象であった。
ARCT-154-01 試験パート 3b における特定有害事象の発現時期と持続期間を評価した。局所の特定有
害事象の発現時期の中央値は、本剤群及びプラセボ群ともに 1 日であった。また、持続期間の中央値は、
本剤群では 1~2 日、プラセボ群では 1~3 日であった。1 回目接種後と 2 回目接種後で発現時期及び持
続期間について大きな違いはなかった。全身性の特定有害事象の発現時期の中央値は、本剤群及びプラ
セボ群ともに 1~2 日であり、持続期間の中央値は本剤群では 1~2 日、プラセボ群では 1~3 日であっ
た。発現時期、持続期間の範囲[最大値, 最小値]はいずれも[1, 7]日であった。本剤群について 1 回
目接種後と 2 回目接種後で発現時期及び持続期間について大きな違いはなかった。なお、7 日目以降も
持続した特定有害事象 44)は、本剤群 1 回目 58 例(0.8%)
、2 回目 72 例(0.9%)、プラセボ群 1 回目 66
例(0.8%)
、2 回目 72 例(0.9%)であり、発現率は非常に低く、プラセボ群と明確な差は認められなか
った。
2)特定外有害事象及び重篤な有害事象
特定外有害事象の発現状況は表 19(7.2.1.2 参照)のとおりであり、多くが軽度又は中等症の有害事象
であった。重篤な有害事象について、7.2.1.2 項に記載のとおり、治験薬との因果関係は否定されなかっ
た事象が数件認められたものの、いずれも転帰は回復であり、本剤接種により特段懸念すべき状況は認
められなかった。
3)年齢別の有害事象
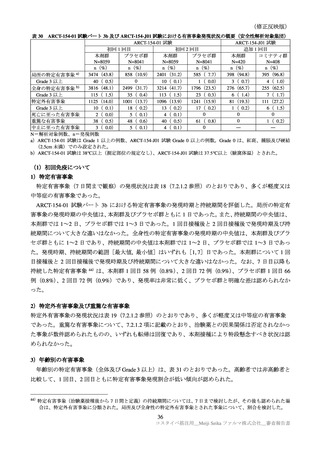
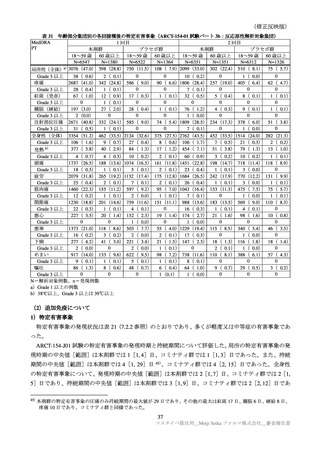
年齢別の特定有害事象(全体及び Grade 3 以上)は、表 31 のとおりであった。高齢者では非高齢者と
比較して、1 回目、2 回目ともに特定有害事象発現割合が低い傾向が認められた。
44)特定有害事象(治験薬接種後から 7 日間と定義)の持続期間については、7 日まで検討したが、その後も認められた場
合は、特定外有害事象に分類された。局所及び全身性の特定外有害事象とされた事象について、割合を検討した。
36
コスタイベ筋注用_Meiji Seika ファルマ株式会社_審査報告書
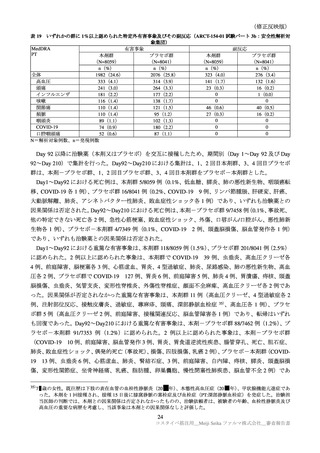
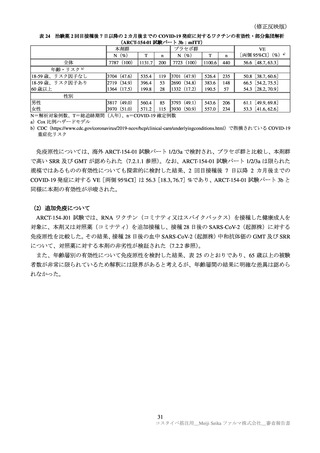
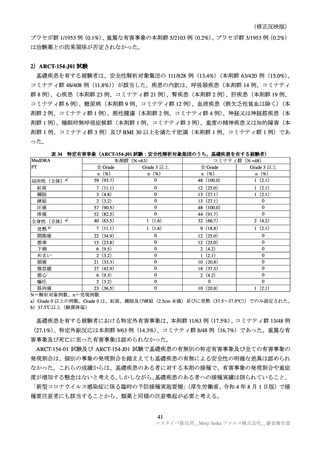
表 30
ARCT-154-01 試験パート 3b 及び ARCT-154-J01 試験における有害事象発現状況の概要(安全性解析対象集団)
ARCT-154-01 試験
ARCT-154-J01 試験
初回 1 回目
初回 2 回目
追加 1 回目
本剤群
プラセボ群
本剤群
プラセボ群
本剤群
コミナティ群
N=8059
N=8041
N=8059
N=8041
N=420
N=408
n(%)
n(%)
n(%)
n(%)
n(%)
n(%)
3474(43.8)
858(10.9) 2401(31.2)
585( 7.7)
398(94.8)
395(96.8)
局所の特定有害事象 a)
0
Grade 3 以上
40( 0.5)
10( 0.1)
1( 0.0)
3( 0.7)
4( 1.0)
3816(48.1) 2499(31.7) 3214(41.7) 1796(23.5)
276(65.7)
255(62.5)
全身の特定有害事象 b)
Grade 3 以上
115( 1.5)
35( 0.4)
113( 1.5)
23( 0.3)
6( 1.4)
7( 1.7)
特定外有害事象
1125(14.0) 1001(13.7) 1096(13.9) 1241(15.9)
81(19.3)
111(27.2)
Grade 3 以上
10( 0.1)
18( 0.2)
13( 0.2)
17( 0.2)
1( 0.2)
6( 1.5)
0
0
0
死亡に至った有害事象
2( 0.0)
5( 0.1)
4( 0.1)
0
重篤な有害事象
38( 0.5)
48( 0.6)
40( 0.5)
61( 0.8)
1( 0.2)
0
―
―
中止に至った有害事象
3( 0.0)
5( 0.1)
4( 0.1)
N=解析対象例数、n=発現例数
a)ARCT-154-01 試験は Grade 1 以上の例数、ARCT-154-J01 試験 Grade 0 以上の例数。Grade 0 は、紅斑、腫脹及び硬結
(2.5cm 未満)でのみ設定された。
b)ARCT-154-01 試験は 38℃以上(測定部位の規定なし)
、ARCT-154-J01 試験は 37.5℃以上(腋窩体温)とされた。
(1)初回免疫について
1)特定有害事象
特定有害事象(7 日間まで観察)の発現状況は表 18(7.2.1.2 参照)のとおりであり、多くが軽度又は
中等症の有害事象であった。
ARCT-154-01 試験パート 3b における特定有害事象の発現時期と持続期間を評価した。局所の特定有
害事象の発現時期の中央値は、本剤群及びプラセボ群ともに 1 日であった。また、持続期間の中央値は、
本剤群では 1~2 日、プラセボ群では 1~3 日であった。1 回目接種後と 2 回目接種後で発現時期及び持
続期間について大きな違いはなかった。全身性の特定有害事象の発現時期の中央値は、本剤群及びプラ
セボ群ともに 1~2 日であり、持続期間の中央値は本剤群では 1~2 日、プラセボ群では 1~3 日であっ
た。発現時期、持続期間の範囲[最大値, 最小値]はいずれも[1, 7]日であった。本剤群について 1 回
目接種後と 2 回目接種後で発現時期及び持続期間について大きな違いはなかった。なお、7 日目以降も
持続した特定有害事象 44)は、本剤群 1 回目 58 例(0.8%)
、2 回目 72 例(0.9%)、プラセボ群 1 回目 66
例(0.8%)
、2 回目 72 例(0.9%)であり、発現率は非常に低く、プラセボ群と明確な差は認められなか
った。
2)特定外有害事象及び重篤な有害事象
特定外有害事象の発現状況は表 19(7.2.1.2 参照)のとおりであり、多くが軽度又は中等症の有害事象
であった。重篤な有害事象について、7.2.1.2 項に記載のとおり、治験薬との因果関係は否定されなかっ
た事象が数件認められたものの、いずれも転帰は回復であり、本剤接種により特段懸念すべき状況は認
められなかった。
3)年齢別の有害事象
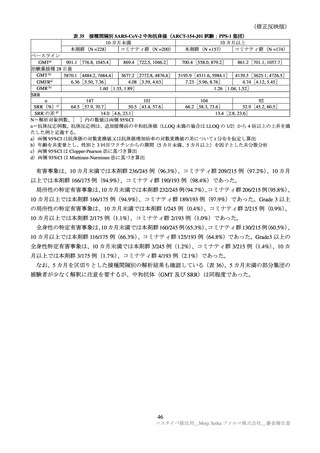
年齢別の特定有害事象(全体及び Grade 3 以上)は、表 31 のとおりであった。高齢者では非高齢者と
比較して、1 回目、2 回目ともに特定有害事象発現割合が低い傾向が認められた。
44)特定有害事象(治験薬接種後から 7 日間と定義)の持続期間については、7 日まで検討したが、その後も認められた場
合は、特定外有害事象に分類された。局所及び全身性の特定外有害事象とされた事象について、割合を検討した。
36
コスタイベ筋注用_Meiji Seika ファルマ株式会社_審査報告書