よむ、つかう、まなぶ。
参考資料1 コスタイベ筋注用 審議結果報告書 (56 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43635.html |
| 出典情報 | 薬事審議会 血液事業部会安全技術調査会(令和6年度第2回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(修正反映版)
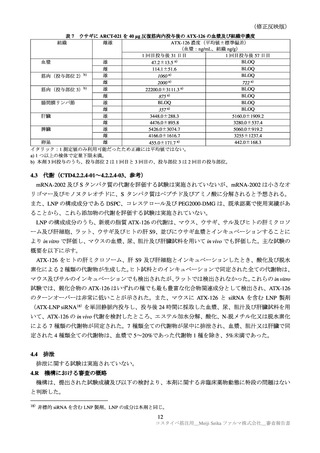
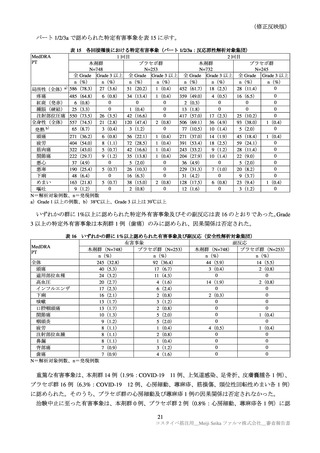
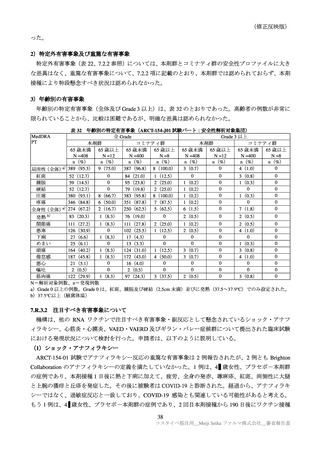
表 37
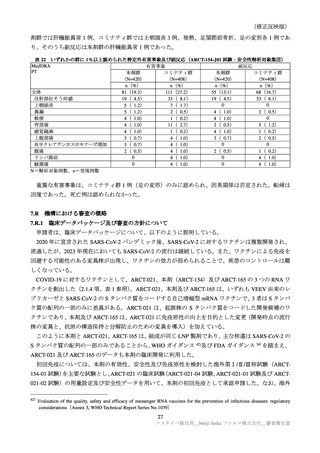
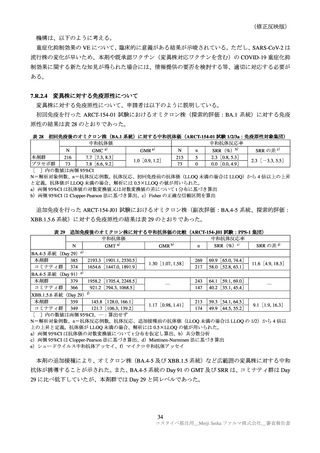
国内第Ⅲ相試験(ARCT-154-J01 試験)における特定有害事象の持続期間(安全性解析対象集団)
本剤群
N=420
コミナティ群
N=408
n
n
中央値
[範囲]
中央値
[範囲]
52
5.0
85
3.0
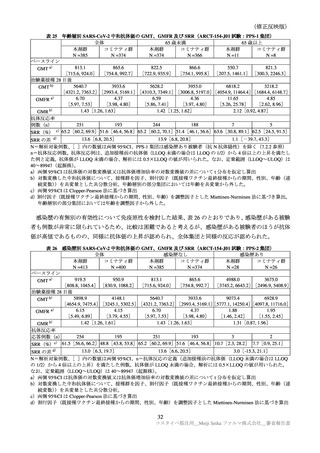
局所
紅斑
[2, 17]
[2, 14]
59
3.0
97
3.0
腫脹
[2, 06]
[2, 14]
52
3.0
81
3.0
硬結
[2, 08]
[2, 15]
388
4.0
391
4.0
圧痛
[1, 29]
[2, 15]
352
3.0
358
3.0
疼痛
[2, 10]
[2, 09]
84
2.0
76
2.0
全身性 発熱
[1, 03]
[1, 04]
112
2.0
113
2.0
関節痛
[2, 09]
[2, 12]
126
2.0
103
2.0
悪寒
[2, 07]
[1, 04]
28
2.0
17
2.0
下痢
[2, 06]
[2, 11]
25
2.0
13
2.0
めまい
[2, 06]
[2, 06]
165
2.0
125
2.0
頭痛
[1, 09]
[2, 09]
188
2.0
176
2.0
倦怠感
[2, 09]
[2, 12]
21
2.0
16
2.0
悪心
[2, 05]
[1, 10]
2
2.0
2
2.0
嘔吐
[2, 02]
[2, 02]
123
2.0
100
3.0
筋肉痛
[2, 09]
[2, 12]
N=解析対象例数、n=発現例数
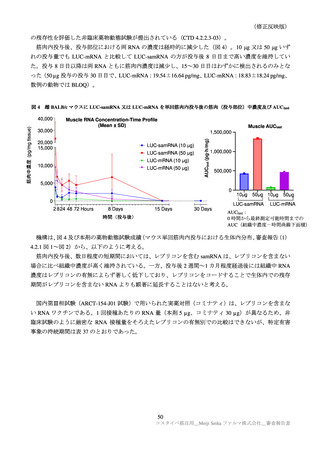
臨床試験の特定有害事象の持続期間について、本剤とコミナティの群間に明らかな差は認められてい
ない。この結果から機構は、本剤がレプリコンを含むことで、副反応の症状が既承認 RNA ワクチンと
比較して著しく持続又は延長する可能性は低いと考える。
特定局所有害事象の紅斑、腫脹、硬結など一部の事象については、本剤群の発現割合がコミナティ群
より低い値を示している(審査報告(1)7.2.2 表 21 参照)。しかしながら、重症(Grade 3 以上)での割
合には特段の差は認められておらず、臨床的な意義がある差とまではいえない。本剤の RNA 接種量は
既承認ワクチンより少量であるが、提出された臨床試験成績は、既承認 RNA ワクチンに比し安全性が
向上したことを示す成績ではないと考える。
有効性について、ARCT-154-J01 試験の Day 91 の免疫原性(審査報告(1)7.R.2.4 表 29)では、中和
抗体価がコミナティより高い傾向が認められた。また、実施中の国内外の第Ⅲ相試験(ARCT-154-01 試
験及び ARCT-154-J01 試験)
は約 12 カ月間まで実施し免疫原性も評価される計画である。
しかしながら、
現時点において、中和抗体価について予防に必要な閾値等は明確になっておらず、抗体価の差異から VE
がどの程度向上するかを推測することは難しいと機構は考える。したがって、今後得られる臨床試験成
績において、抗体価に群間差が認められる場合であっても、その解釈には限界があることに留意する必
要があると考える。
1.2 医薬品リスク管理計画(案)について
審査報告(1)の「7.R.6 製造販売後の検討事項について」に記載した機構の判断は専門委員から支持
された。
機構は、現時点における本剤の医薬品リスク管理計画(案)について、表 38 に示す安全性検討事項を
設定すること、並びに表 39 及び表 40 に示す追加の医薬品安全性監視活動及び追加のリスク最小化活動
を実施することが適切と判断した。
51
コスタイベ筋注用_Meiji Seika ファルマ株式会社_審査報告書
表 37
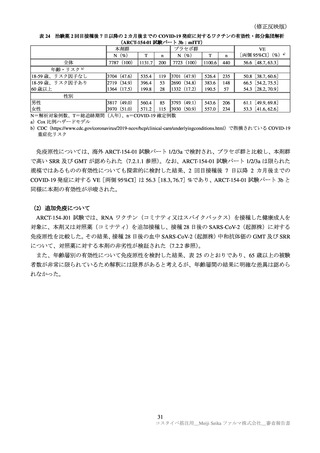
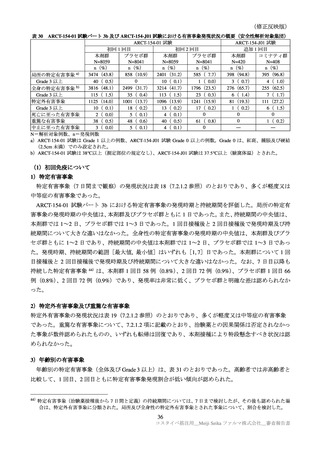
国内第Ⅲ相試験(ARCT-154-J01 試験)における特定有害事象の持続期間(安全性解析対象集団)
本剤群
N=420
コミナティ群
N=408
n
n
中央値
[範囲]
中央値
[範囲]
52
5.0
85
3.0
局所
紅斑
[2, 17]
[2, 14]
59
3.0
97
3.0
腫脹
[2, 06]
[2, 14]
52
3.0
81
3.0
硬結
[2, 08]
[2, 15]
388
4.0
391
4.0
圧痛
[1, 29]
[2, 15]
352
3.0
358
3.0
疼痛
[2, 10]
[2, 09]
84
2.0
76
2.0
全身性 発熱
[1, 03]
[1, 04]
112
2.0
113
2.0
関節痛
[2, 09]
[2, 12]
126
2.0
103
2.0
悪寒
[2, 07]
[1, 04]
28
2.0
17
2.0
下痢
[2, 06]
[2, 11]
25
2.0
13
2.0
めまい
[2, 06]
[2, 06]
165
2.0
125
2.0
頭痛
[1, 09]
[2, 09]
188
2.0
176
2.0
倦怠感
[2, 09]
[2, 12]
21
2.0
16
2.0
悪心
[2, 05]
[1, 10]
2
2.0
2
2.0
嘔吐
[2, 02]
[2, 02]
123
2.0
100
3.0
筋肉痛
[2, 09]
[2, 12]
N=解析対象例数、n=発現例数
臨床試験の特定有害事象の持続期間について、本剤とコミナティの群間に明らかな差は認められてい
ない。この結果から機構は、本剤がレプリコンを含むことで、副反応の症状が既承認 RNA ワクチンと
比較して著しく持続又は延長する可能性は低いと考える。
特定局所有害事象の紅斑、腫脹、硬結など一部の事象については、本剤群の発現割合がコミナティ群
より低い値を示している(審査報告(1)7.2.2 表 21 参照)。しかしながら、重症(Grade 3 以上)での割
合には特段の差は認められておらず、臨床的な意義がある差とまではいえない。本剤の RNA 接種量は
既承認ワクチンより少量であるが、提出された臨床試験成績は、既承認 RNA ワクチンに比し安全性が
向上したことを示す成績ではないと考える。
有効性について、ARCT-154-J01 試験の Day 91 の免疫原性(審査報告(1)7.R.2.4 表 29)では、中和
抗体価がコミナティより高い傾向が認められた。また、実施中の国内外の第Ⅲ相試験(ARCT-154-01 試
験及び ARCT-154-J01 試験)
は約 12 カ月間まで実施し免疫原性も評価される計画である。
しかしながら、
現時点において、中和抗体価について予防に必要な閾値等は明確になっておらず、抗体価の差異から VE
がどの程度向上するかを推測することは難しいと機構は考える。したがって、今後得られる臨床試験成
績において、抗体価に群間差が認められる場合であっても、その解釈には限界があることに留意する必
要があると考える。
1.2 医薬品リスク管理計画(案)について
審査報告(1)の「7.R.6 製造販売後の検討事項について」に記載した機構の判断は専門委員から支持
された。
機構は、現時点における本剤の医薬品リスク管理計画(案)について、表 38 に示す安全性検討事項を
設定すること、並びに表 39 及び表 40 に示す追加の医薬品安全性監視活動及び追加のリスク最小化活動
を実施することが適切と判断した。
51
コスタイベ筋注用_Meiji Seika ファルマ株式会社_審査報告書