よむ、つかう、まなぶ。
参考資料1 コスタイベ筋注用 審議結果報告書 (57 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_43635.html |
| 出典情報 | 薬事審議会 血液事業部会安全技術調査会(令和6年度第2回 9/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(修正反映版)
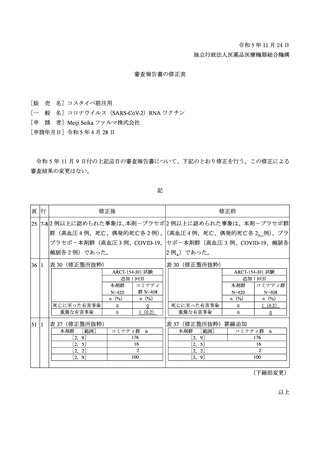
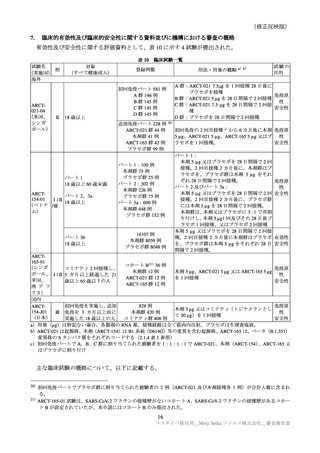
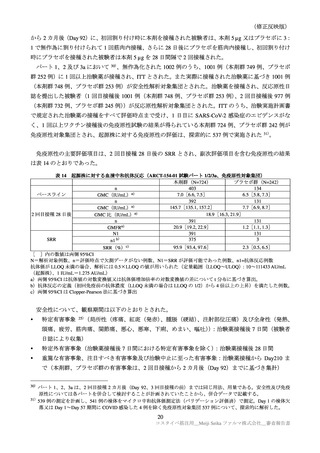
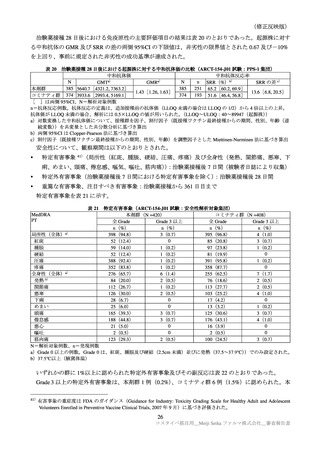
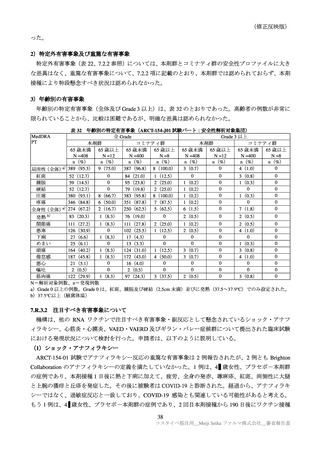
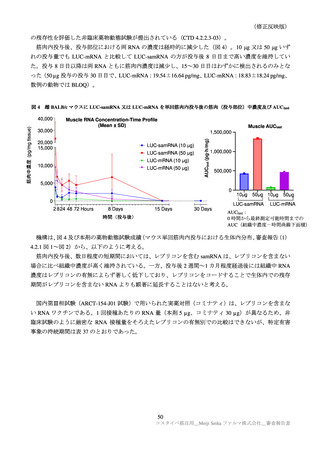
表 38
安全性検討事項
重要な特定されたリスク
・ショック、アナフィラキシー
医薬品リスク管理計画(案)における安全性検討事項
重要な潜在的リスク
重要な不足情報
・心筋炎・心膜炎
・妊婦及び授乳婦への接種における安
・ ワ ク チ ン 接 種 に 伴 う 疾 患 増 強 全性
( Vaccine-associated enhanced disease
(VAED))及びワクチン関連の呼吸
器 疾 患 増 強 ( Vaccine-associated
enhanced respiratory disease(VAERD)
)
・ギラン・バレー症候群
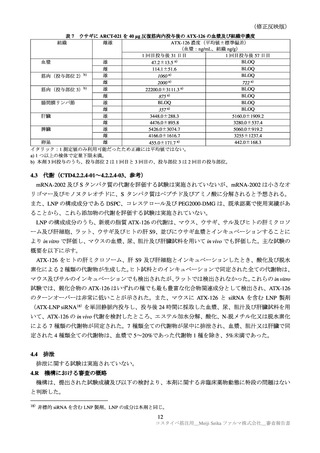
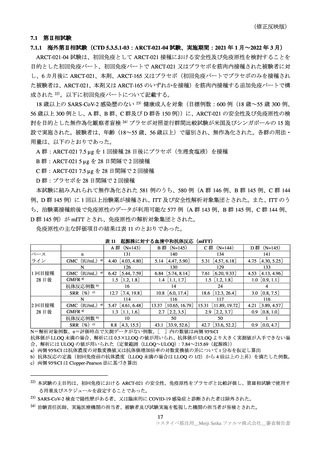
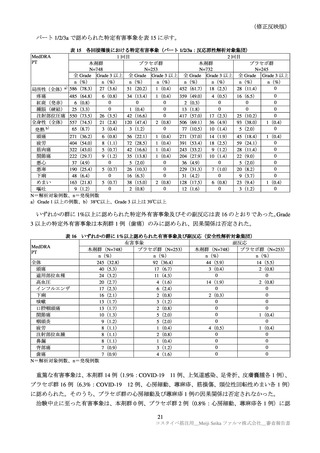
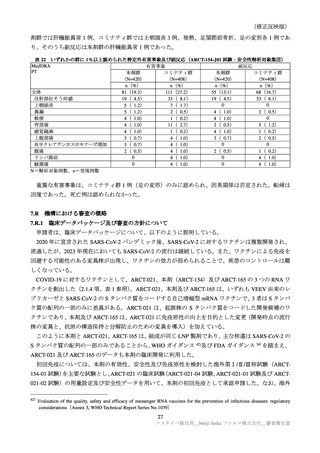
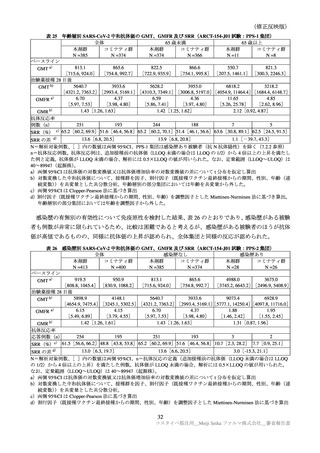
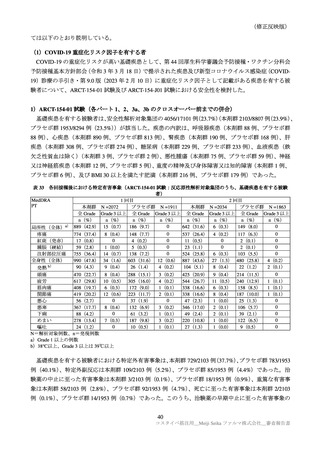
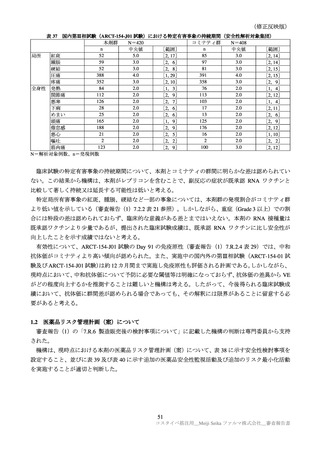
表 39
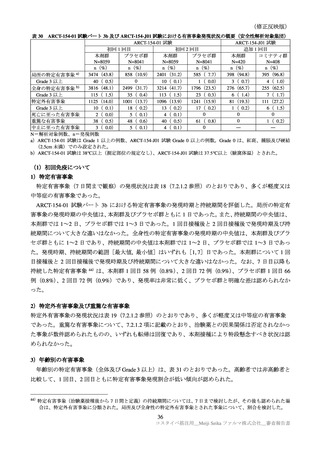
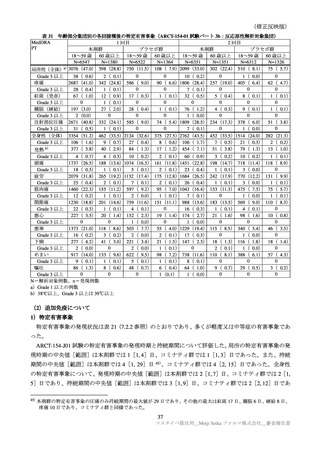
医薬品リスク管理計画(案)における追加の医薬品安全性監視活動及び追加のリスク最小化活動の概要
追加のリスク最小化活動
追加の医薬品安全性監視活動
・市販直後調査による情報提供
・市販直後調査
・一般使用成績調査
・医療従事者向け資材の作成及び提供
・製造販売後臨床試験(ARCT-154-J01 試験)
・被接種者向け資材の作成及び提供
・副反応発現状況の定期的な公表
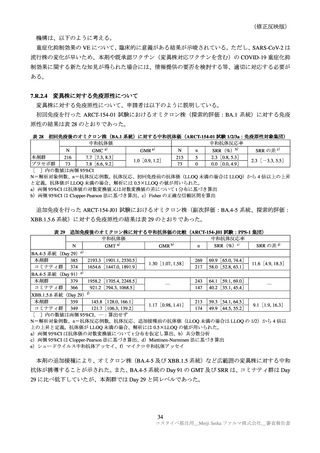
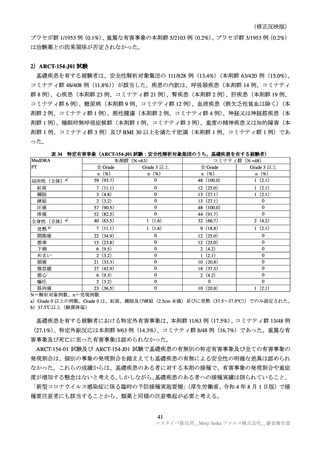
目
的
調査方法
対象患者
観察期間
予定症例数
主な調査項目
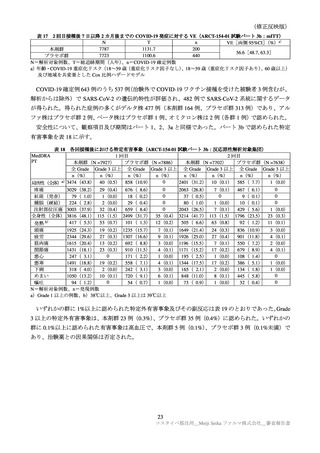
表 40 一般使用成績調査計画の骨子(案)
製造販売後の使用実態下における本剤の初回免疫(1 回目接種及び 2 回目接種)又は追加免疫におけ
る安全性を検討する。
中央登録方式
18 歳以上で本剤の接種(初回免疫、追加免疫)を受ける者
12 週間
安全性解析対象症例として 1250 例
被接種者の背景、本剤の接種状況、併用薬剤、有害事象・副反応の発現状況、COVID-19罹患状況
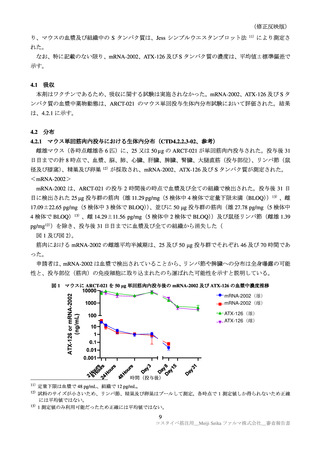
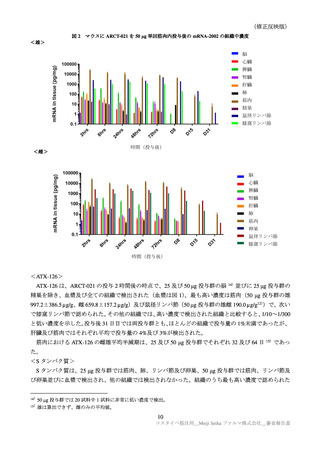
1.3 原薬の有効期間について
原薬の安定性試験成績について、5′キャップ化率及びポリ A 鎖の 23 カ月時点の長期保存試験成績が
提出された。申請者は、23 カ月までの時点において、5′キャップ化率及びポリ A 鎖を含む全ての試験
項目に明確な変化が認められず、規格に適合していたこと確認した。この結果から申請者は、原薬の有
効期間は、
容器及び
キャップを用
いて-60℃以下で保存するとき、23 カ月と設定すると説明した。
機構は、申請者の説明を受入れ可能と判断した。
2.
機構による承認申請書に添付すべき資料に係る適合性調査結果及び機構の判断
2.1 適合性書面調査結果に対する機構の判断
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律の規定に基づき承認申請書に添
付すべき資料に対して適合性書面調査を実施した。その結果、提出された承認申請資料に基づいて審査
を行うことについて支障はないものと機構は判断した。
2.2 GCP 実地調査結果に対する機構の判断
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律の規定に基づき承認申請書に添
付すべき資料(CTD5.3.5.1-01、CTD5.3.5.1-04)に対して GCP 実地調査を実施した。その結果、提出さ
れた承認申請資料に基づいて審査を行うことについて支障はないものと機構は判断した。
3.
総合評価
以上の審査を踏まえ、機構は、下記の承認条件を付した上で、承認申請された効能・効果及び用法・
用量を以下のように整備し、承認して差し支えないと判断する。本品目は新有効成分含有医薬品である
52
コスタイベ筋注用_Meiji Seika ファルマ株式会社_審査報告書
表 38
安全性検討事項
重要な特定されたリスク
・ショック、アナフィラキシー
医薬品リスク管理計画(案)における安全性検討事項
重要な潜在的リスク
重要な不足情報
・心筋炎・心膜炎
・妊婦及び授乳婦への接種における安
・ ワ ク チ ン 接 種 に 伴 う 疾 患 増 強 全性
( Vaccine-associated enhanced disease
(VAED))及びワクチン関連の呼吸
器 疾 患 増 強 ( Vaccine-associated
enhanced respiratory disease(VAERD)
)
・ギラン・バレー症候群
表 39
医薬品リスク管理計画(案)における追加の医薬品安全性監視活動及び追加のリスク最小化活動の概要
追加のリスク最小化活動
追加の医薬品安全性監視活動
・市販直後調査による情報提供
・市販直後調査
・一般使用成績調査
・医療従事者向け資材の作成及び提供
・製造販売後臨床試験(ARCT-154-J01 試験)
・被接種者向け資材の作成及び提供
・副反応発現状況の定期的な公表
目
的
調査方法
対象患者
観察期間
予定症例数
主な調査項目
表 40 一般使用成績調査計画の骨子(案)
製造販売後の使用実態下における本剤の初回免疫(1 回目接種及び 2 回目接種)又は追加免疫におけ
る安全性を検討する。
中央登録方式
18 歳以上で本剤の接種(初回免疫、追加免疫)を受ける者
12 週間
安全性解析対象症例として 1250 例
被接種者の背景、本剤の接種状況、併用薬剤、有害事象・副反応の発現状況、COVID-19罹患状況
1.3 原薬の有効期間について
原薬の安定性試験成績について、5′キャップ化率及びポリ A 鎖の 23 カ月時点の長期保存試験成績が
提出された。申請者は、23 カ月までの時点において、5′キャップ化率及びポリ A 鎖を含む全ての試験
項目に明確な変化が認められず、規格に適合していたこと確認した。この結果から申請者は、原薬の有
効期間は、
容器及び
キャップを用
いて-60℃以下で保存するとき、23 カ月と設定すると説明した。
機構は、申請者の説明を受入れ可能と判断した。
2.
機構による承認申請書に添付すべき資料に係る適合性調査結果及び機構の判断
2.1 適合性書面調査結果に対する機構の判断
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律の規定に基づき承認申請書に添
付すべき資料に対して適合性書面調査を実施した。その結果、提出された承認申請資料に基づいて審査
を行うことについて支障はないものと機構は判断した。
2.2 GCP 実地調査結果に対する機構の判断
医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律の規定に基づき承認申請書に添
付すべき資料(CTD5.3.5.1-01、CTD5.3.5.1-04)に対して GCP 実地調査を実施した。その結果、提出さ
れた承認申請資料に基づいて審査を行うことについて支障はないものと機構は判断した。
3.
総合評価
以上の審査を踏まえ、機構は、下記の承認条件を付した上で、承認申請された効能・効果及び用法・
用量を以下のように整備し、承認して差し支えないと判断する。本品目は新有効成分含有医薬品である
52
コスタイベ筋注用_Meiji Seika ファルマ株式会社_審査報告書