会議資料 (46 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00031.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第57回 ) |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
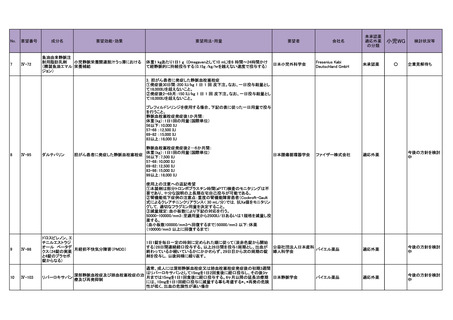
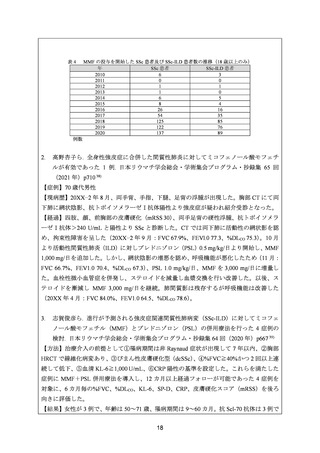
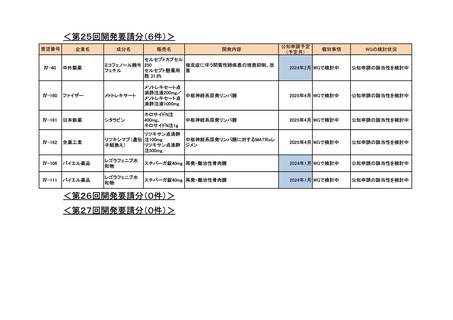
500~3,000 mg/日とされている。
また、Medical Date Vision 社の国内病院請求データを用いた使用実態調査の結果、初回投
与量は 500 mg/日が 34.6%、1,000 mg/日が 38.1%、最大投与量は 1,000 mg/日が 34.9%、
1,500 mg/日が 23.1%、2,000 mg/日が 24.4%及び 3,000 mg/日が 1.9%であり、要望用法・用量
の通常用量(1 回 250~1,000 mg を 1 日 2 回投与)での使用が過半数以上であったこと、最
大 3,000 mg/日までの SSc-ILD 患者における使用実態が確認できること及び既承認効能での
使用時も含めて現時点において安全性上の懸念は認められていないことを踏まえ、用法・
用量を「1 回 250~1,000 mg を 1 日 2 回 12 時間毎に食後経口投与する。なお、年齢、症状
により適宜増減するが、1 日 3,000 mg を上限とする。」とすることは適切と考えた。
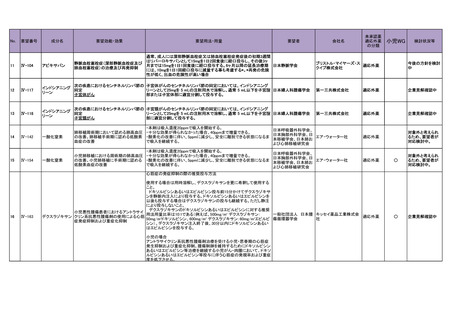
なお、本剤の主な消失経路が腎排泄であることを踏まえて現行の添付文書の<用法及び
用量に関連する注意>の項に記載されている、重度の慢性腎不全患者に対する注意等に関
しては、SSc-ILD 患者に対しても適用することが適切と考える。
9.要望内容に係る更なる使用実態調査等の必要性について
(1)要望内容について現時点で国内外のエビデンスまたは臨床使用実態が不足している点
の有無について
現時点で追加すべき試験又は調査はないと考える。
(2)上記(1)で臨床使用実態が不足している場合は、必要とされる使用実態調査等の内
容について
なし
(3)その他、製造販売後における留意点について
本剤はヒトにおいて催奇形性が報告されていることから、既存の効能・効果と同様に、
妊娠する可能性のある女性への使用に際して添付文書で注意喚起されている内容の周知徹
底を企業及び関連学会に求める必要があると考える。
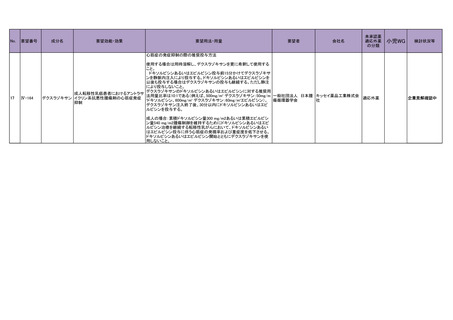
10.備考
なし
11.参考文献一覧
1)
全身性強皮症 診断基準・重症度分類・診療ガイドライン. 全身性強皮症 診断基準・
重症度分類・診療ガイドライン委員会. 日皮会誌 2016; 126: 1831-96
2)
全身性強皮症・限局性強皮症・好酸球性筋膜炎・硬化性萎縮性苔癬 診断基準・重症度
分類・診療ガイドライン. 強皮症・皮膚線維化疾患の診断基準・重症度分類・診療ガイ
ドライン作成委員会; 2016: p30-31
22
46 / 204