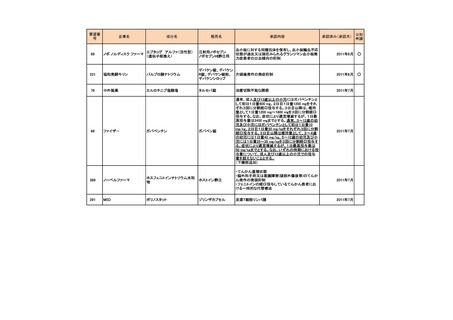
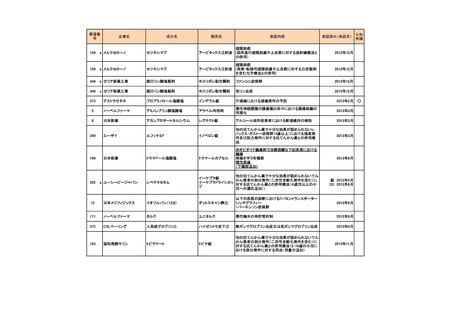
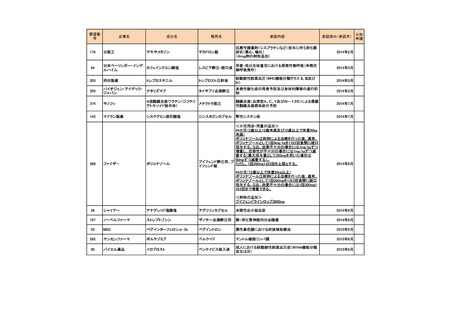
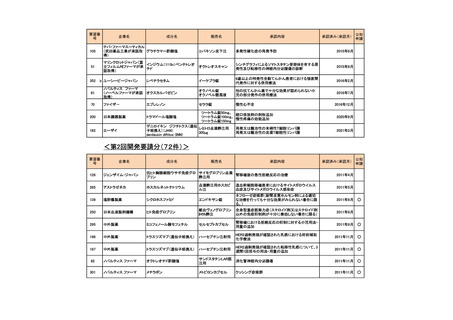
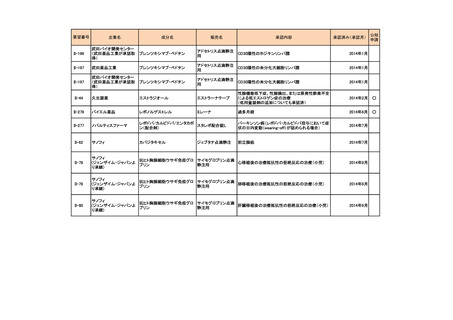
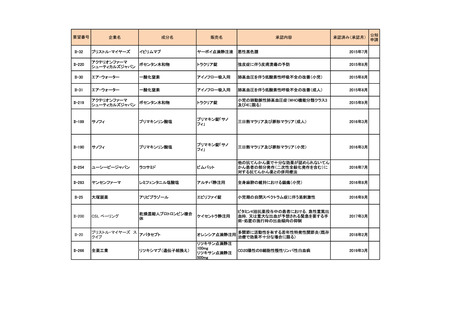
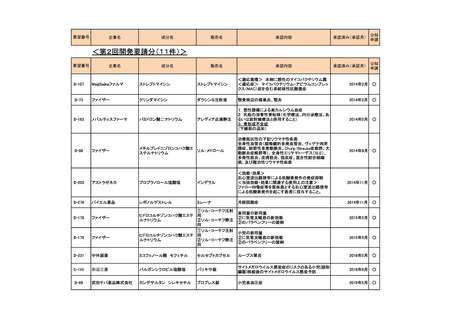
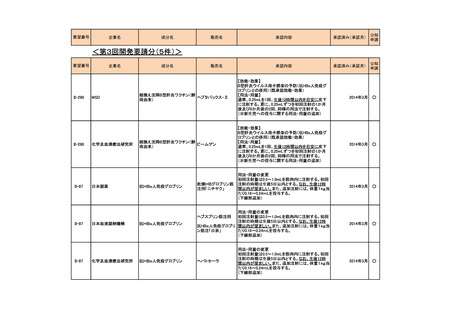
会議資料 (73 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00031.html |
| 出典情報 | 医療上の必要性の高い未承認薬・適応外薬検討会議(第57回 ) |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
国における開発の有 ていない]
(2023 年 9 月 14 日現在)
無)
備考
6)豪州
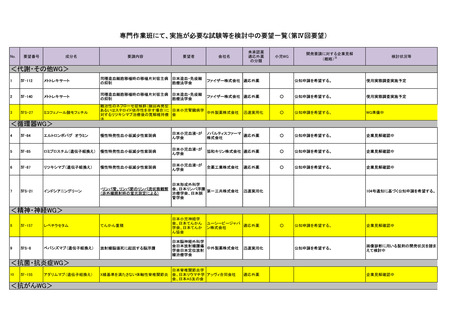
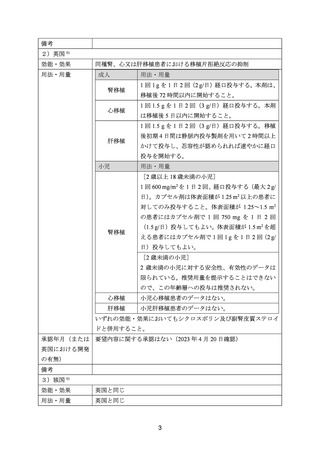
効能・効果
用法・用量
承認年月(または豪 子宮体癌の効能・効果については、承認されていない[開発を行っ
州における開発の有 ていない]
(2023 年 9 月 14 日現在)
無)
備考
(2)
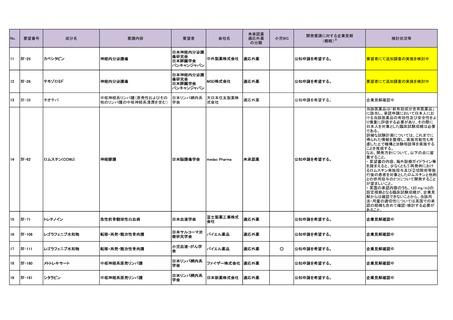
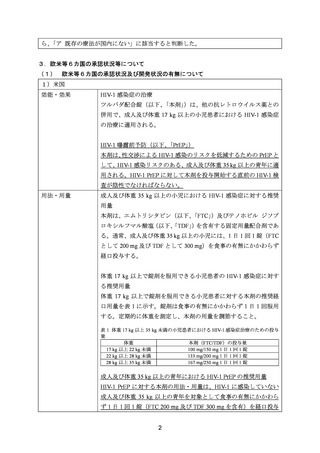
欧米等 6 カ国での標準的使用状況について
1)米国
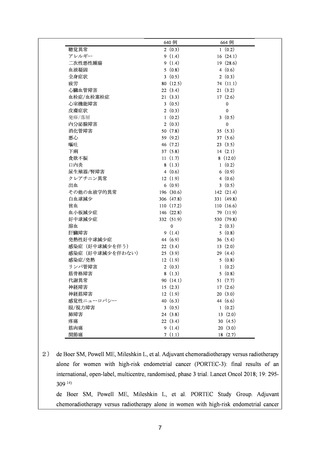
ガイドライン名
① National Comprehensive Cancer Network (NCCN) Clinical Practice
Guidelines in Oncology for Uterine Neoplasms Ver2.20231)
② National Cancer Institute, Endometrial Cancer Treatment (PDQ®)Health Professional Version2)
効能・効果
①
(または効能・効果に関
治療歴のない又は術後の子宮体癌(パクリタキセルとの併用投与)
連のある記載箇所)
再発又は難治性の子宮体癌(パクリタキセル又はドセタキセル水和
物との併用投与)
②
ステージⅠ又はⅡの術後高リスク子宮体癌(パクリタキセルとの併
用投与)
ステージⅢ及びⅣ、並びに再発の子宮体癌(パクリタキセルとの併
用投与)
用法・用量
①
(または用法・用量に関
用法・用量について、ガイドラインに記載はないものの、公表論文
連のある記載箇所)
3)~6)
が引用されている。
②
用法・用量について、ガイドラインに記載はないものの、公表論文
3)、7)及び 8)
が引用されている。
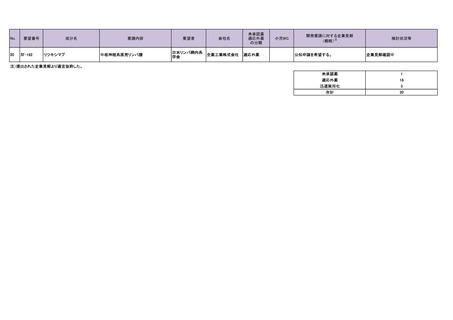
ガイドラインの根拠
①
論文
Gynecol Oncol 2012; 125: 771 [abstract] 3)
Gynecol Oncol 2013; 131: 581-5 4)
3
73 / 204