総-1○診療報酬改定結果検証部会からの報告について (259 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00169.html |
| 出典情報 | 中央社会保険医療協議会 総会(第532回 11/16)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
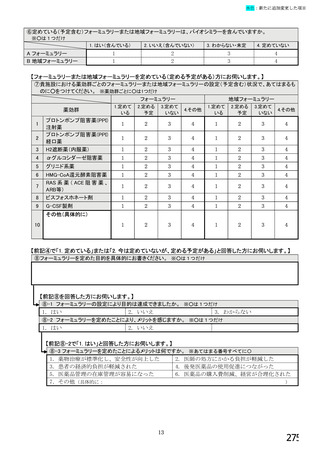
【すべての方にお伺いします。】
⑤貴施設では、外来患者に対して、バイオ後続品の院外処方箋を発行していますか。 ※○は1つだけ
※バイオ後続品の院外処方箋とは、バイオ後続品の製品名又は一般的名称で処方箋を発行する場合をいいます。
なお、バイオ後続品の院外処方箋発行の対象となるバイオ製品は在宅自己注射が可能な製品であり、現在使用できるバイオ後
続品は、インスリン製剤、ヒト成長ホルモン剤、エタネルセプト製剤、テリパラチド製剤です。
1.発行している →質問⑥へ
2. 発行していない →14ページの質問⑪へ
【前記⑤で「1.発行している」と回答した方にお伺いします。】
⑥発行する際、処方箋にどのように表記していますか。 ※○は1つだけ
1. バイオ後続品の販売名(例:「●●● BS注射液 含量 会社名」)
2. バイオ後続品の一般的名称(「○○○(遺伝子組換え)[●●●後続1]」)
3. バイオ後続品の一般的名称だが(遺伝子組換え)と記載しない(「○○○[●●●後続1]」)
4. 変更不可欄にチェックを入れずに先行品の販売名で処方
5. 変更不可欄にチェックを入れずに先行品の一般的名称で処方(「○○○(遺伝子組換え))
6. その他(具体的に:
)
⑦バイオ後続品を院外処方するにあたって薬局・薬剤師に望むことはありますか。 ※あてはまる番号すべてに○
1. 「一般名処方の調剤」または「バイオ後続品への変更調剤」について、予め合意した方法で情報提
供を受けること
2. 「一般名処方の調剤」または「バイオ後続品への変更調剤」について、合意方法や頻度によらず情
報提供を受けること
3. 患者に対して、バイオ後続品の品質や有効性、安全性について説明を行うこと
4. 患者に対して、バイオ後続品の普及啓発を行うこと
5. その他(具体的に:
)
【⑧、⑨は前記⑥で選択肢 2.3.5.(一般的名称で処方)を選んだ方にお伺いします。】
⑧バイオ医薬品を一般名処方で処方する理由は何ですか。 ※あてはまる番号すべてに○
1.
2.
3.
4.
5.
一般名処方加算のため
バイオ後続品導入初期加算のため
電子カルテで一般名が選択できるシステムになっているから
薬局薬剤師もデバイスについて患者の好みを確認し、医師に情報提供すべきだから
薬局薬剤師がバイオ後続品と先行バイオ医薬品のどちらを選択するかの患者の意向を確認し、
医師に情報提供すべきだから
6. その他(具体的に:
)
⑨バイオ後続品の一般名処方として望ましい表記はどれですか。 ※あてはまる番号すべてに○
1. バイオ後続品の一般的名称(「○○○(遺伝子組換え)[●●●後続1]」)
2. バイオ後続品の一般的名称だが(遺伝子組換え)と記載しない
(「○○○[●●●後続1]」)
3. 先行品の一般的名称(「○○○(遺伝子組換え))
4. その他(具体的に:
)
【前記⑤で「1.発行している」と回答した方にお伺いします。】
⑩令和4年診療報酬改定で外来腫瘍化学療法診療料、外来化学療法加算におけるバイオ後続品導入初期加算が新
設されたことで、貴施設におけるバイオ後続品の使用件数が増えましたか。 ※○は1つだけ
1. はい
2. いいえ
3. わからない
13
259