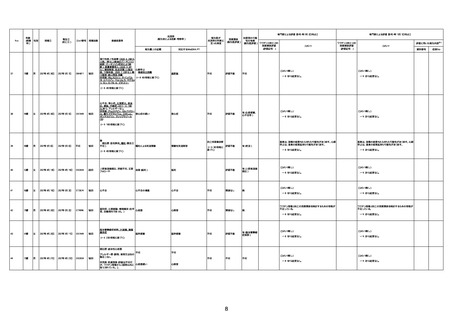
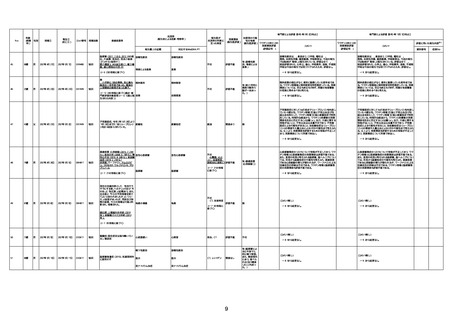
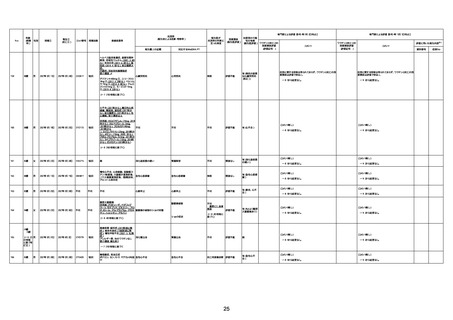
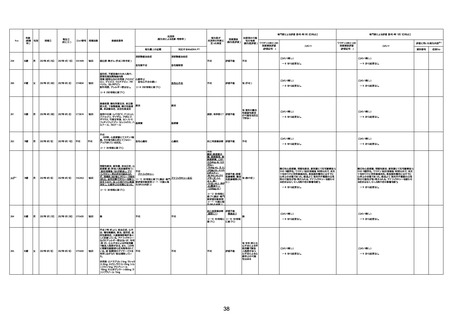
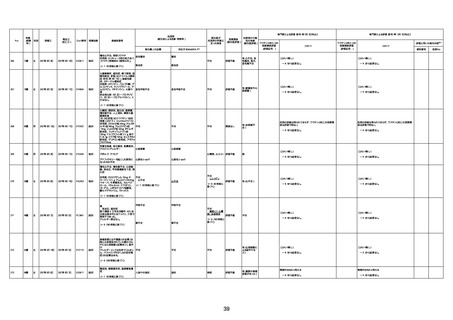
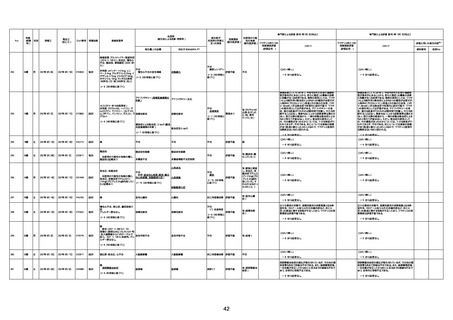
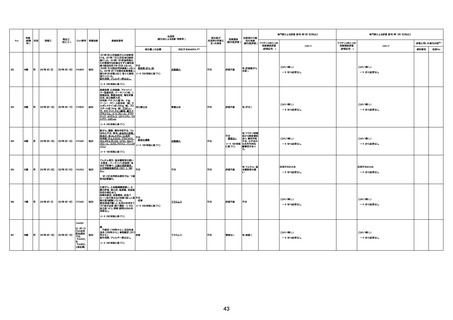
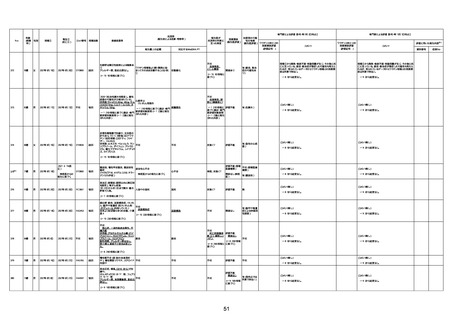
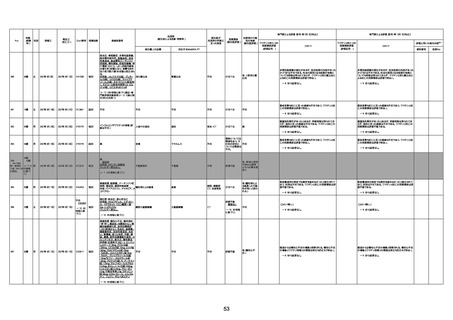
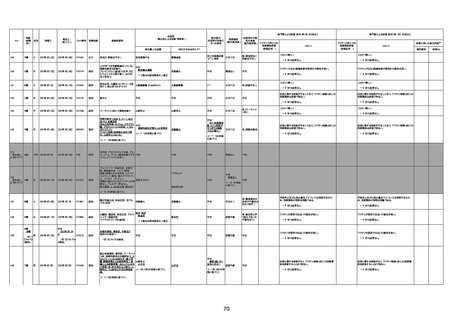
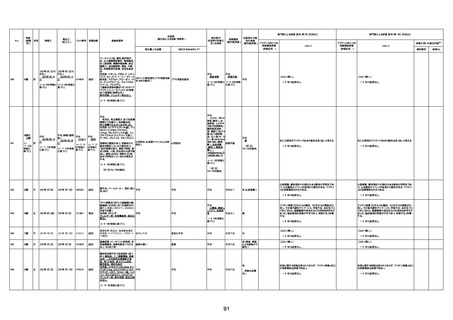
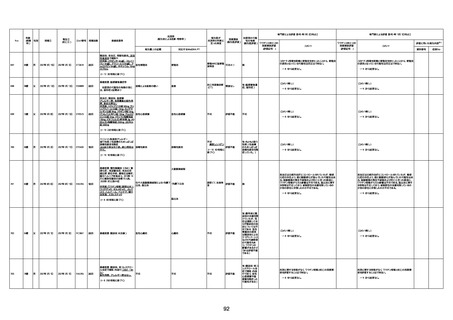
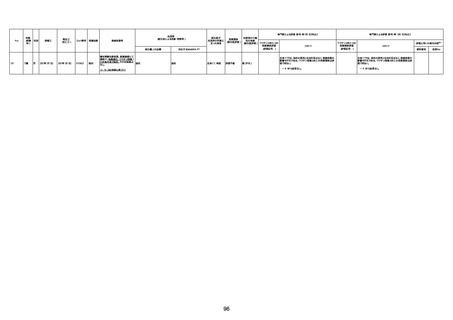
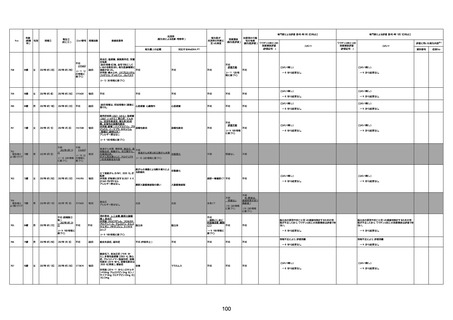
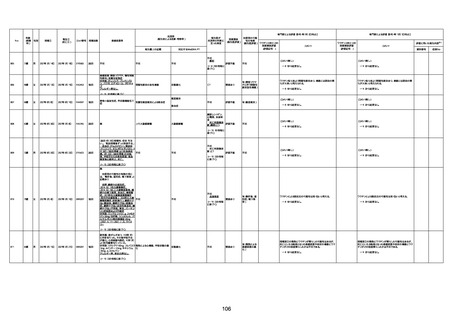
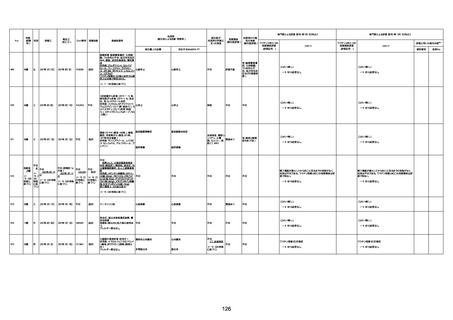
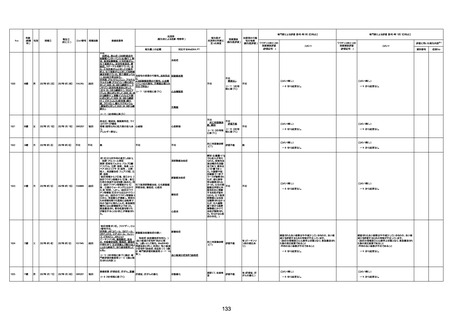
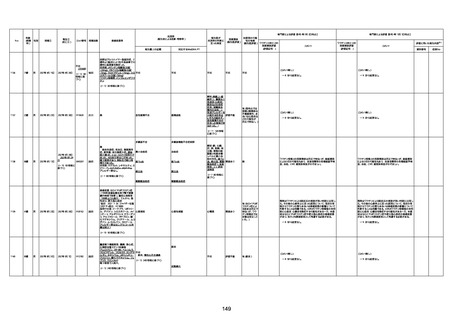
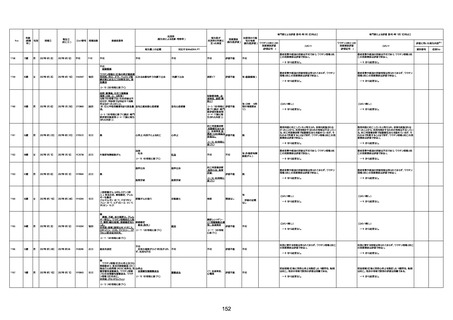
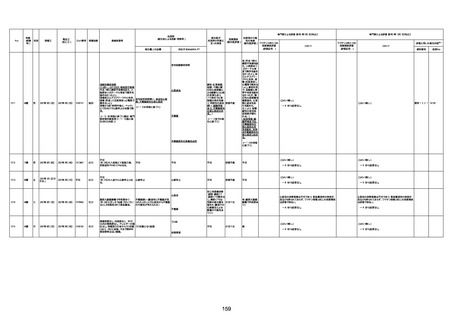
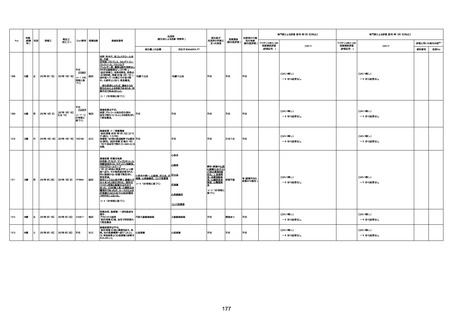
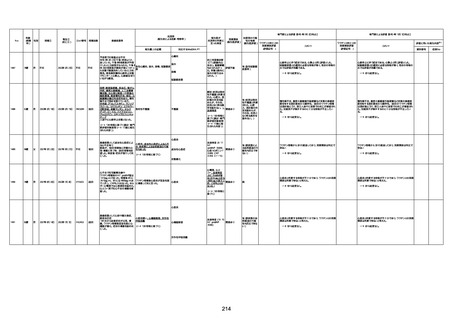
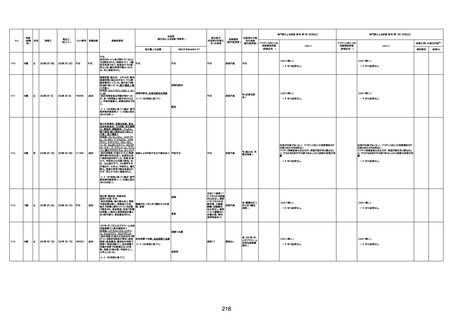
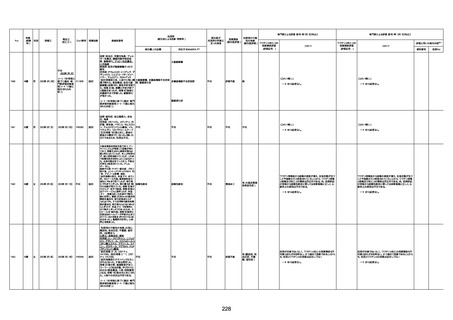
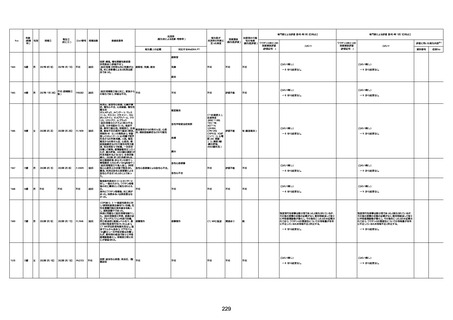
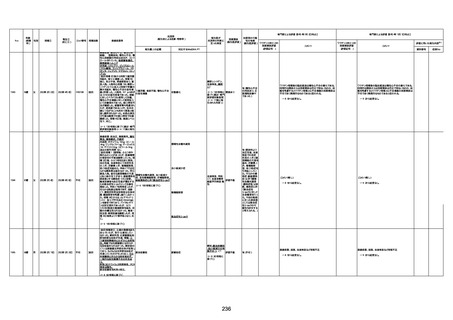
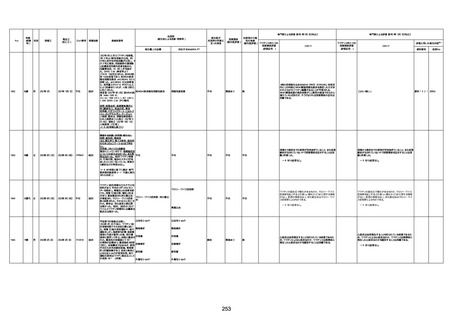
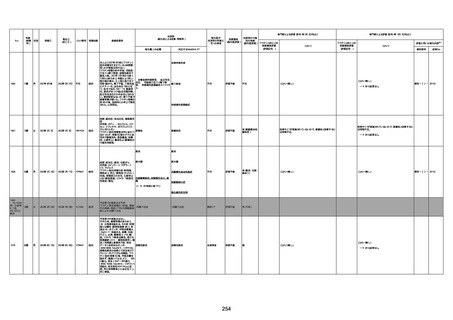
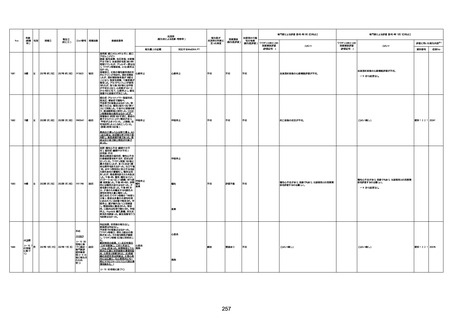
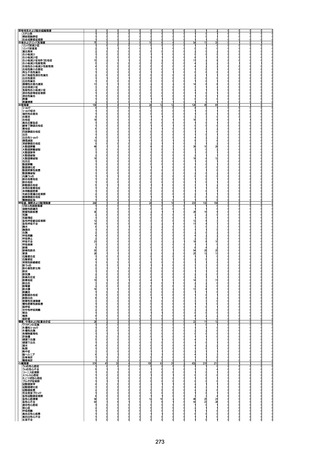
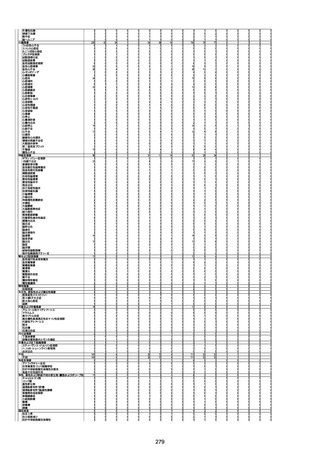
資料1-3-1 新型コロナワクチン接種後の死亡として報告された事例の概要(コミナティ筋注) (275 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00052.html |
| 出典情報 | 第85回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第14回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)(10/7)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1
1
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
皮膚筋炎
2
0
0
0
0
1
0
1
0
1
0
1
0
0
0
0
0
皮膚転移
1
1
1
0
0
0
0
0
0
0
0
0
0
0
0
0
0
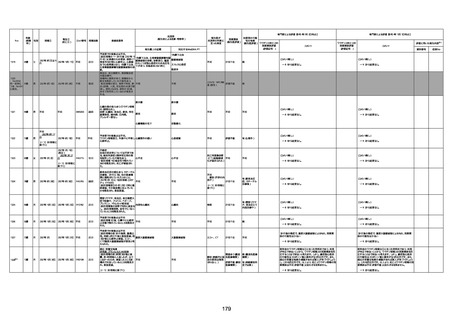
不明
356
19
10
7
2
46
31
11
4
281
152
120
9
10
7
2
1
不明
356
19
10
7
2
46
31
11
4
281
152
120
9
10
7
2
1
免疫系障害
19
0
0
0
0
1
0
1
0
18
11
7
0
0
0
0
0
アナフィラキシーショック
2
0
0
0
0
0
0
0
0
2
1
1
0
0
0
0
0
アナフィラキシー反応
11
0
0
0
0
0
0
0
0
11
7
4
0
0
0
0
0
血球貪食性リンパ組織球症
3
0
0
0
0
1
0
1
0
2
0
2
0
0
0
0
0
抗好中球細胞質抗体陽性血管炎
2
0
0
0
0
0
0
0
0
2
2
0
0
0
0
0
0
免疫介在性副作用
1
0
0
0
0
0
0
0
0
1
1
0
0
0
0
0
0
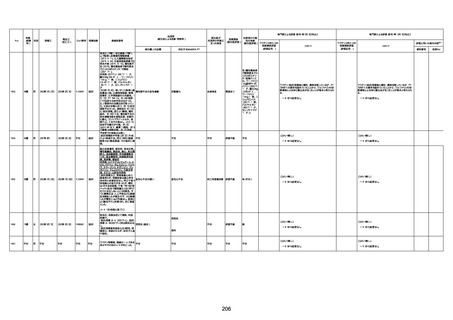
良性、悪性および詳細不明の新生物(嚢胞およびポリープを含む) 20
0
0
0
0
4
3
1
0
16
7
9
0
0
0
0
0
キャッスルマン病
1
0
0
0
0
1
1
0
0
0
0
0
0
0
0
0
0
リンパ腫
1
0
0
0
0
1
0
1
0
0
0
0
0
0
0
0
0
悪性リンパ腫
1
0
0
0
0
0
0
0
0
1
0
1
0
0
0
0
0
悪性新生物
1
0
0
0
0
0
0
0
0
1
1
0
0
0
0
0
0
胃癌
2
0
0
0
0
0
0
0
0
2
1
1
0
0
0
0
0
遠隔転移を伴う肝癌
1
0
0
0
0
0
0
0
0
1
0
1
0
0
0
0
0
遠隔転移を伴う脳悪性腫瘍
1
0
0
0
0
0
0
0
0
1
0
1
0
0
0
0
0
急性リンパ性白血病
1
0
0
0
0
1
1
0
0
0
0
0
0
0
0
0
0
急性骨髄性白血病
2
0
0
0
0
0
0
0
0
2
0
2
0
0
0
0
0
急性白血病
1
0
0
0
0
0
0
0
0
1
1
0
0
0
0
0
0
骨髄異形成症候群
2
0
0
0
0
0
0
0
0
2
1
1
0
0
0
0
0
骨髄線維症
1
0
0
0
0
1
1
0
0
0
0
0
0
0
0
0
0
小細胞肺癌
1
0
0
0
0
0
0
0
0
1
1
0
0
0
0
0
0
腎癌
1
0
0
0
0
0
0
0
0
1
1
0
0
0
0
0
0
白血病
1
0
0
0
0
0
0
0
0
1
1
0
0
0
0
0
0
卵巣癌
1
0
0
0
0
0
0
0
0
1
0
1
0
0
0
0
0
膵癌
1
0
0
0
0
0
0
0
0
1
0
1
0
0
0
0
0
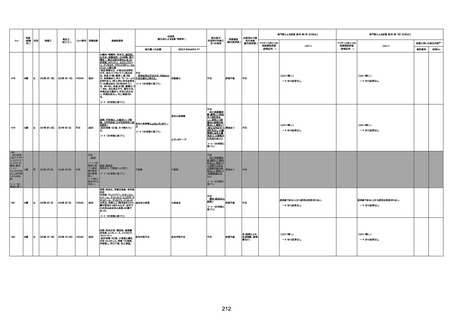
臨床検査
13
0
0
0
0
1
0
1
0
12
4
8
0
0
0
0
0
血圧上昇
1
0
0
0
0
1
0
1
0
0
0
0
0
0
0
0
0
血圧低下
3
0
0
0
0
0
0
0
0
3
0
3
0
0
0
0
0
血小板数減少
5
0
0
0
0
0
0
0
0
5
3
2
0
0
0
0
0
血小板数増加
1
0
0
0
0
0
0
0
0
1
0
1
0
0
0
0
0
抗アクアポリン4抗体陽性
1
0
0
0
0
0
0
0
0
1
0
1
0
0
0
0
0
抗好中球細胞質抗体陽性
1
0
0
0
0
0
0
0
0
1
1
0
0
0
0
0
0
細胞診異常
1
0
0
0
0
0
0
0
0
1
0
1
0
0
0
0
0
注1:9/4時点の報告内容に基づき集計。集計時点が別紙1(9/30)とは異なるため、追加報告の報告時期によっては、各症例の死因や年齢等について、別紙1とは異なることがある。
注2:同一症例に複数の死因等の記載がある場合はいずれも計上しているため、件数の総数と症例数は一致しない。
注3:「死因等」の記載は副反応疑い報告書の記載(接種の状況、症状の概要、報告者意見)を総合的に考慮の上、記載。資料1−1−2や資料1−2−2の「症状名(PT)」とは異なることがある。
注4:報告書における死因等の記載が基礎疾患の増悪等とされているものについては、本資料においては、7/21以降「対応するMedDRA PT」は基礎疾患等の名称ではなく、「状態悪化」として整理している。
注5:「血小板減少症を伴う血栓症」が死因として疑われると報告された事例については、「対応するMedDRA PT」には、令和3年10月22日までは、血小板減少に係る症状と血栓症に係る症状の両方を併記。10月22日以降は「血小板減少症
を伴う血栓症」と表記。10月22日までに報告された症例においても、10月22日以降の追加報告の際に、死因を「血小板減少症を伴う血栓症」に更新、又は死因に「血小板減少症を伴う血栓症」を追加している。
注6:1件の副反応疑い報告書において、異なる接種回の副反応疑い事例が同時に報告されている場合は、当該報告書における最大接種回数を、当該報告の「接種回数」として記載・集計している。「接種回数総計」は、接種回数が不明なものを含む。
275