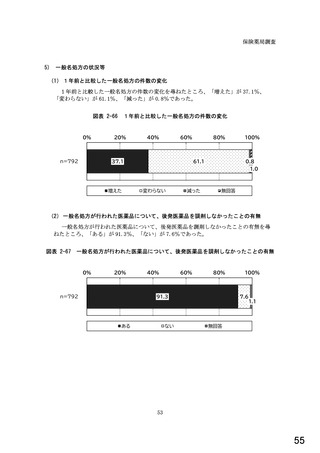
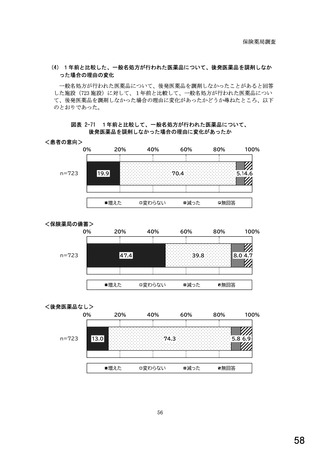
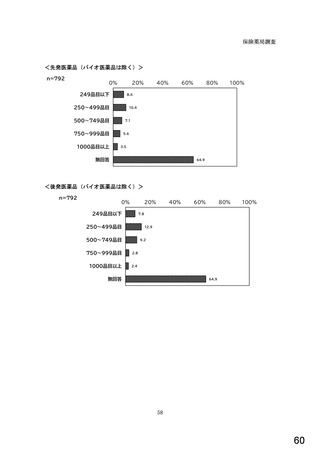
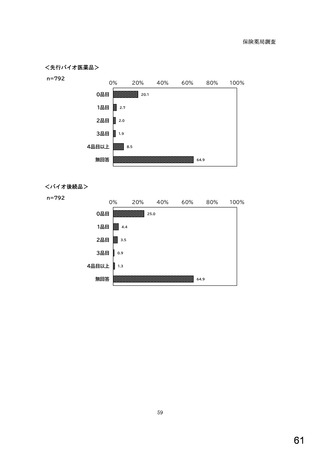
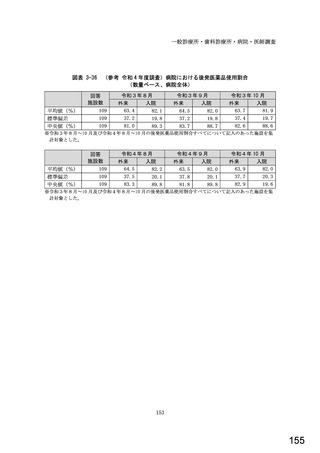
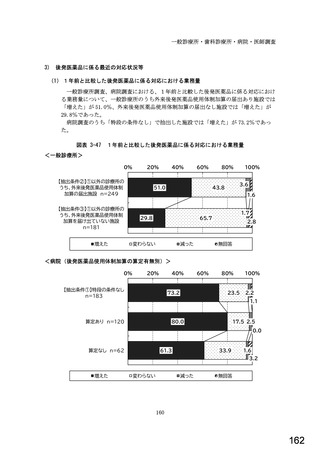
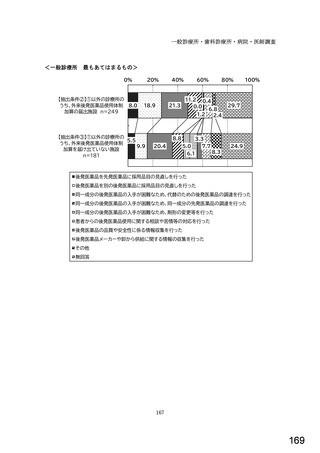
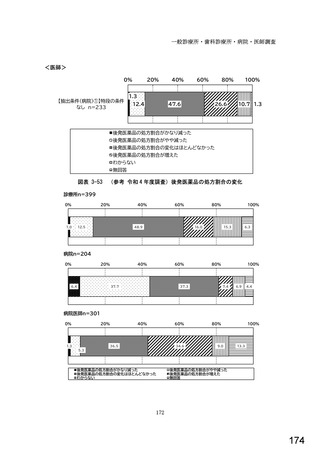
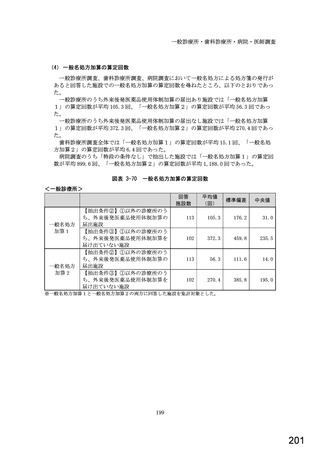
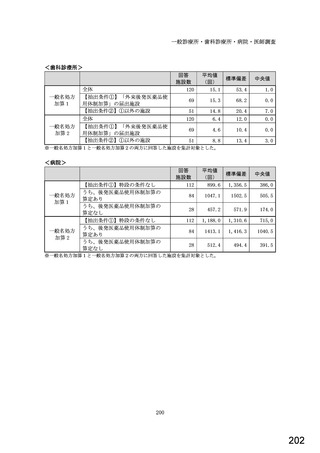
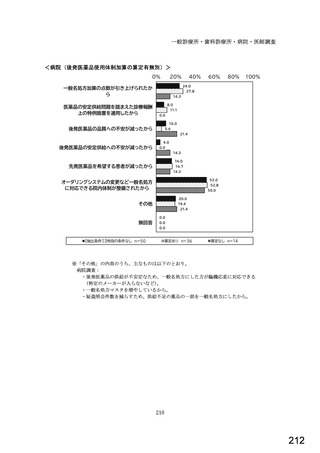
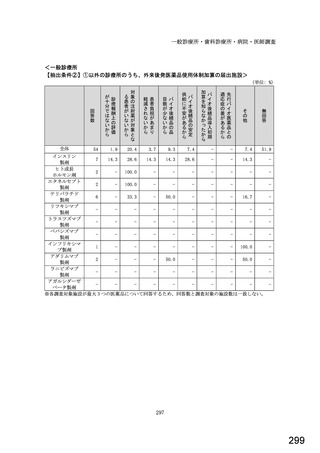
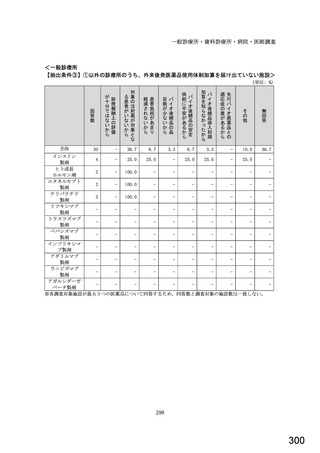
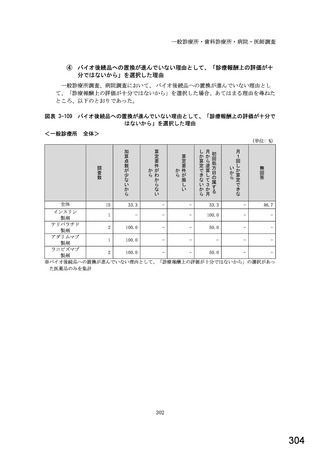
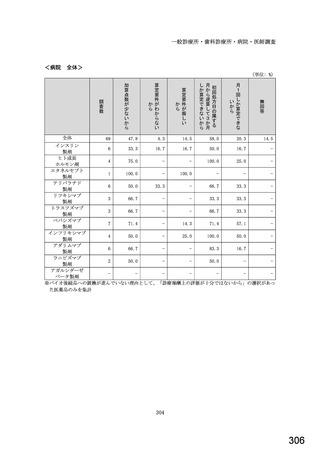
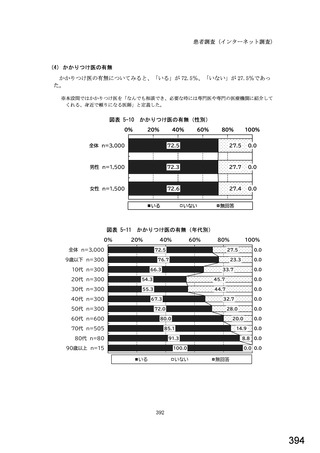
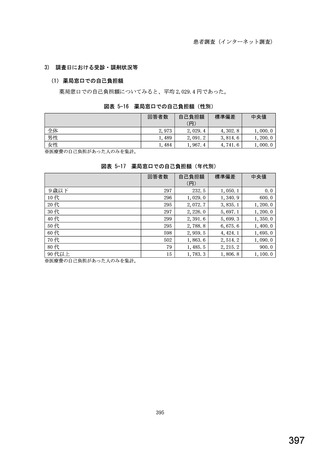
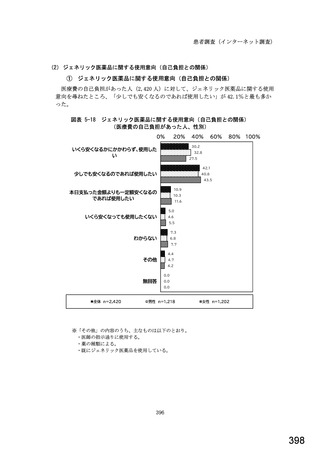
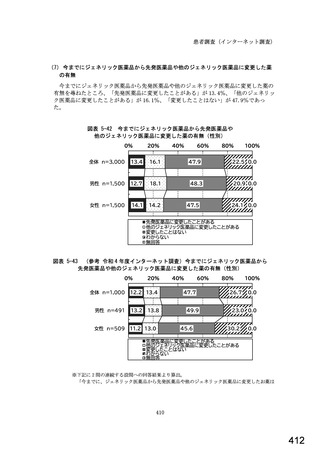
○診療報酬改定結果検証部会からの報告について 総-1-5-2 (249 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00222.html |
| 出典情報 | 中央社会保険医療協議会 総会(第563回 11/10)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
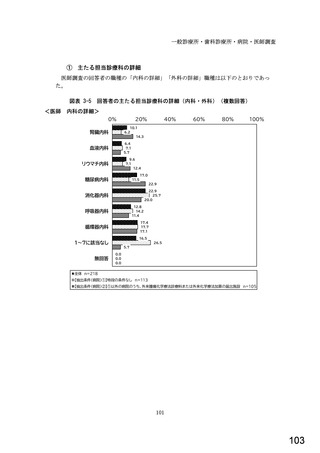
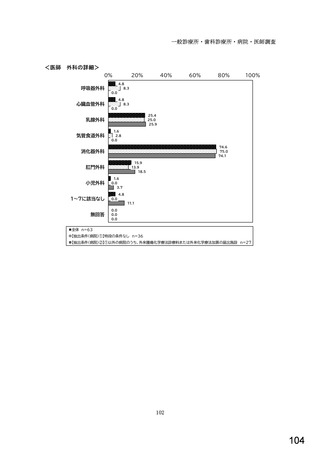
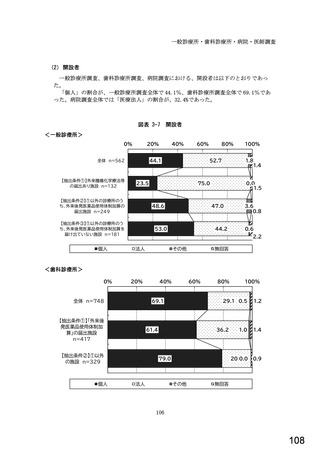
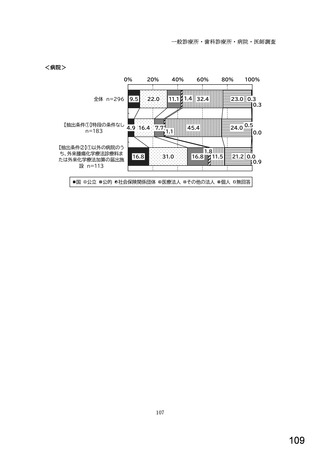
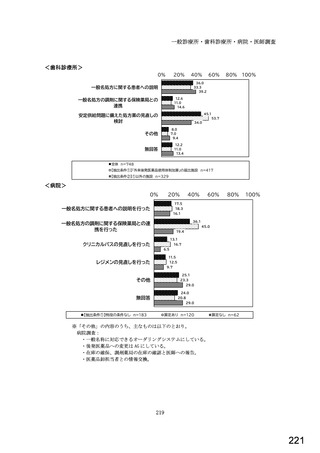
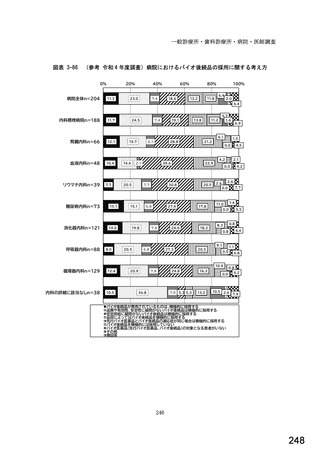
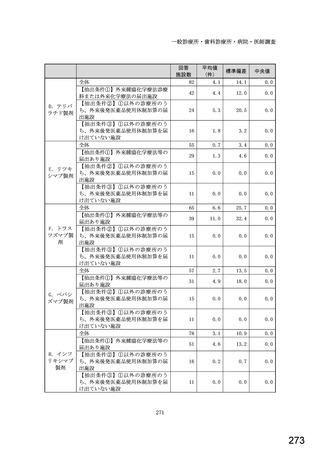
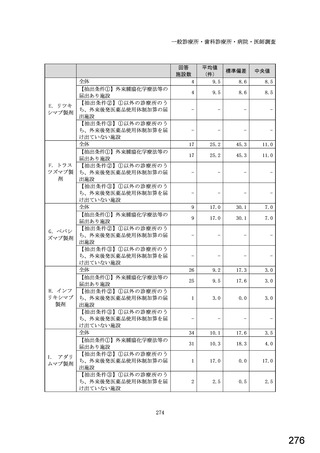
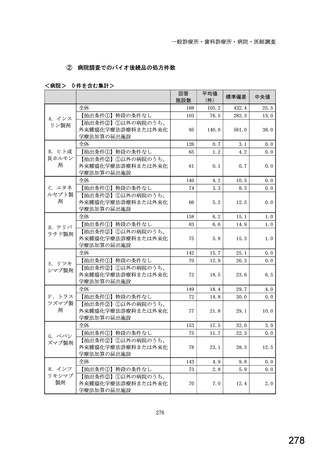
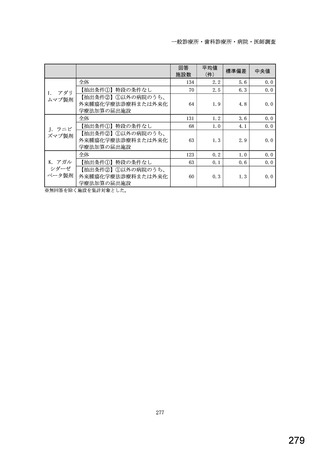
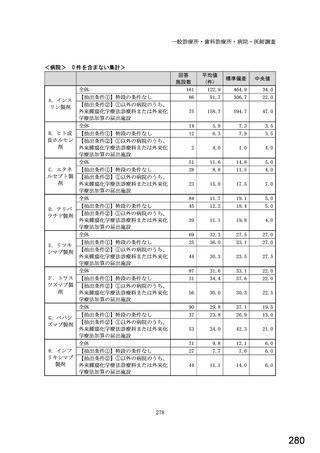
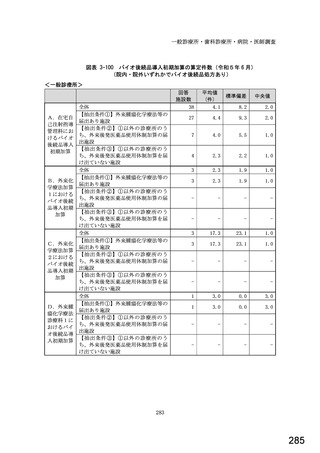
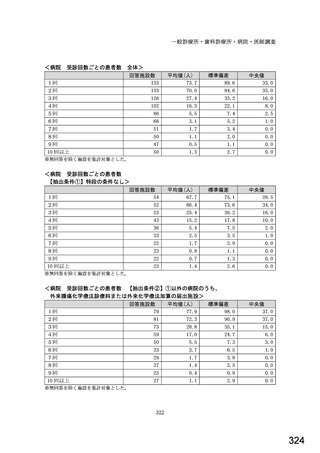
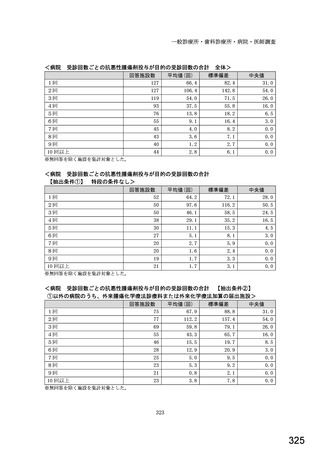
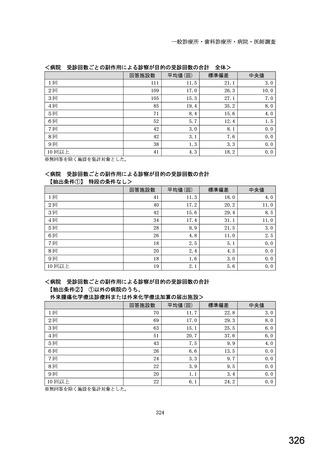
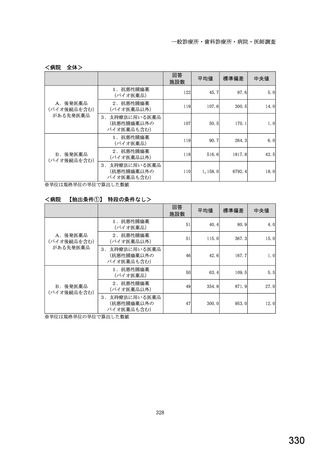
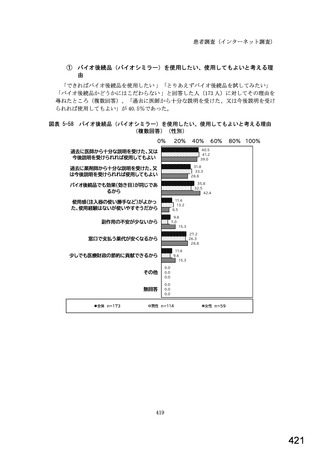
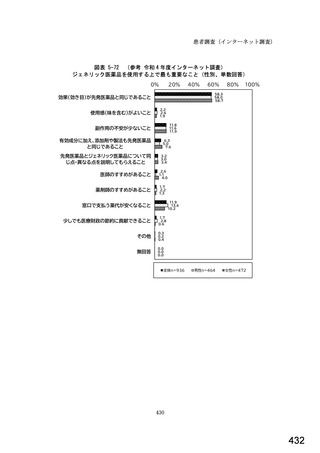
図表 3-86 (参考 令和 4 年度調査)病院におけるバイオ後続品の採用に関する考え方
0%
病院全体n=204
20%
11.3
40%
23.0
60%
7.4
18.6
80%
13.2
100%
6.4
11.8
2.0
6.4
内科標榜病院n=188
11.7
腎臓内科n=66
12.1
24.5
7.4
19.1
13.8
3.7
1.6
11.2
6.9
6.1
19.7
6.1
28.8
1.5
21.2
0.0
血液内科n=48
リウマチ内科n=39
4.2
10.4
14.6
2.1
39.6
2.1
22.9
0.0
7.7
20.5
7.7
30.8
20.5
4.2
2.6
2.6
7.7
0.0
糖尿病内科n=73
15.1
消化器内科n=121
14.0
15.1
6.8
27.4
17.8
1.4
11.0
0.0
19.8
7.4
24.0
18.2
5.5
0.8
8.3
6.6
0.8
9.1
呼吸器内科n=88
4.5
8.0
20.5
6.8
27.3
20.5
1.1
0.0
10.9
循環器内科n=129
12.4
内科の詳細に該当なしn=38
10.5
20.9
7.8
24.8
16.3
0.0
36.8
7.9
5.3 5.3
13.2
10.5
6.8
0.8
6.2
2.6
7.9
バイオ後続品が発売されているものは、積極的に採用する
品質や有効性、安全性に疑問がないバイオ後続品は積極的に採用する
安定供給に疑問がないバイオ後続品は積極的に採用する
品目によってはバイオ後続品を積極的に採用する
先行バイオ医薬品とバイオ後続品の適応症が同じ場合は積極的に採用する
バイオ後続品を積極的には採用していない
バイオ医薬品(先行バイオ医薬品、バイオ後続品)の対象となる患者がいない
その他
無回答
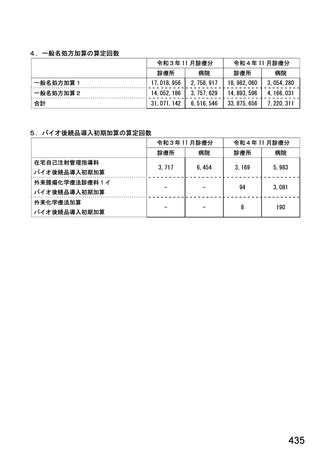
246
248