○診療報酬改定結果検証部会からの報告について 総-1-5-2 (66 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00222.html |
| 出典情報 | 中央社会保険医療協議会 総会(第563回 11/10)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
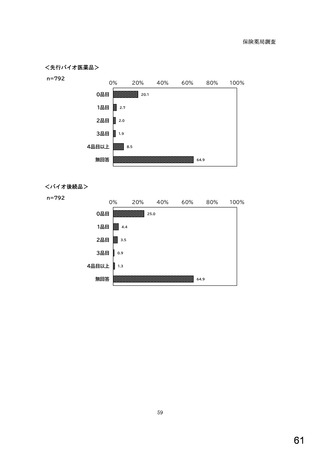
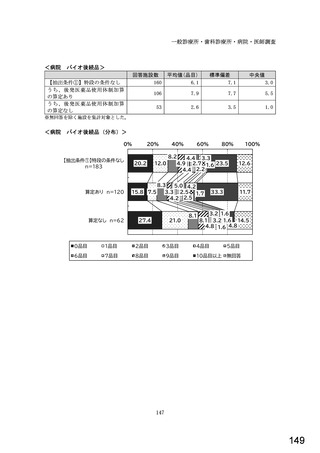
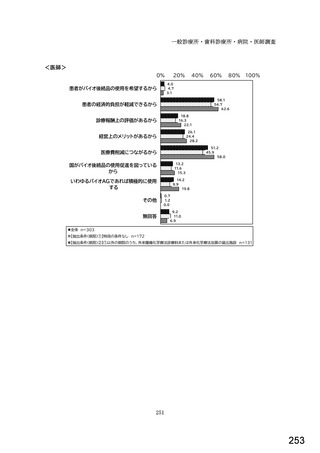
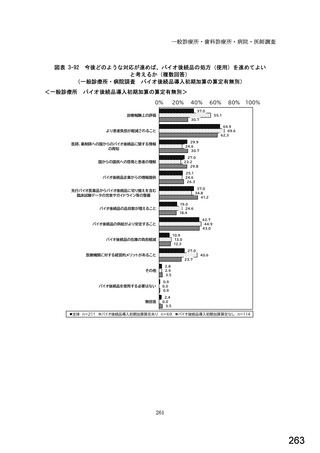
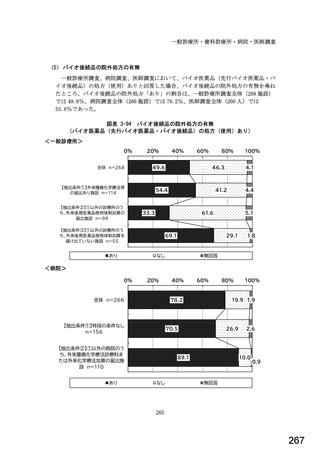
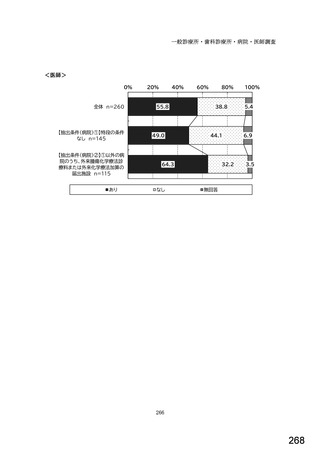
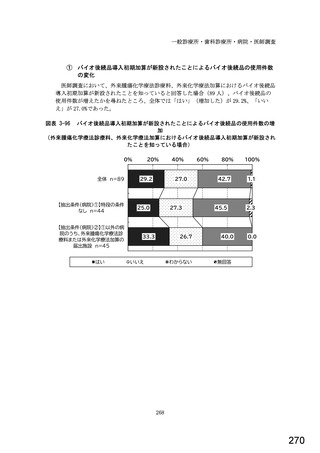
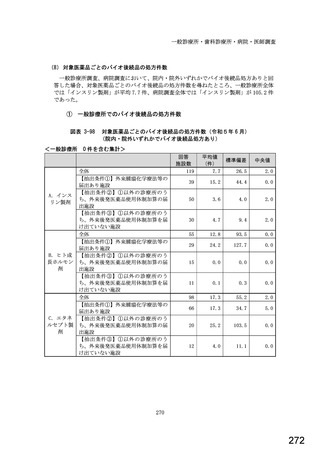
7) バイオ後続品への対応状況
バイオ後続品とは、国内で既に新有効成分含有医薬品として承認されたバイオテクノ
ロジー応用医薬品(以下「先行バイオ医薬品」という。)と同等/同質の品質、安全
性、有効性を有する医薬品として、異なる製造販売業者により開発される医薬品。
本調査における「バイオ後続品」には、後発医薬品として承認されたバイオ医薬品
(いわゆるバイオ AG、先行品工場で製造された先行品と同一のバイオ医薬品)を含
む。
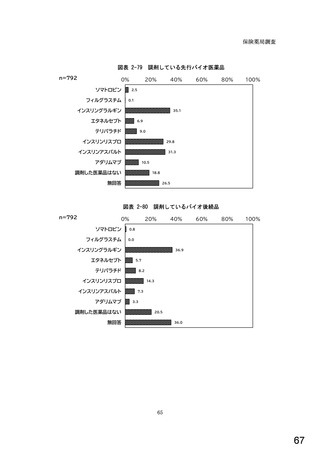
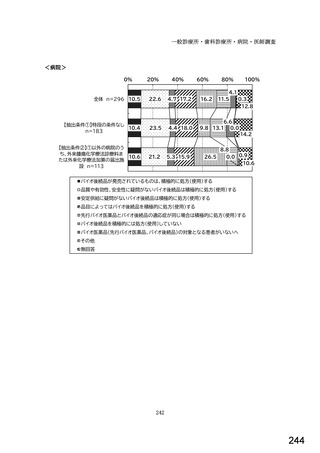
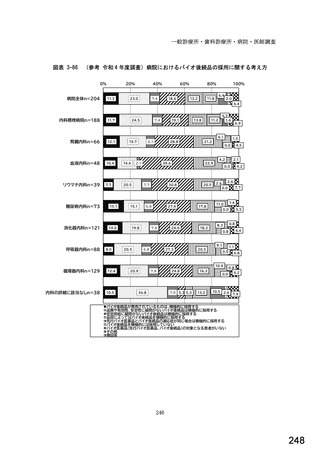
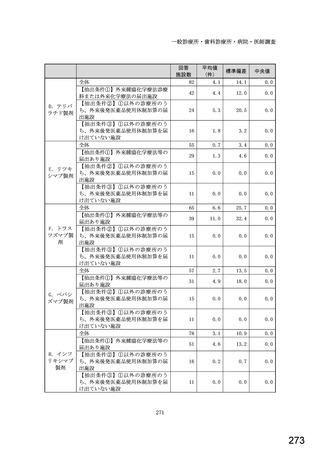
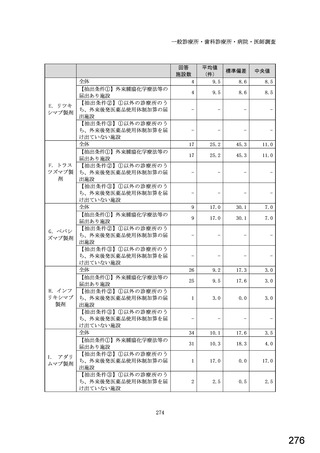
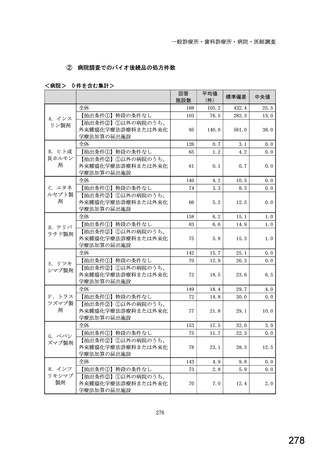
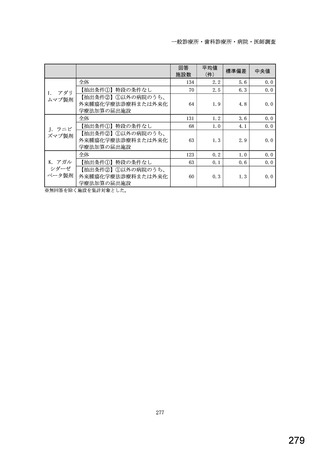
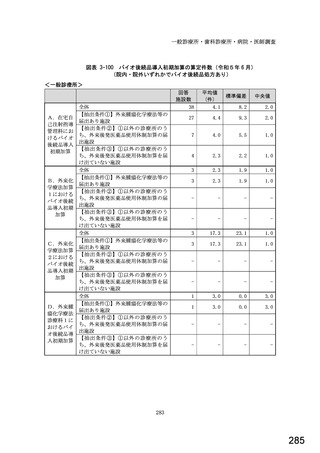
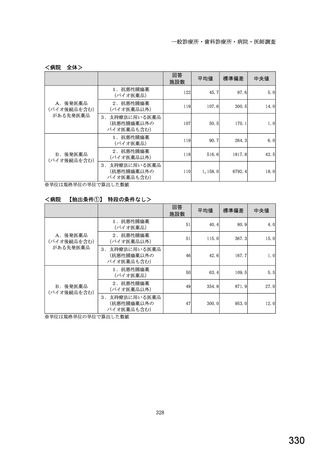
図表 2-76 国内でバイオ後続品が承認されている先行バイオ医薬品のうち
在宅自己注射可能なもの
先行バイオ医薬品の一般的名称
先行バイオ医薬品
ソマトロピン
フィルグラスチム
インスリン グラルギン
エタネルセプト
テリパラチド
インスリン リスプロ
インスリン アスパルト
アダリムマブ
販売名
ジェノトロピン
グラン
ランタス
エンブレル
フォルテオ
ヒューマログ
ノボラピッド
ヒュミラ
63
65