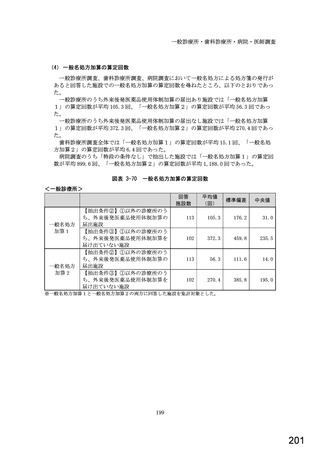
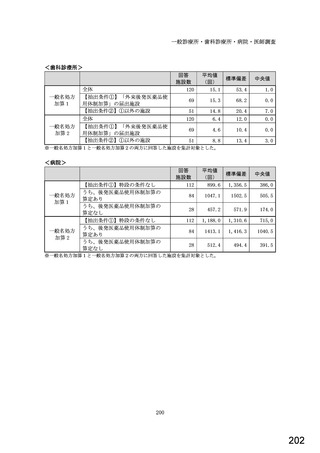
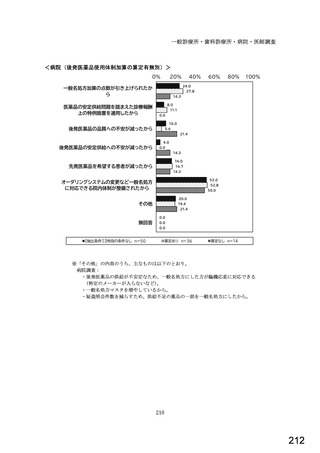
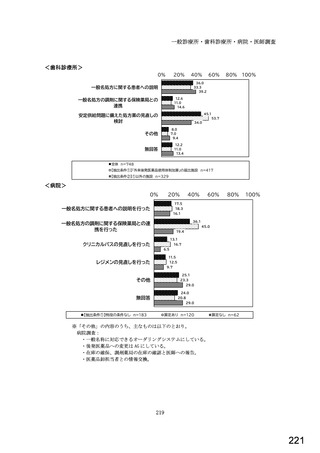
○診療報酬改定結果検証部会からの報告について 総-1-5-2 (442 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00222.html |
| 出典情報 | 中央社会保険医療協議会 総会(第563回 11/10)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
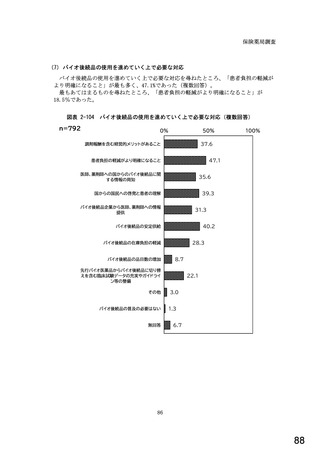
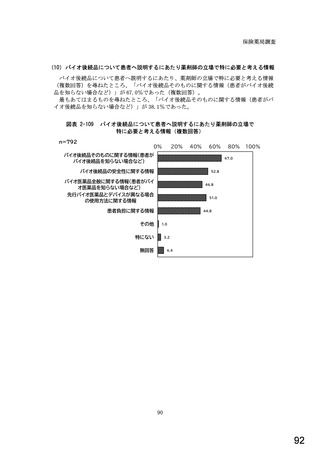
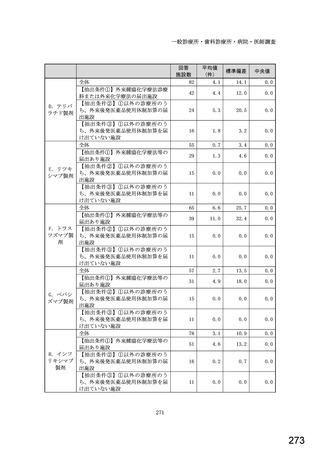
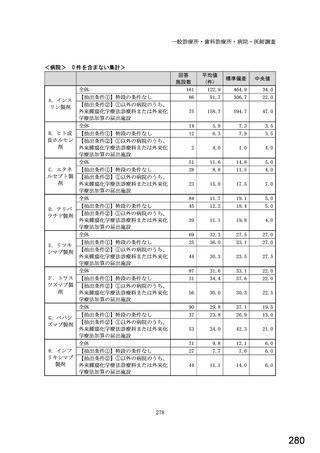
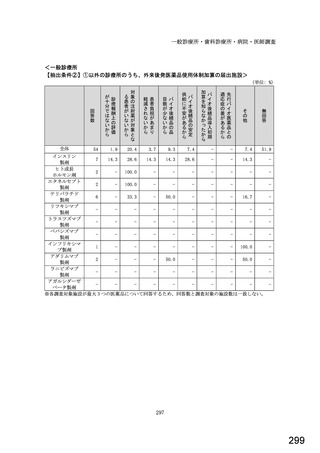
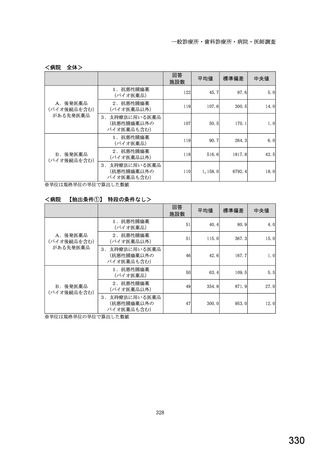
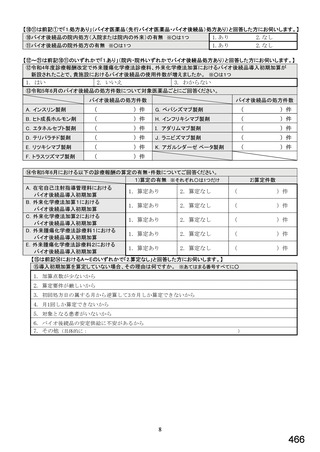
6.貴薬局におけるバイオ後続品への対応状況についてお伺いします。
注:バイオ後続品とは、国内で既に新有効成分含有医薬品として承認されたバイオテクノロジー応用医薬品(以下「先行バイ
オ医薬品」という。)と同等/同質の品質、安全性、有効性を有する医薬品として、異なる製造販売業者により開発され
る医薬品です。
本調査における「バイオ後続品」には、後発医薬品として承認されたバイオ医薬品(いわゆるバイオAG、先行品工場で製
造された先行品と同一のバイオ医薬品)を含みます。
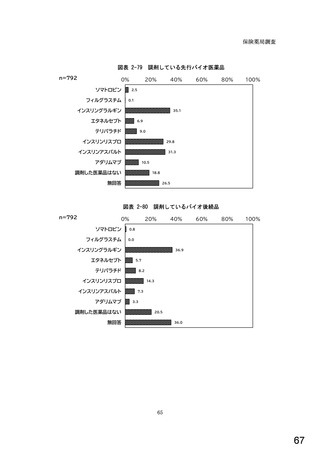
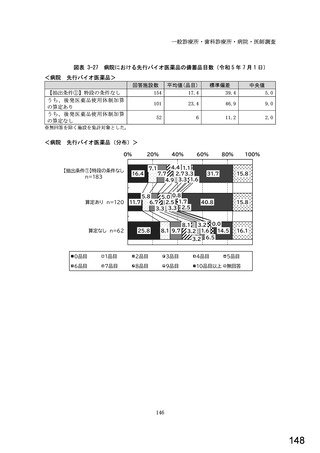
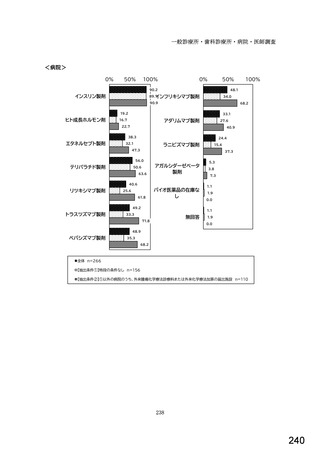
表1 国内でバイオ後続品が承認されている先行バイオ医薬品のうち在宅自己注射可能なもの
先行バイオ医薬品の一般的名称
先行バイオ医薬品 販売名
ソマトロピン
ジェノトロピン
フィルグラスチム
グラン
インスリン グラルギン
ランタス
エタネルセプト
エンブレル
テリパラチド
フォルテオ
インスリン リスプロ
ヒューマログ
インスリン アスパルト
ノボラピッド
アダリムマブ
ヒュミラ
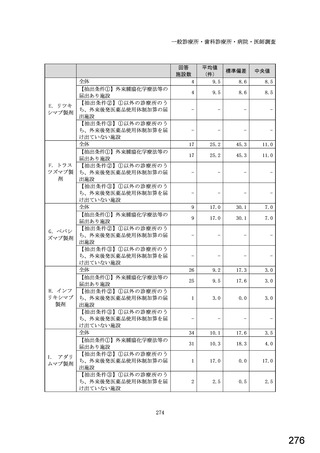
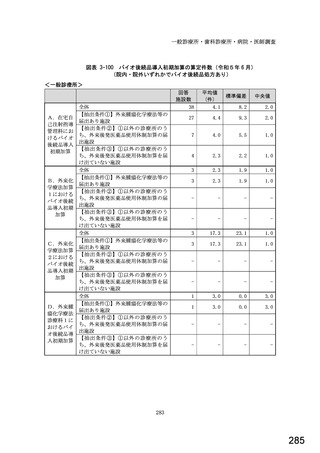
①バイオ医薬品(表1に示す先行バイオ医薬品・及びそのバイオ後続品)のうち、貴薬局が備蓄している医薬品、及び令
和5年6月1か月間で調剤した医薬品は何ですか。※あてはまる項目すべてに○
備蓄している医薬品
調剤した医薬品(令和5年6月1か月間)
先行バイオ医薬品
バイオ後続品
先行バイオ医薬品
バイオ後続品
1) ソマトロピン
1
1
1
1
2) フィルグラスチム
2
2
2
2
3) インスリン グラルギン
3
3
3
3
4) エタネルセプト
4
4
4
4
5) テリパラチド
5
5
5
5
6) インスリン リスプロ
6
6
6
6
7) インスリン アスパルト
7
7
7
7
8) アダリムマブ
8
8
8
8
9) 備蓄及び調剤した
9
9
9
9
医薬品はない
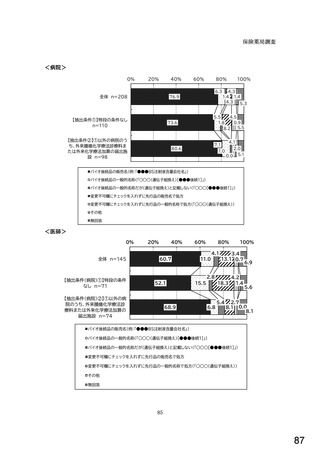
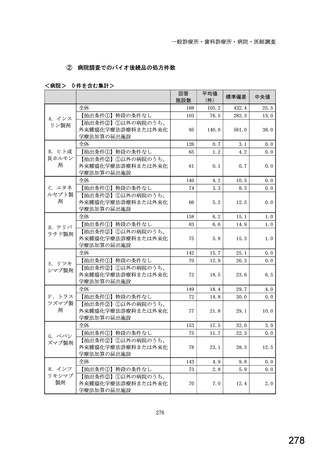
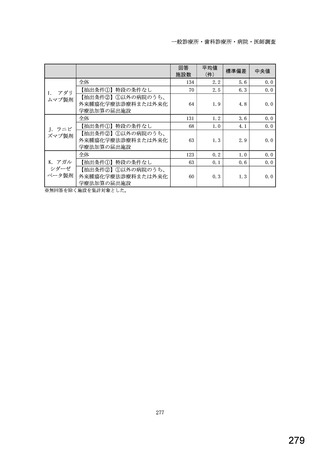
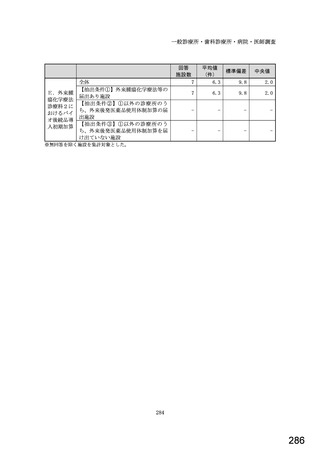
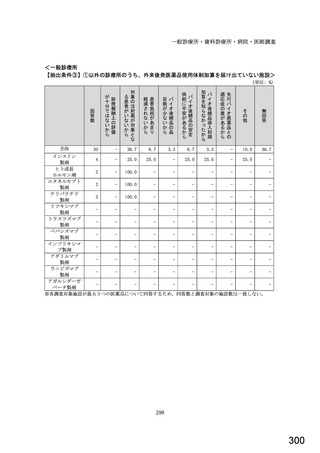
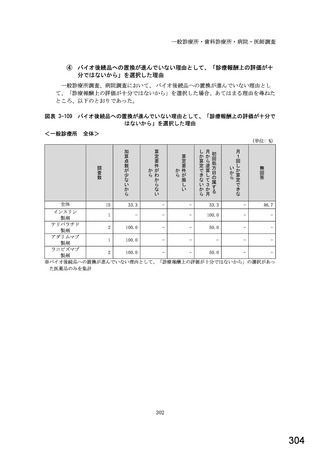
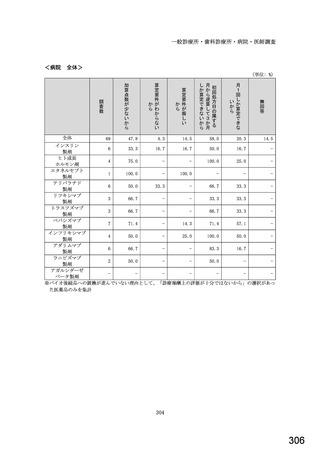
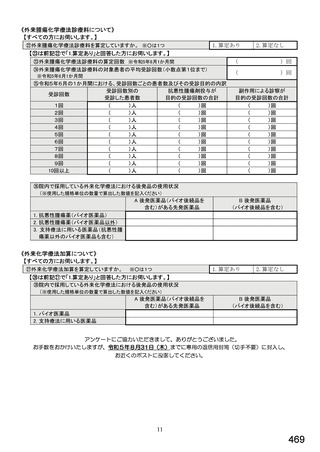
令和5年6月1日(木)~6月30日(金)の1か月間に受け付けた処方箋に関して、表1に示すバイオ後続品に係る状況につ
いてお尋ねします。 ※1枚の処方箋に下記③~⑥が重複して含まれている場合、各々1枚とカウントしてください。
②表1に示すバイオ後続品を調剤した処方箋枚数
③前記②のうち、表1に示すバイオ医薬品の「先行バイオ医薬品 販売名」で処方さ
れ、「変更不可」となっていない注1医薬品が1品目でもある処方箋の枚数
④前記②のうち、バイオ後続品の販売名注2で処方されている医薬品が1品目でもあ
る処方箋の枚数
⑤前記②のうち、バイオ後続品の一般的名称注3で処方されている医薬品が1品目で
もある処方箋の枚数
⑥前記②のうち、バイオ医薬品の一般的名称に「(遺伝子組換え)」が記載されてい
ない医薬品名注4の処方箋が1品目でもある処方箋の枚数
(
)枚
(
)枚
(
)枚
(
)枚
(
)枚
注1: 処方医が「個々の処方薬について、 後発医薬品(ジェネリック医薬品)への変更に差し支えがあると判断した場合には、「変更不可」欄に「レ」又は
「×」を記載し、「保険医署名」欄に署名又は記名・押印すること」となっている。
注2:バイオ後続品の販売名とは、「●●● BS注射液 含量 会社名」と記載されたものをいう。
注3:バイオ後続品の一般的名称とは、「○○○(遺伝子組換え)[●●●後続1]」と記載されたものをいう。
注4:バイオ医薬品の一般的名称で「(遺伝子組換え)」が記載されていない医薬品名とは、「○○○(遺伝子組換え)」の〇〇〇部分のみが記載されたもの
をいう。
6
441