会議資料 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
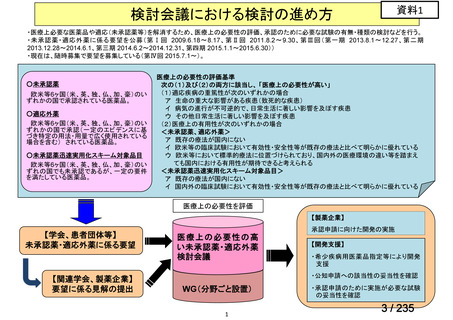
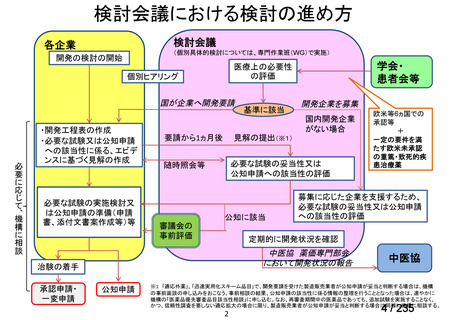
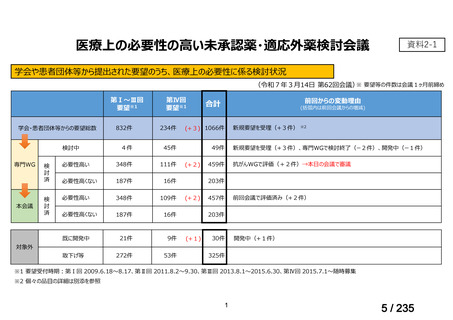
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
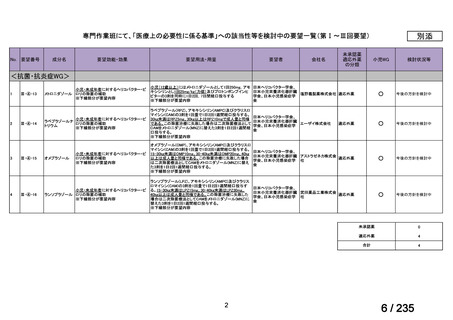
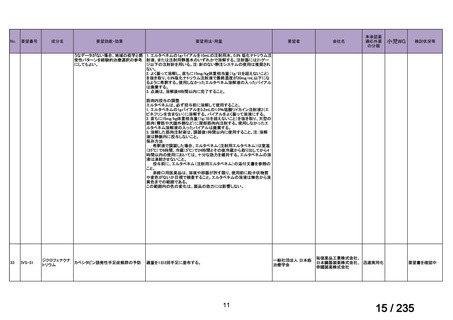
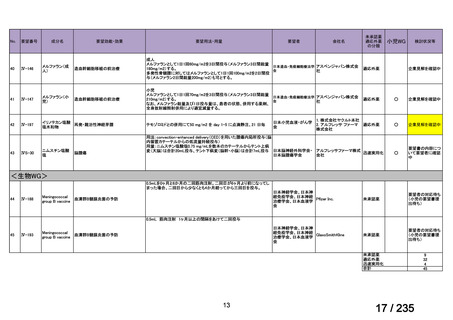
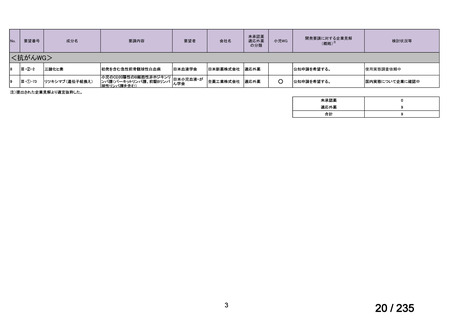
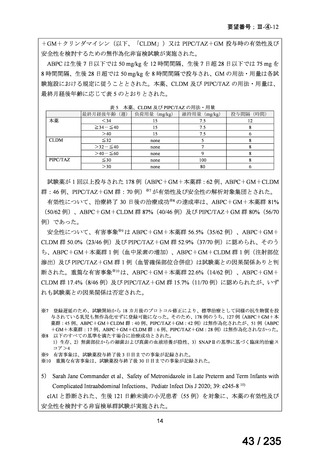
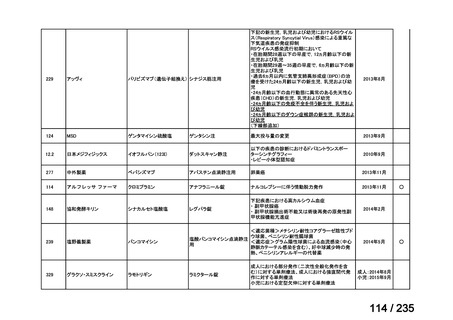
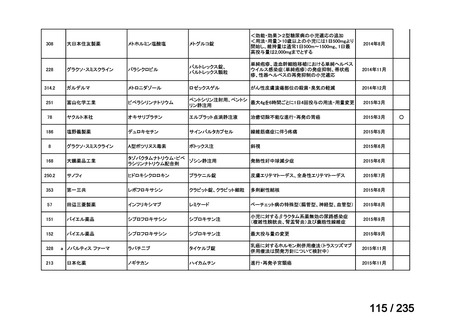
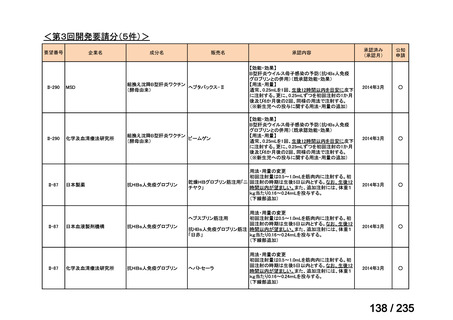
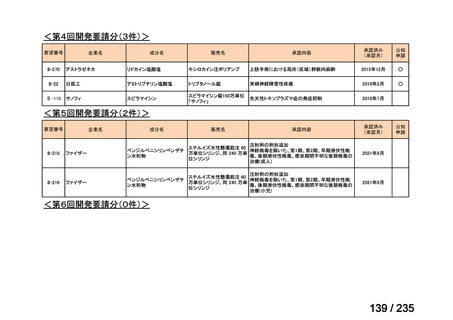
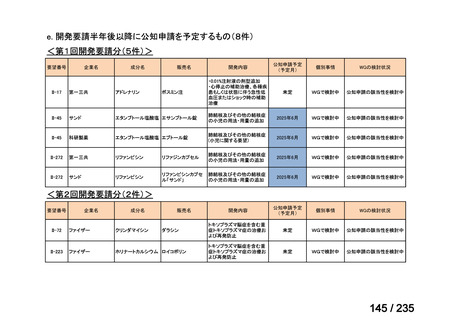
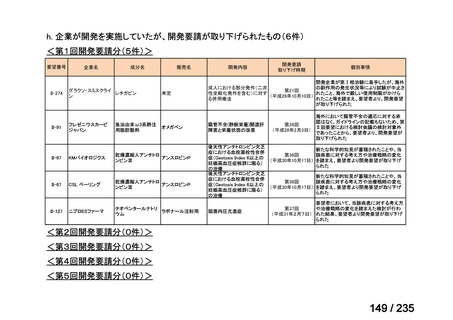
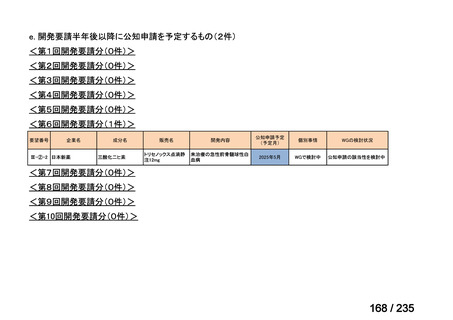
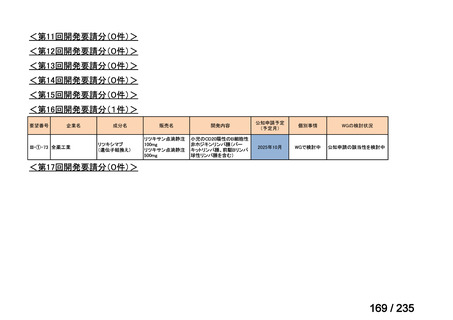
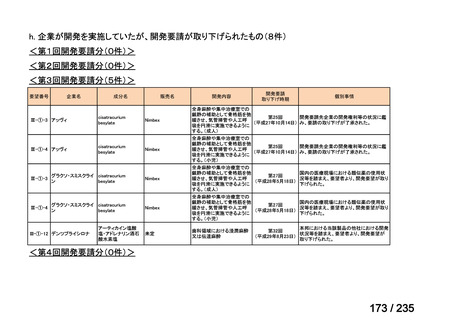
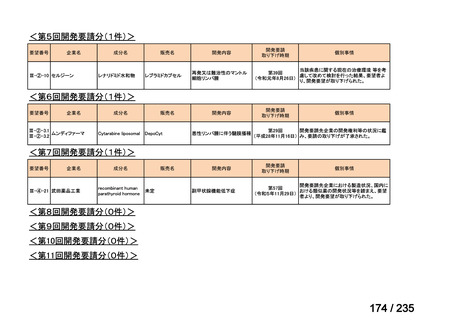
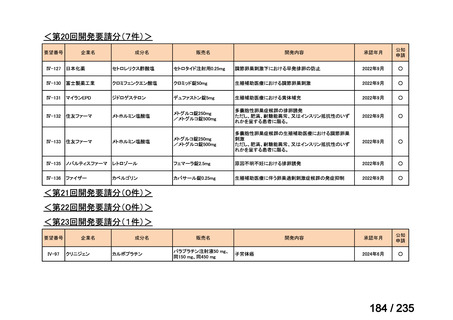
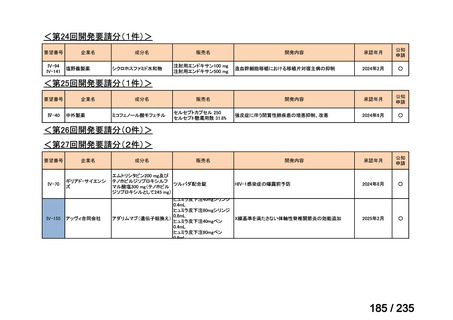
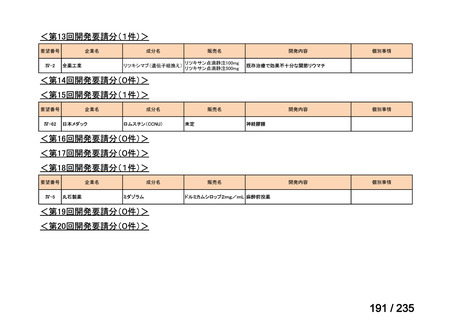
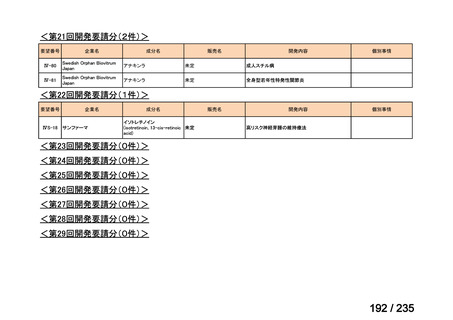
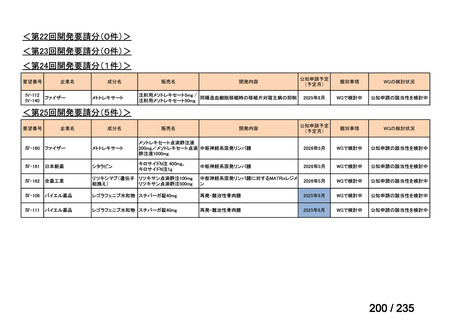
要望番号
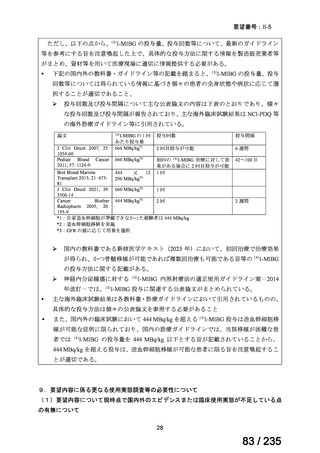
成分名
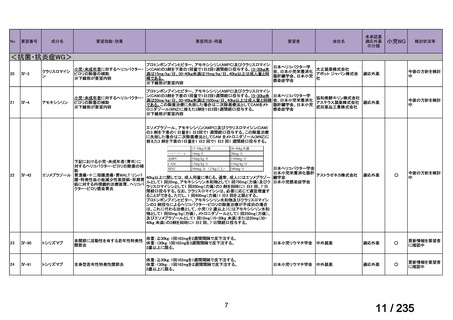
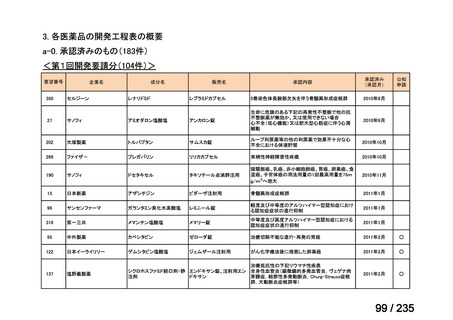
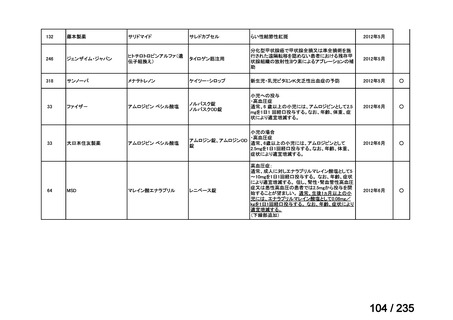
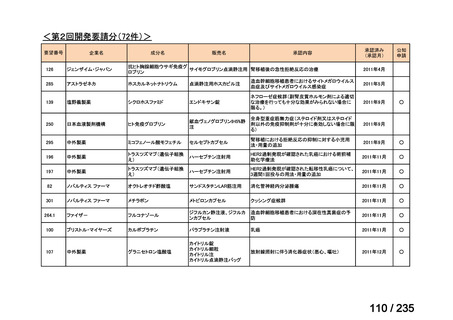
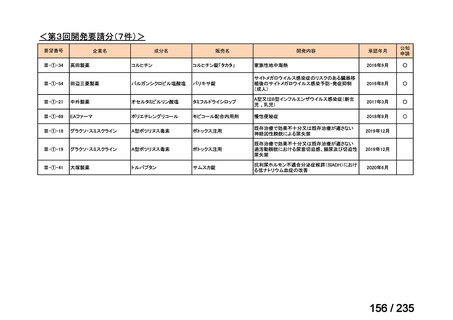
Ⅳ-146
メルファラン(成
人)
41
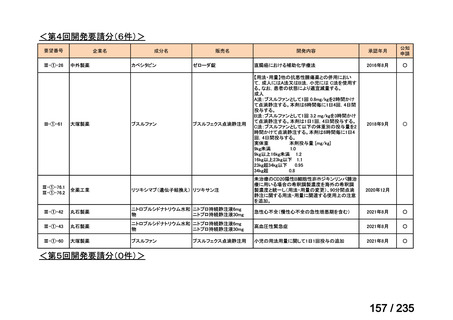
Ⅳ-147
メルファラン(小
児)
42
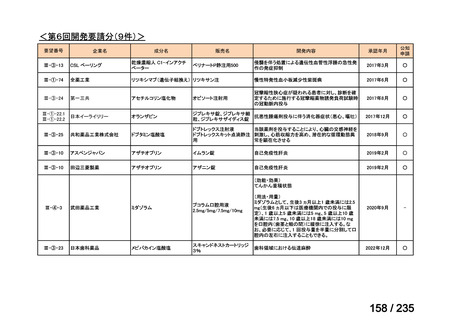
Ⅳ-197
イリノテカン塩酸
再発・難治性神経芽腫
塩水和物
40
43
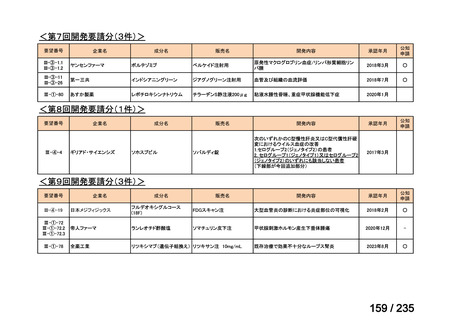
ⅣS-30
ニムスチン塩酸
塩
要望効能・効果
要望用法・用量
要望者
会社名
未承認薬
適応外薬
の分類
小児WG
検討状況等
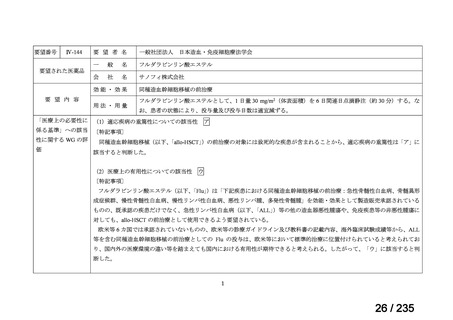
造血幹細胞移植の前治療
成人
メルファランとして1日1回60mg/m2を3日間投与(メルファラン3日間総量
日本造血・免疫細胞療法学 アスペンジャパン株式会
180mg/m2)する。
会
社
多発性骨髄腫に対してはメルファランとして1日1回100mg/m2を2日間投
与(メルファラン2日間総量200mg/m2)も可とする。
適応外薬
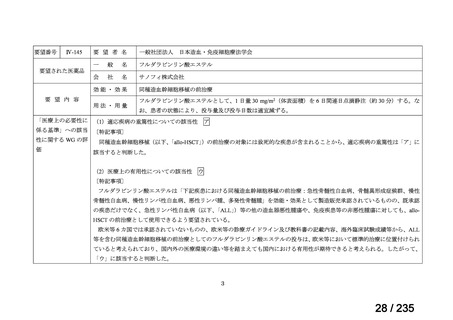
造血幹細胞移植の前治療
小児
メルファランとして1日1回70mg/m2を3日間投与(メルファラン3日間総量
日本造血・免疫細胞療法学 アスペンジャパン株式会
210mg/m2)する。
会
社
なお、メルファラン総量及び1日投与量は、患者の状態、併用する薬剤、
全身放射線照射併用により適宜減量する。
適応外薬
○
企業見解を確認中
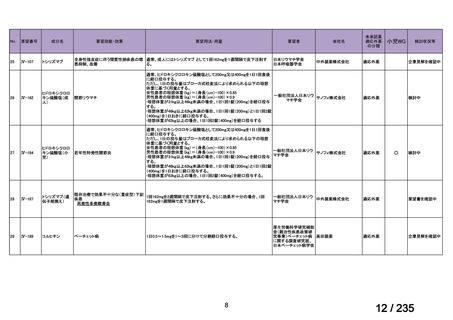
1. 株式会社ヤクルト本社
日本小児血液・がん学
2. アルフレッサ ファーマ 適応外薬
会
株式会社
○
企業見解を確認中
○
要望書の内容につ
いて要望者に確認
中
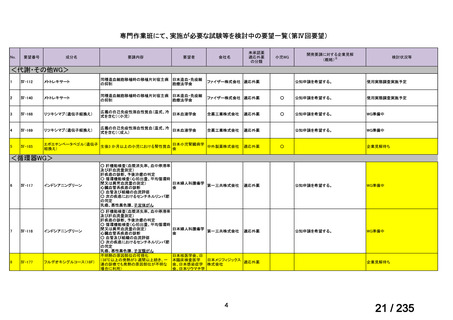
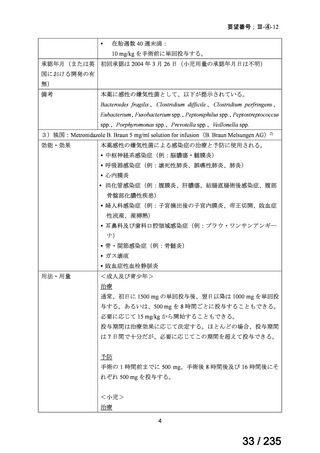
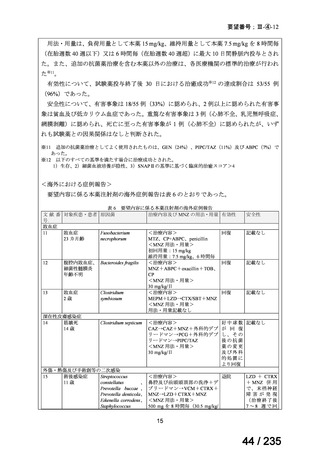
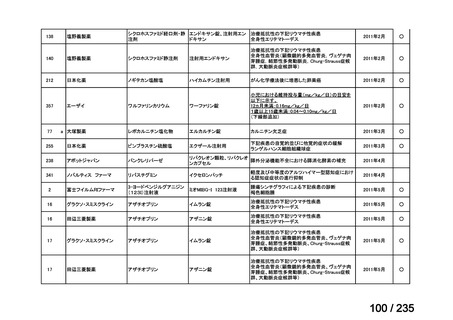
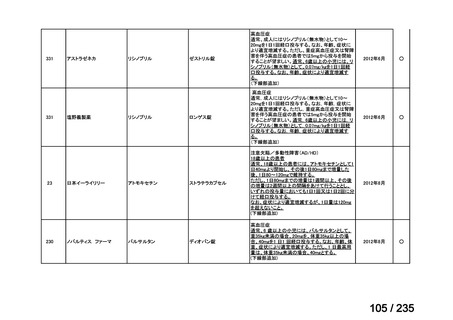
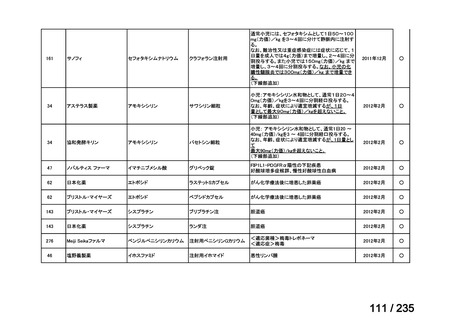
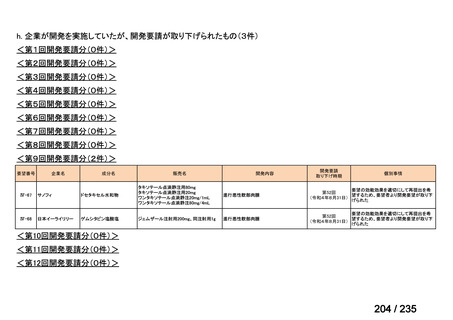
脳腫瘍
テモゾロミドとの併用にて50 mg/m2 を day 1-5 に点滴静注、21 日毎
用法:convection-enhanced delivery(CED)を用いた腫瘍内局所投与(脳
内留置カテーテルからの低流量持続投与)
用量:ニムスチン塩酸塩0.75 mg/mLを数本のカテーテルからテント上病
変(大脳)は合計20mL投与、テント下病変(脳幹・小脳)は合計7mL投与 日本脳神経外科学会・ アルフレッサファーマ株式
迅速実用化
日本脳腫瘍学会
会社
企業見解を確認中
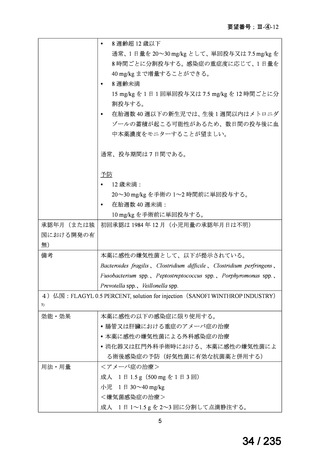
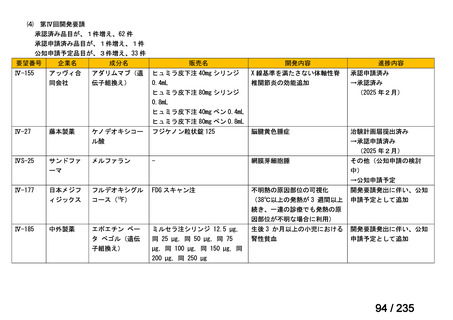
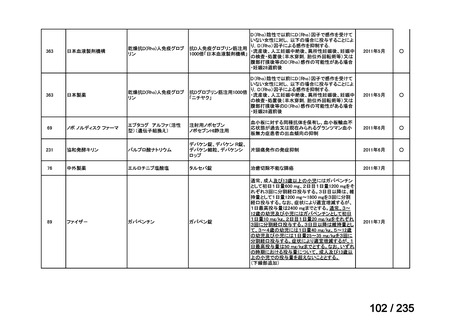
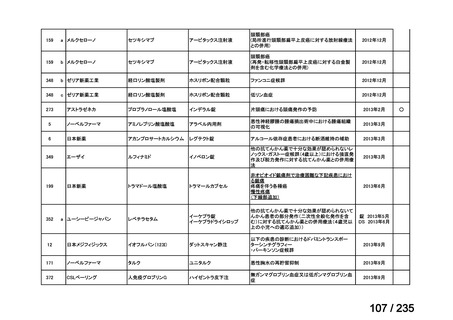
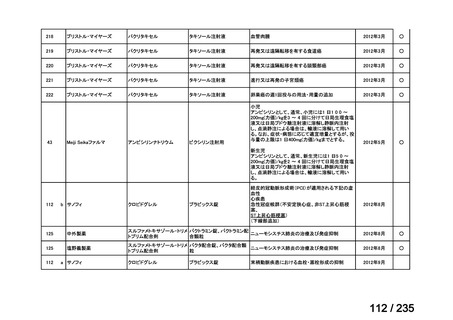
<生物WG>
0.5mLを0ヶ月と6か月の二回筋肉注射。二回目が6ヶ月より前になってし
まった場合、二回目から少なくとも4か月経ってから三回目を投与。
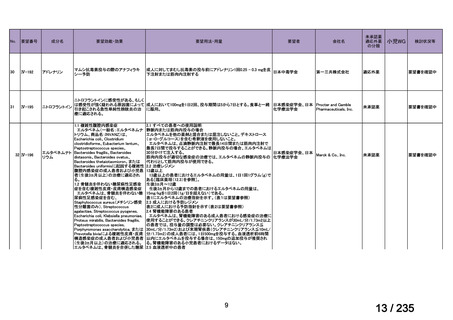
44
Ⅳ-188
Meningococcal
血清群B髄膜炎菌の予防
group B vaccine
日本神経学会、日本神
経免疫学会、日本神経
Pfizer Inc.
治療学会、日本血液学
会
未承認薬
要望者の対応待ち
(小児の要望書提
出待ち)
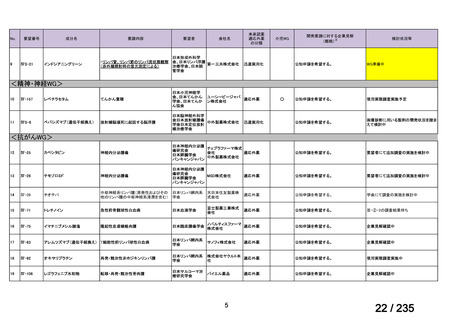
日本神経学会、日本神
経免疫学会、日本神経
GlaxoSmithKline
治療学会、日本血液学
会
未承認薬
要望者の対応待ち
(小児の要望書提
出待ち)
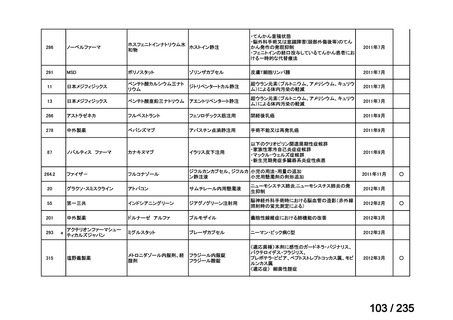
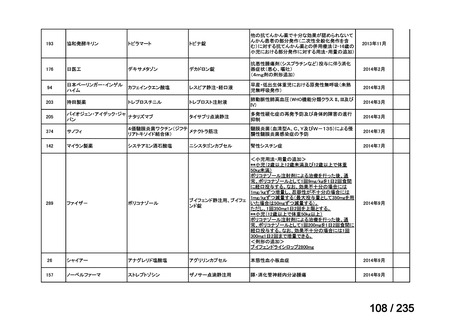
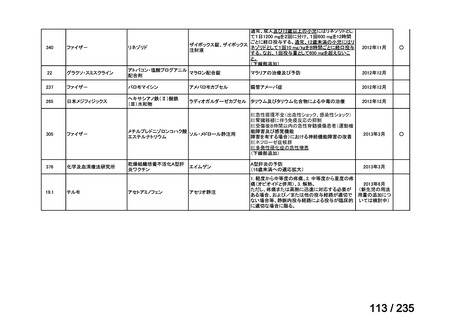
未承認薬
適応外薬
迅速実用化
合計
9
32
4
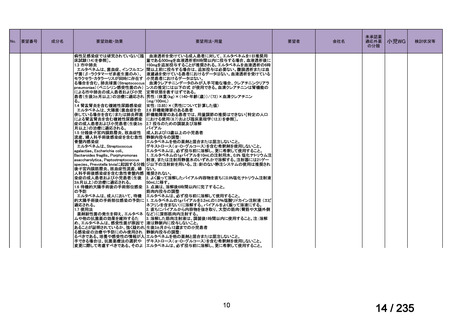
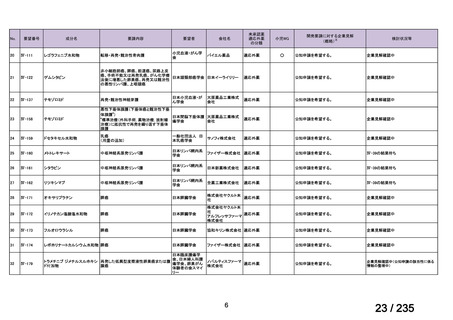
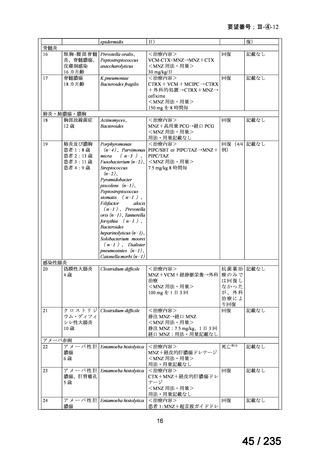
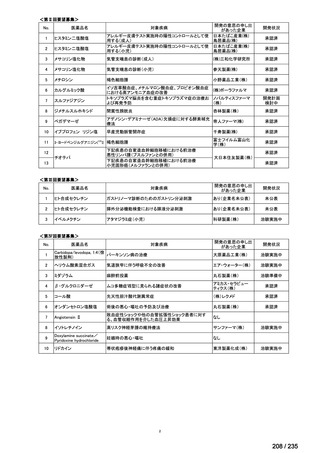
45
0.5mL 筋肉注射 1ヶ月以上の間隔をあけて二回投与
45
Ⅳ-193
Meningococcal
血清群B髄膜炎菌の予防
group B vaccine
13
17 / 235