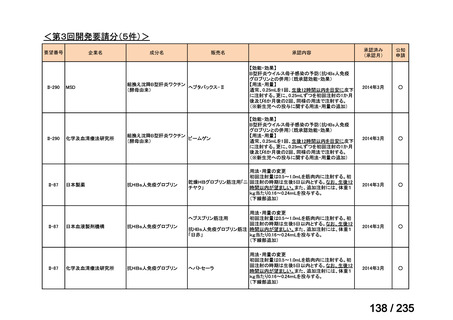
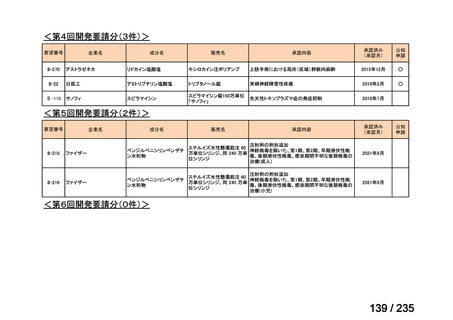
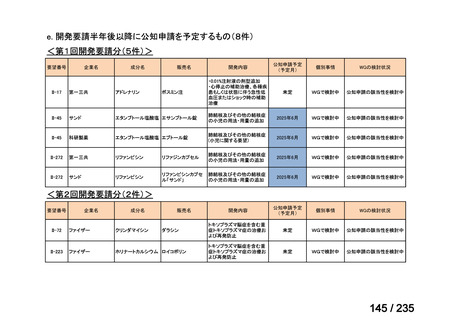
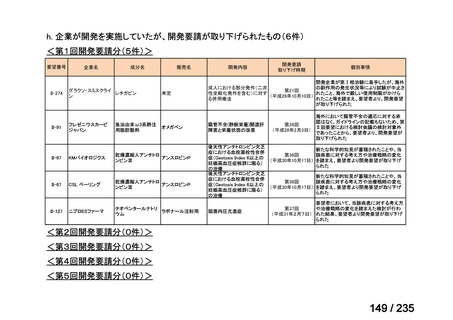
会議資料 (62 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
19)
ガイドライン名②
EANM procedure guidelines for 131I-meta-iodobenzylguanidine (131ImIBG) therapy (Eur J Nucl Med Mol Imaging 2008; 35: 1039-47) 20)
効能・効果
MIBG 集積陽性の病期Ⅲ又は病期Ⅳの神経芽腫
(または効能・効果に関
連のある記載箇所)
用法・用量
通常、1 回あたり 3.7~11.2 GBq を投与する。投与量は腫瘍サイズ
(または用法・用量に関
などの医学的理由や法規制に従い変更する。間隔を開けて投与を
連のある記載箇所)
繰り返すことが多い。
強力な化学療法後の神経芽腫患者では,全身被ばく線量を評価
し、1 投与あたり 2 Gy を耐容線量として大量投与を行うことがあ
る。幹細胞移植等の併用が可能な状況においては、4 Gy を耐容線
量として累積投与量を増大させることがある。
ガイドラインの根拠論文における投与量をそれぞれ【】内に示す。
ガイドライン②の根
Lashford
LS,
et
al.
Phase
I/II
study
of
iodine-131
拠論文
metaiodobenzylguanidine in chemoresistant neuroblastoma: a United
Kingdom Children’s Cancer Study Group investigation. J Clin Oncol
1992; 10: 1889-96 21)
【全身の吸収線量が 1.0~2.5 Gy の範囲内で投与量を調整。実投与
量は 2.4~12.1 GBq】
Matthay KK, et al. Correlation of tumour and whole-body dosimetry with
tumour response and toxicity in refractory neuroblastoma treated with
131
I-MIBG. J Nucl Med 2001; 42: 1713-21 22)
【111、222、333、444、555 又は 666 MBq/kg を投与。444 MBq/kg
以上では自家幹細胞移植を併用。
】
Gaze MN, et al. Feasibility of dosimetry-based high-dose I-131-metaiodobenzylguanidine with topotecan as a radiosensitizer in children with
metastatic neuroblastoma. Cancer Biother Radiopharm 2005; 20: 195-9 19)
【英国ガイドライン①の用法・用量参照】
備考
3)独国
ガイドライン名①
EANM procedure guidelines for 131I-meta-iodobenzylguanidine (131ImIBG) therapy (Eur J Nucl Med Mol Imaging 2008; 35: 1039-47) 20)
効能・効果
英国ガイドライン②と同じ
(または効能・効果に関
連のある記載箇所)
7
62 / 235