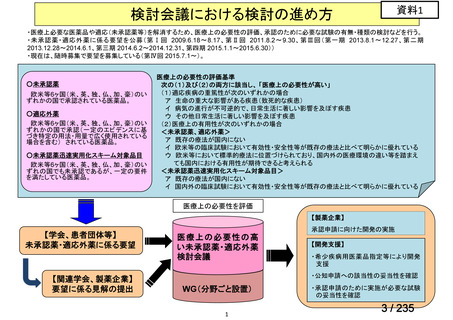
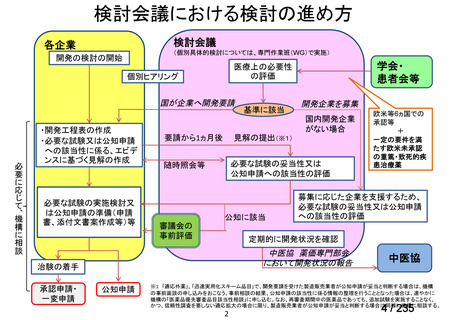
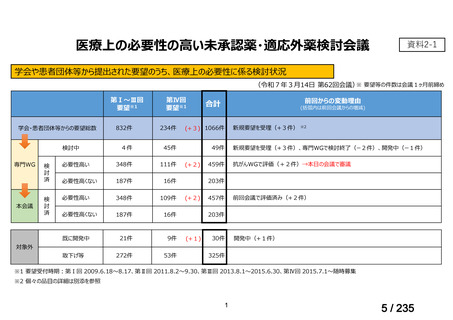
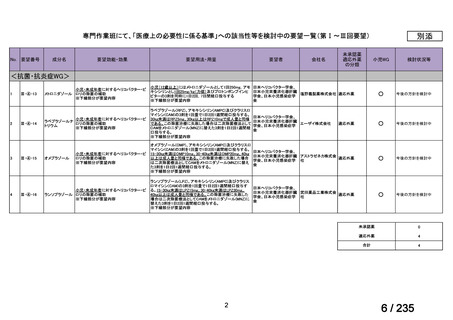
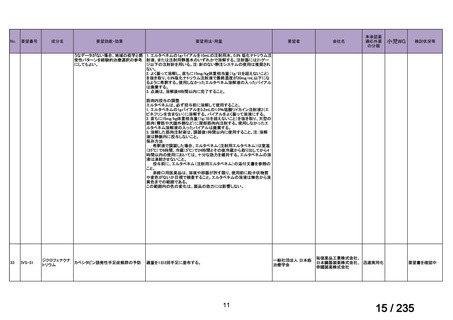
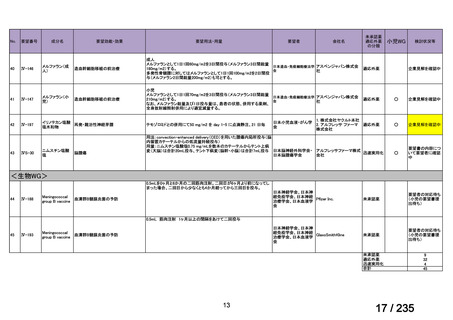
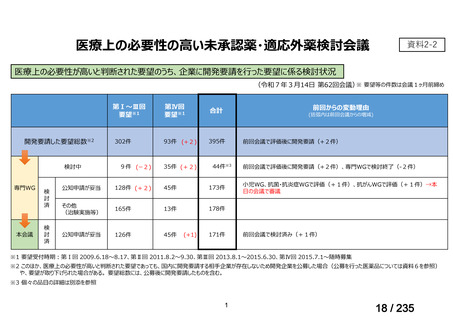
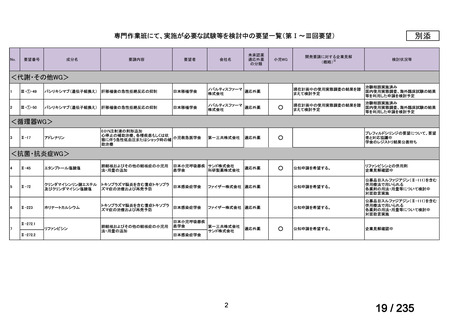
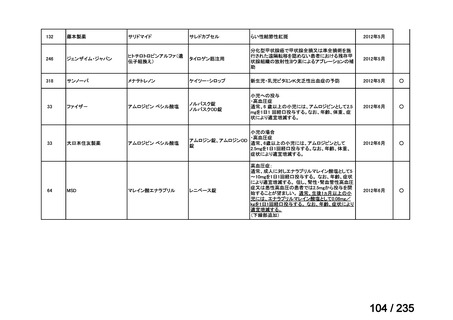
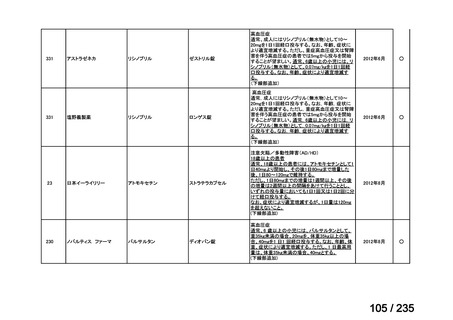
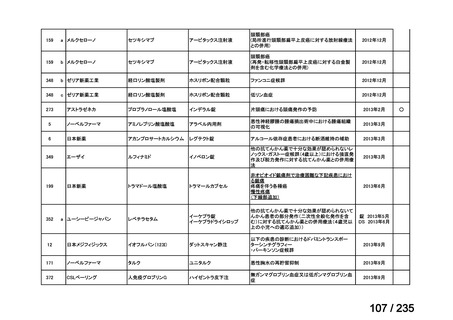
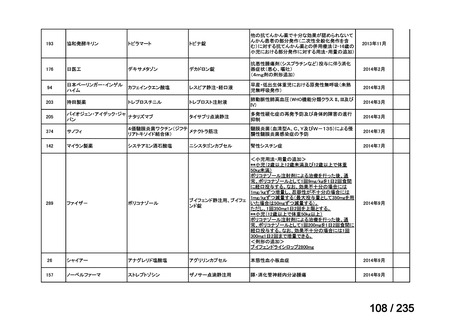
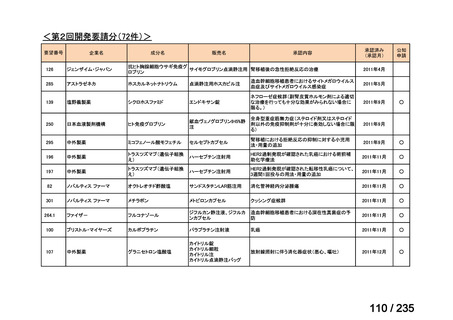
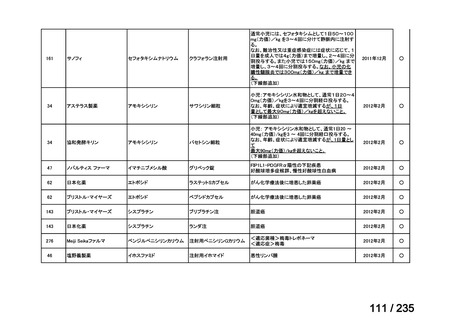
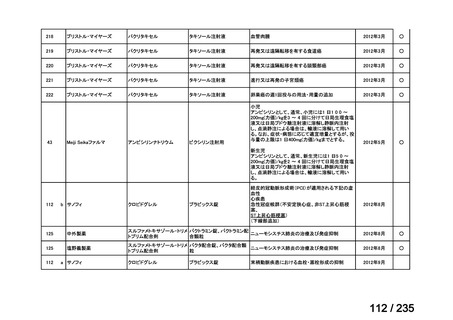
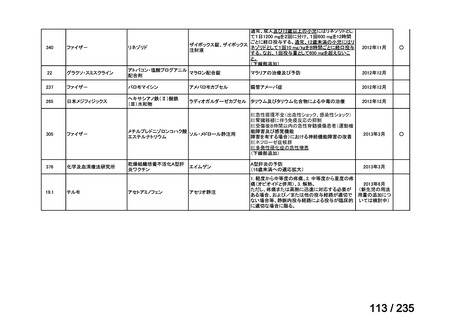
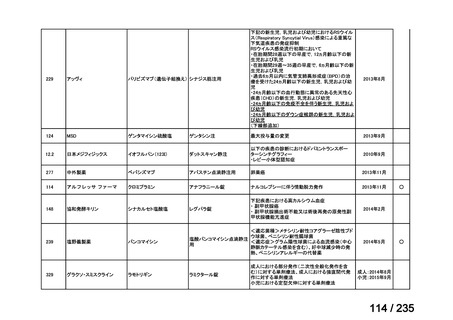
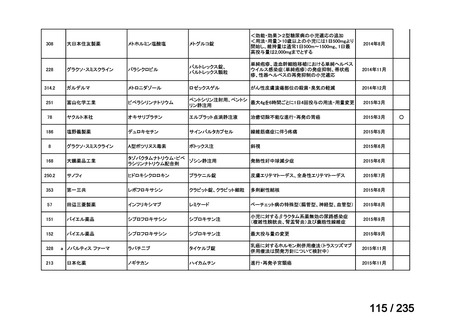
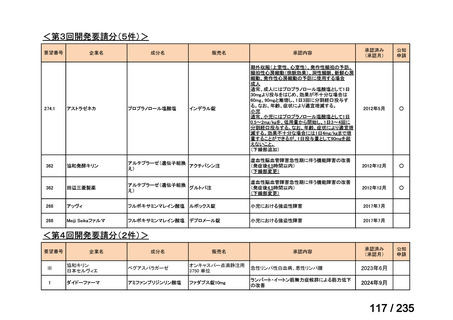
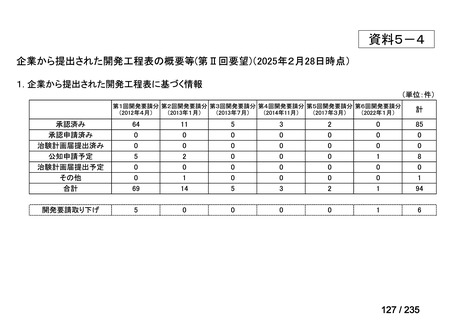
会議資料 (49 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
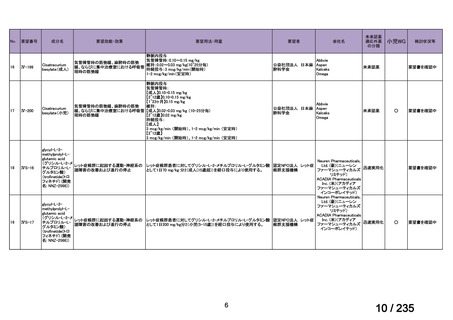
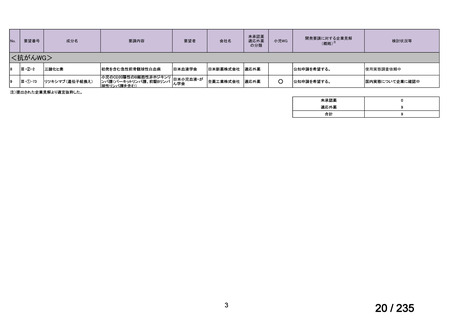
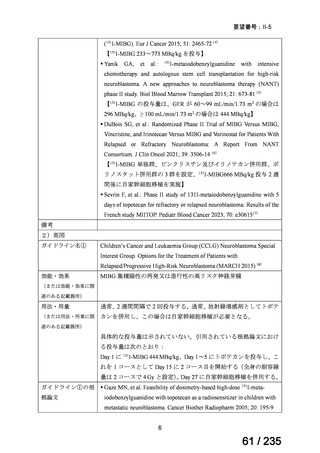
10 mg/kg、6 時間ごと
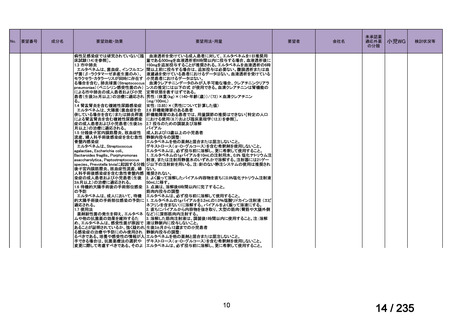
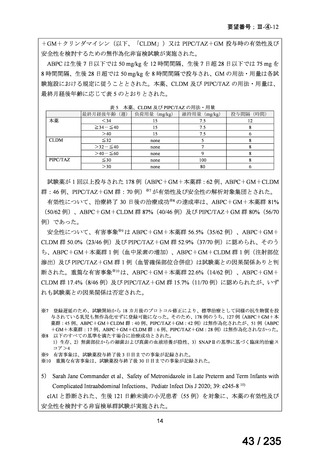
感染性腸炎
39
ク ロ ス ト リ デ Clostridioides
<治療内容>
4 例で改善 1 例にタクロ
ィオイデス・デ ( Clostridium ) MNZ ( CPR 、 DRPM + MINO 、
リムスの血中
ィ フ ィ シ ル 関 difficile
TAZ/PIPC、
MEPM+MINO がそれ
濃度の急激な
連下痢症患者
ぞれ 1 例ずつ併用)
上昇が認めら
(造血幹細胞
<MNZ 用法・用量>
れた。
移植を含む抗
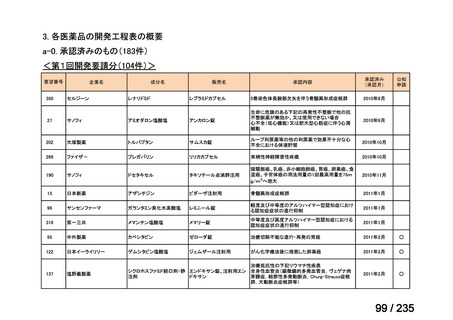
10 mg/kg を 1 日 3 回、8 時間毎、
がん剤治療を
1 回 20 分かけて点滴投与
受けた)4 例[年
齢中央値:8 歳
5 か月
(2 歳 5 カ
月 -10 歳 7 カ
月)
]
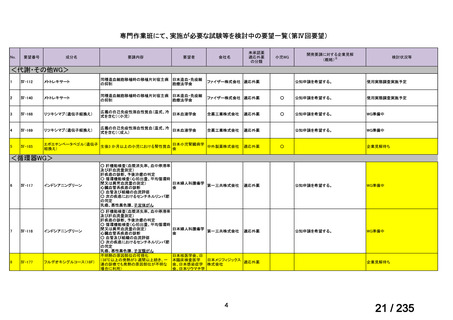
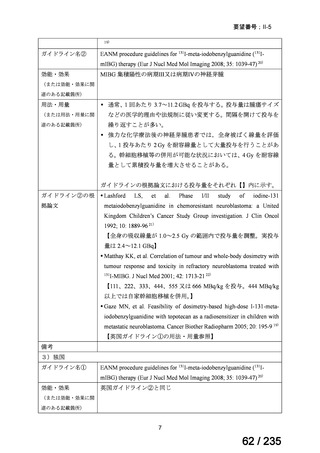
40
Clostridium
Clostridium difficile
<治療内容>
転 帰 : 改 記載なし
difficile 感染症
CDTR→MNZ(用量記載なし)+ 善、退院
7 歳女児
VCM(注腸)→VCM(経口)
CDTR:セフジトレン、CPR:セフピロム、DRPM:ドリペネム、MINO:ミノサイクリン
※15 MNZ 投与終了時点で感染症に伴う臨床症状および炎症反応が消失し、その他の抗嫌気性菌活性を有す
る抗嫌気性菌治療を必要としなかったものを「有効」と判定。
7.公知申請の妥当性について
(1)要望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価につ
いて
小児患者を対象とした本薬注射剤の海外臨床試験及び海外症例報告から、嫌気性菌感染
症、クロストリジウム・ディフィシルによる感染性腸炎及びアメーバ赤痢の小児患者にお
ける本薬注射剤の有効性は示唆されている(5.
(1)参照)
。
本薬注射剤は、英国、独国、仏国及び豪州において小児の嫌気性菌感染症、並びに仏国
では小児のアメーバ症に係る効能・効果が承認されており、また、英国、独国及び仏国で
は本薬に感性の嫌気性菌としてクロストリジウム・ディフィシルが本薬添付文書で提示さ
れている。米国では、米国感染症学会(IDSA)のガイドライン 5)において、嫌気性菌によ
る小児の腹腔内感染症に対して、本薬注射剤の使用が推奨されている。
本邦においても、嫌気性菌による腹膜炎、腹腔内膿瘍、脳膿瘍及び感染性腸炎の小児患
者に対する本薬注射剤の使用成績が報告されており(6.(2)参照)、また、国内の感染
症治療ガイドライン 35)では、赤痢アメーバ腸炎のうち、重症の腸炎又は肝膿瘍において、
小児に対する本薬注射剤の使用が推奨されている。
以上の点に加え、成人の嫌気性菌感染症等における本薬の薬物動態及び有効性に臨床上
問題となるような国内外差が認められていないこと(平成 26 年 5 月 14 日付けアネメトロ
点滴静注液 500 mg 審査報告書 参照)を踏まえると、医療上の必要性の高い未承認薬・適
応外薬検討会議(以下、
「検討会議」
)は、要望効能・効果について、日本人小児患者での本
薬注射剤の有効性は医学薬学上公知と判断できると考える。
20
49 / 235