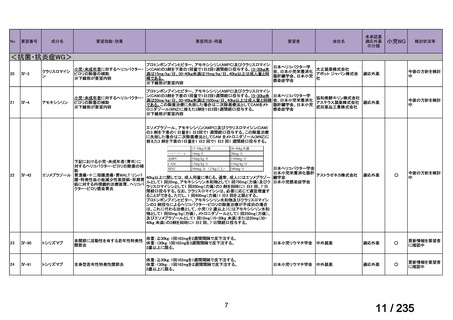
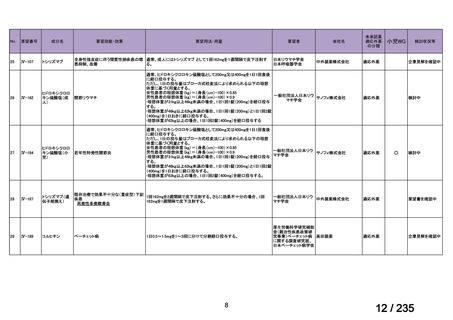
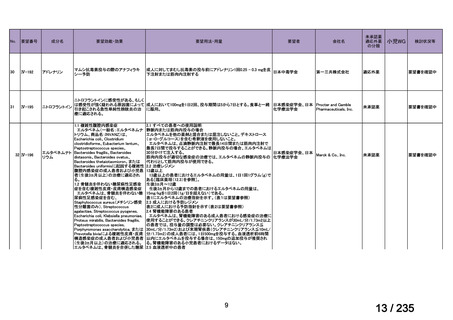
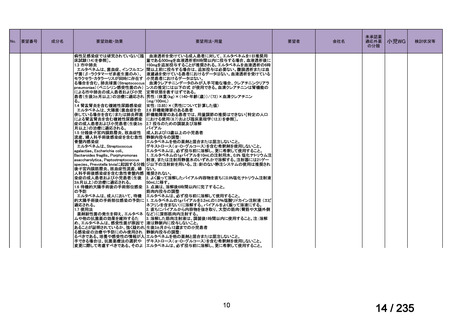
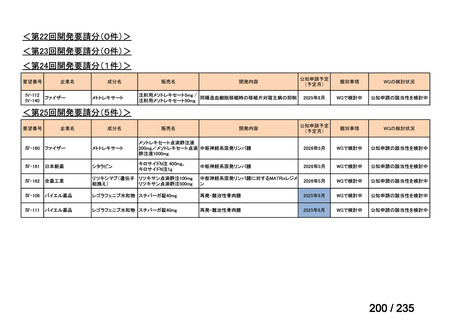
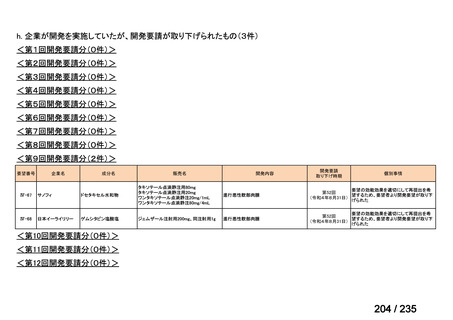
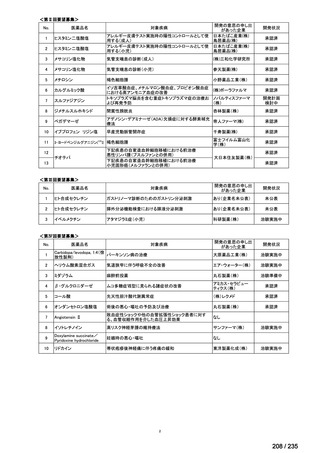
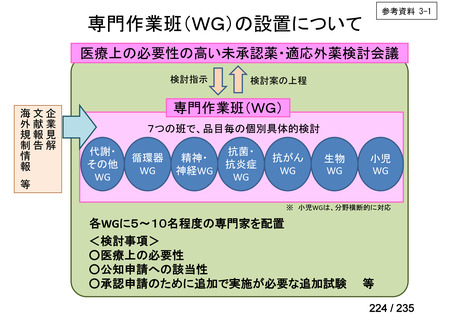
会議資料 (69 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
う)に 131I-MIBG を併用したときの有効性及び安全性を検討することを目的とした第Ⅱ相試
験が実施された。
用法・用量について、幹細胞移植日を Day 0 として、GFR が 100 mL/min/1.73 m2 以上の
患者では 131I-MIBG 444 MBq/kg、GFR が 60~99 mL/min/1.73 m2 の患者では 131I-MIBG
296 MBq/kg が Day -21 に 2 時間かけて静脈内投与、カルボプラチン及びエトポシドが Day
-7~-4 に点滴静注、メルファランが Day -7~-5 に急速静脈内投与され、その後、幹細胞移
植が実施された。カルボプラチン、エトポシド及びメルファランの投与量は、患者の体重
及び GFR に応じて調整された。
有効性について、 NANT Response Criteria に基づく奏効率はコホート 1(導入化学療法に
対して効果がなかった、又は増悪した患者)で 10%(4/41 例)、コホート 2(導入化学療法
の終了時点で少なくとも部分奏効(以下、
「PR」
)となった患者)で 38%(3/8 例)であっ
た。3 年 EFS 率及び 3 年 OS 率は、コホート 1 でそれぞれ 20±7%、62±8%、コホート 2 で
それぞれ 38±17%、75±15%であった。
安全性について、2/50 例に重篤な有害事象(カテーテルに関連した菌血症及び一過性の
ウイルス性上気道感染)が認められた。Grade 3 以上の非血液毒性は、発熱性好中球減少症
35 例、口内炎/粘膜炎 32 例、菌血症 14 例、低酸素症 9 例、類洞閉塞性症候群 6 例、敗血症
2 例であった。28 例が死亡に至り、死因は、疾患進行 23 例(本試験の治療終了から 3 年後
に発症した二次性 AML 1 例を含む)、治療に関連した臓器関連毒性/類洞閉塞症症候群
(SOS)及び本試験終了後の治療に関連した多臓器不全各 2 例であった。
5)Sevrin F, et al. Phase II study of (131) I-metaiodobenzylguanidine with 5 days of topotecan for
refractory or relapsed neuroblastoma: Results of the French study MIITOP. Pediatr Blood Cancer
2023; 70: e30615. 17)
MIBG 集積陽性の再発又は難治性の神経芽腫患者 30 例(2~20 歳)を対象に、131I-MIBG
とトポテカンを併用投与した際の有効性及び安全性を検討することを目的とした第Ⅱ相試
験が実施された。
用法・用量について、Day 1 に 131I-MIBG 444 MBq/kg、Day 1~5 にトポテカン 0.7 mg/m2/day
が静脈内投与された。また、2 回目の投与として Day 21 に全身の総線量が 4 Gy となるよう
に 131I-MIBG、Day 21~25 にトポテカン 0.7 mg/m2/day が静脈内投与された。その後、Day
31 に末梢血幹細胞移植が実施された。
有効性について、主要評価項目である INRC に基づく奏効率[95%CI]は 13[4, 31]%
(4/30 例)であった。
安全性について、Grade 4 の血小板減少が 18/30 例(60%)、Grade 4 の好中球減少が 16/30
例(53%)に認められた。Grade 3~4 の非血液毒性は認められなかった。
6)DuBois SG, et al. Phase I/II study of (131)I-MIBG with vincristine and 5 days of irinotecan for
advanced neuroblastoma. Br J Cancer 2015; 112: 644-9 32)
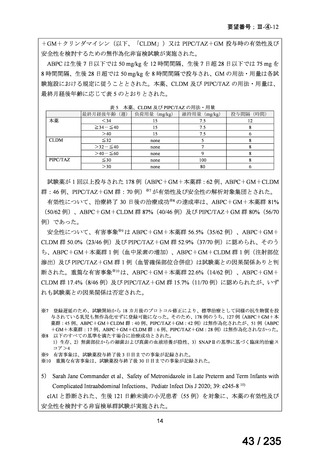
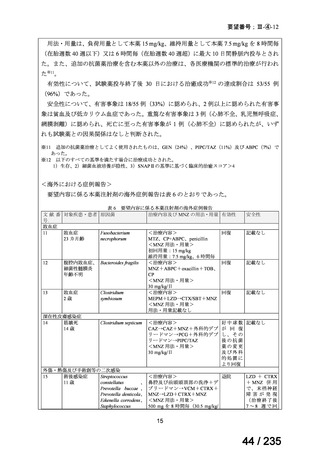
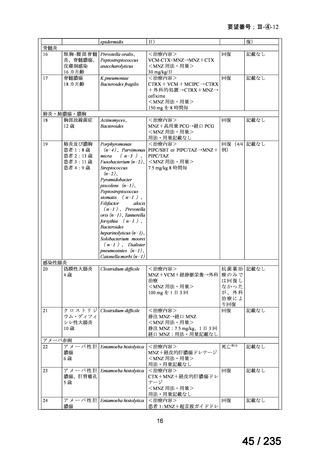
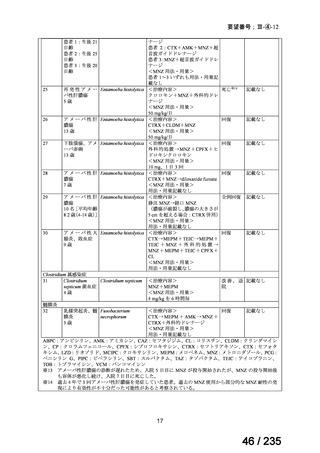
14
69 / 235