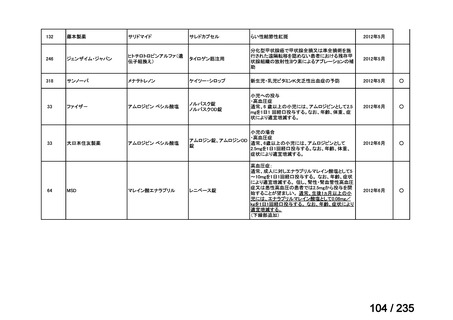
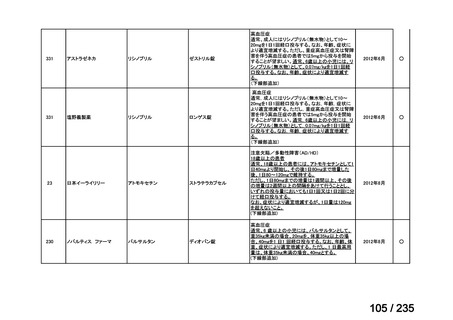
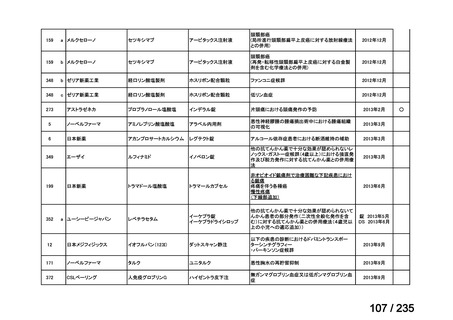
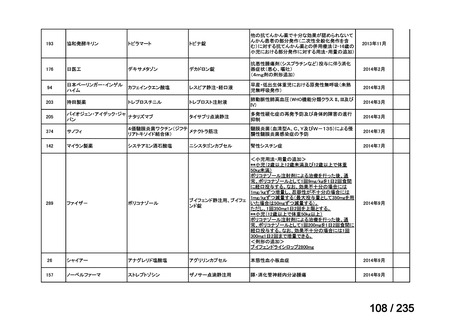
会議資料 (65 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
備考
-
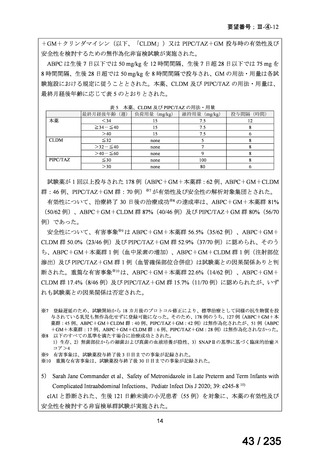
5)加国
ガイドライン名
該当なし
効能・効果
-
(または効能・効果に関
連のある記載箇所)
-
用法・用量
(または用法・用量に関
連のある記載箇所)
ガイドラインの根拠
-
論文
備考
-
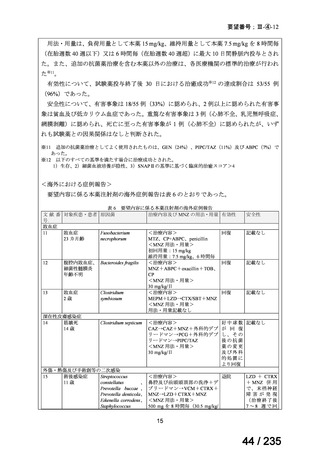
6)豪州
ガイドライン名
該当なし
効能・効果
-
(または効能・効果に関
連のある記載箇所)
-
用法・用量
(または用法・用量に関
連のある記載箇所)
ガイドラインの根拠
-
論文
備考
-
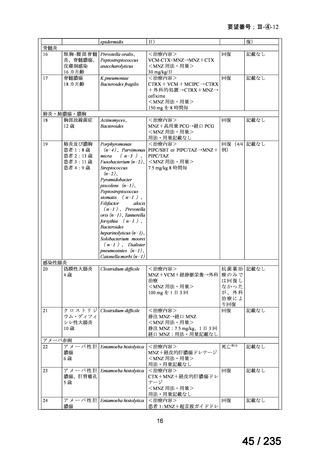
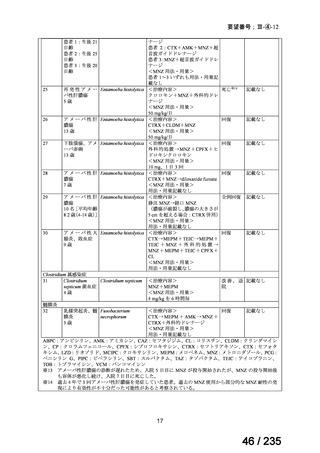
4.要望内容について企業側で実施した海外臨床試験成績について
開発企業が海外で実施した臨床試験はない。
米国 Molecular Insight Pharmaceuticals, Inc.社が 131I-MIBG 製剤である Azedra(旧名称:
Ultratrace)について、再発又は難治性の高リスク神経芽腫を対象とした第Ⅱ相試験を 2008
~2010 年に米国で実施した。
試験名
A Phase 2a Study of Ultratrace™ Iobenguane I 131 in Patients With
Relapsed/Refractory High-Risk Neuroblastoma
(ClinicalTrials.gov Identifier:NCT00659984)
対象
再発又は難治性の高リスク神経芽腫患者 15 例
投与量
444 MBq/kg より開始し、555、666、777 MBq/kg へと用量制限毒性が認めら
10
65 / 235