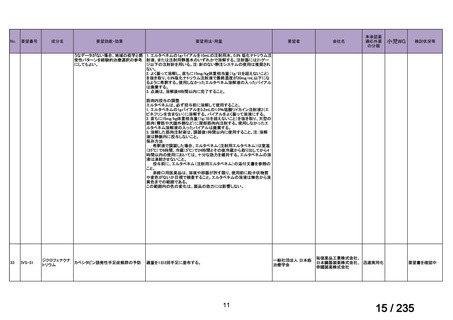
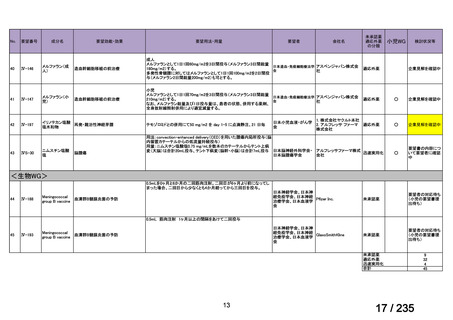
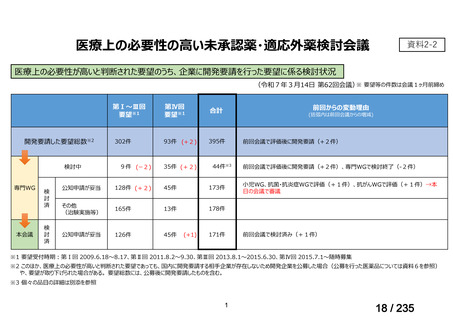
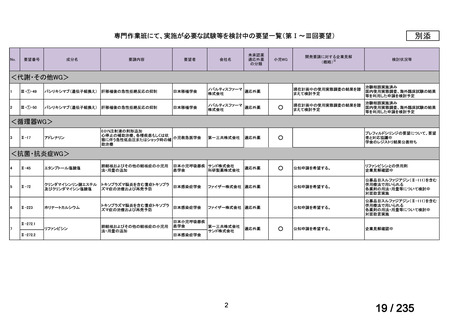
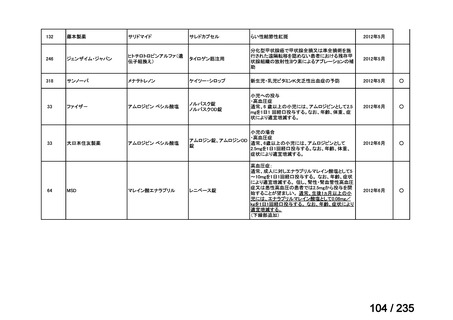
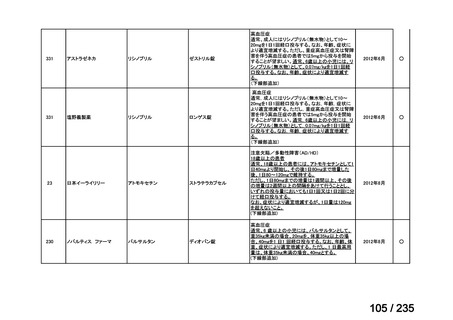
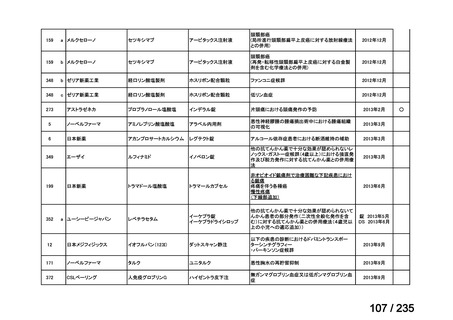
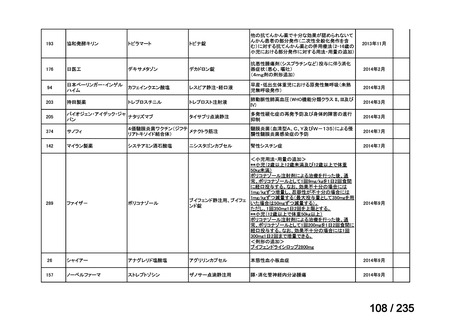
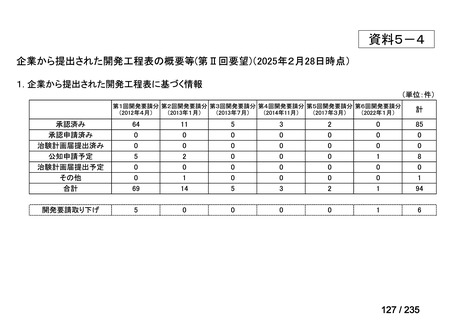
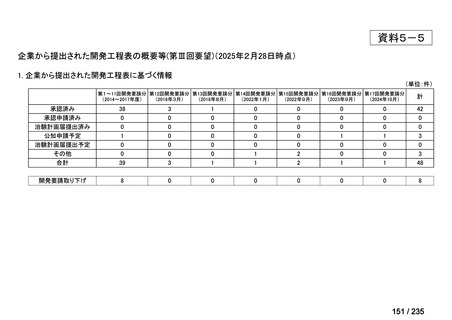
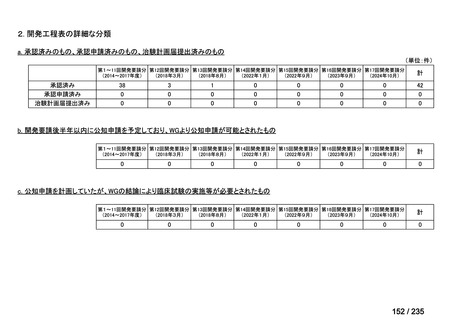
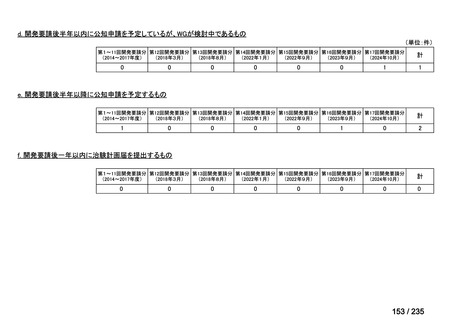
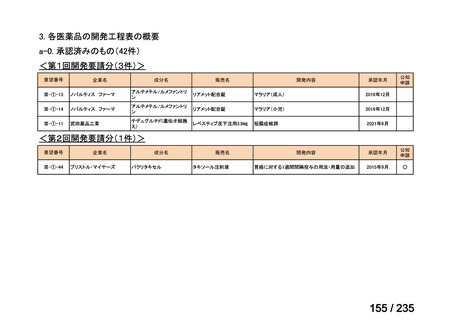
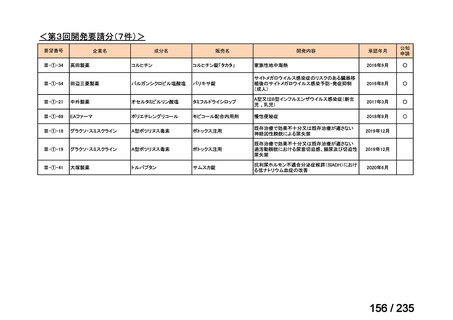
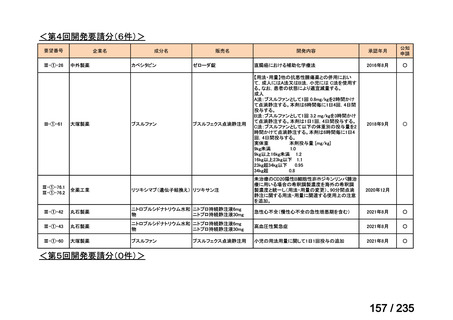
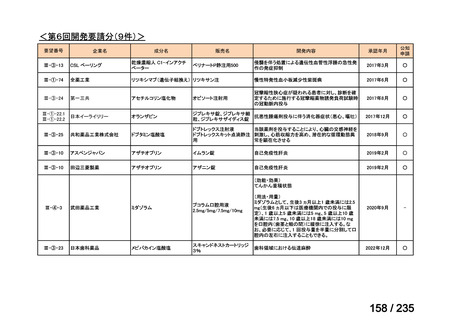
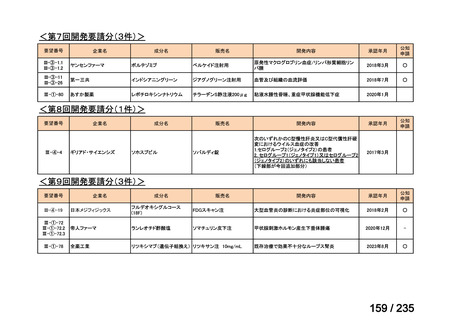
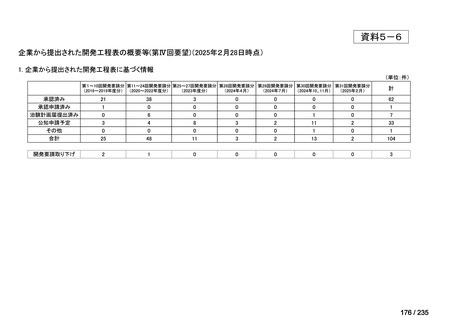
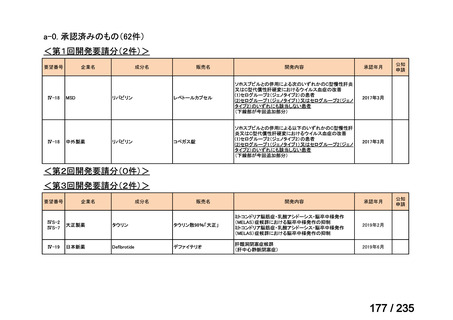
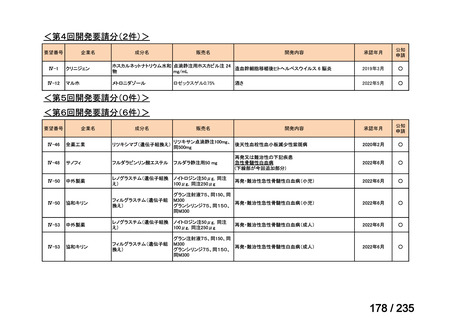
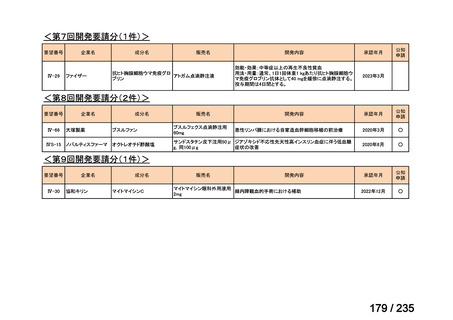
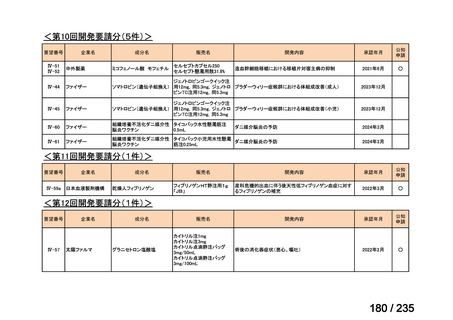
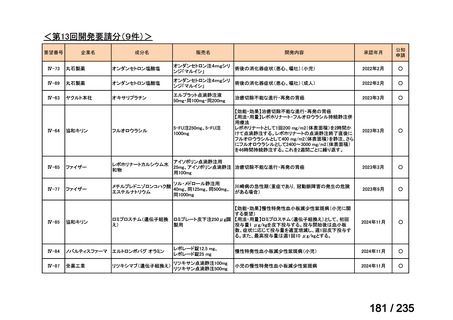
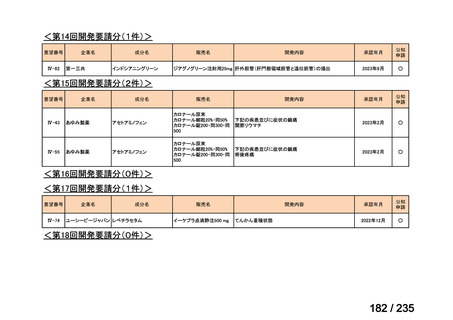
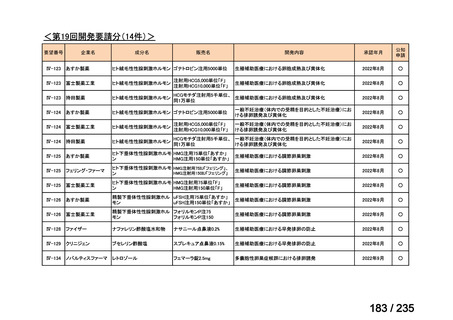
会議資料 (43 ページ)
出典
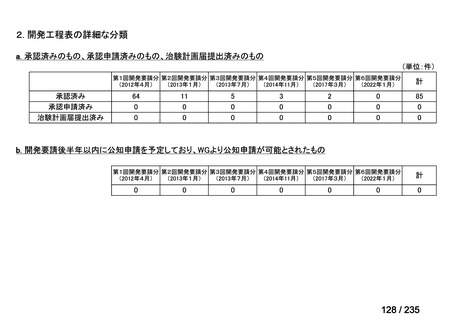
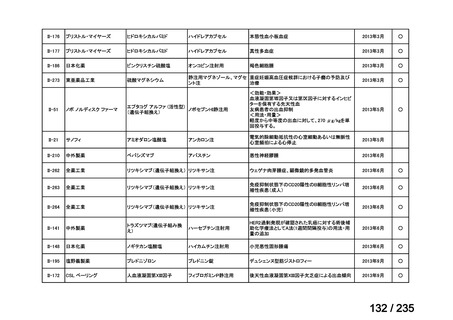
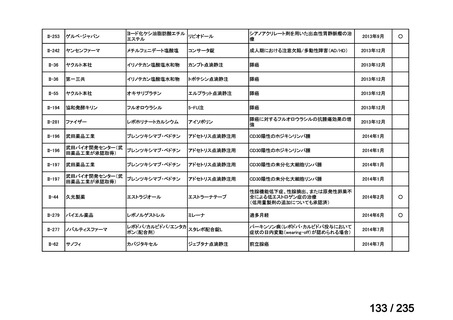
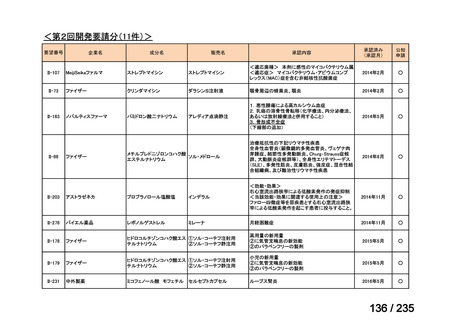
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
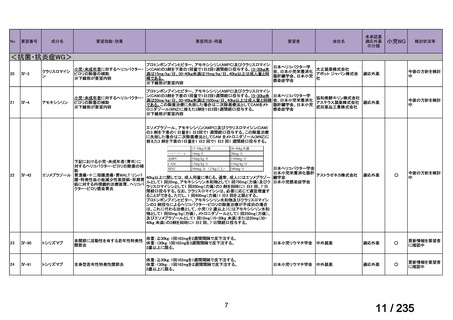
+GM+クリンダマイシン(以下、「CLDM」)又は PIPC/TAZ+GM 投与時の有効性及び
安全性を検討するための無作為化非盲検試験が実施された。
ABPC は生後 7 日以下では 50 mg/kg を 12 時間間隔、生後 7 日超 28 日以下では 75 mg を
8 時間間隔、生後 28 日超では 50 mg/kg を 8 時間間隔で投与され、GM の用法・用量は各試
験施設における規定に従うこととされた。本薬、CLDM 及び PIPC/TAZ の用法・用量は、
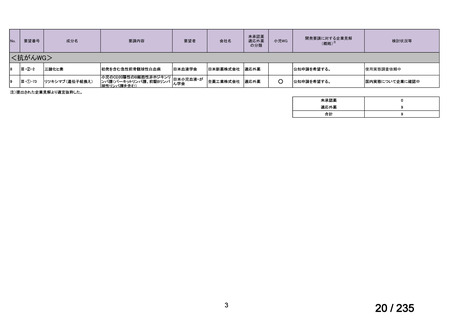
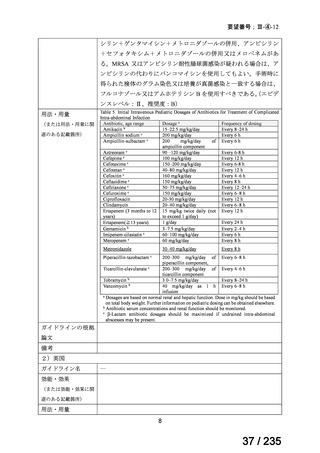
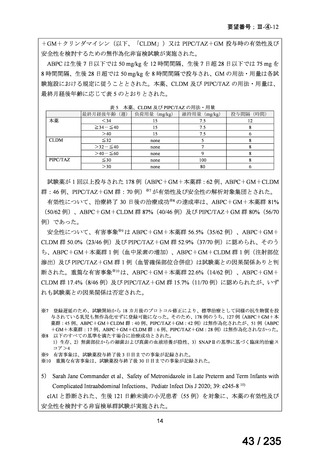
最終月経後年齢に応じて表 5 のとおりとされた。
本薬
CLDM
PIPC/TAZ
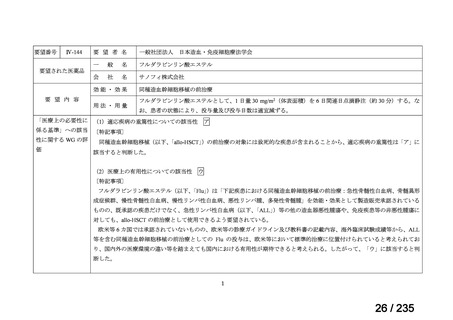
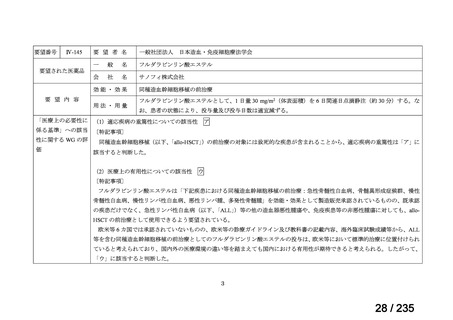
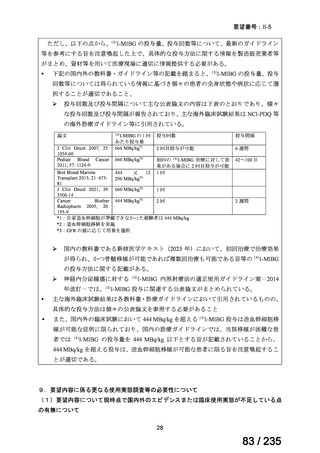
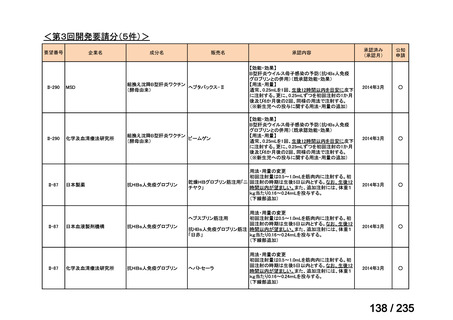
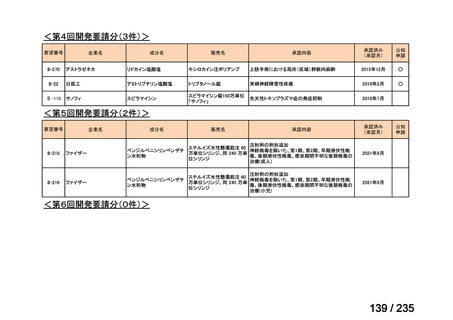
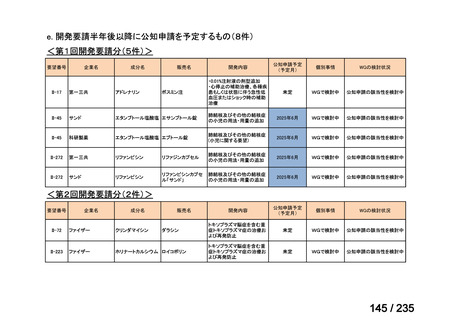
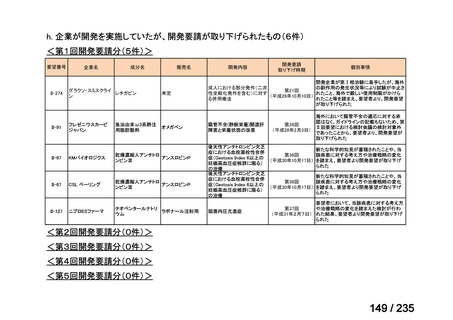
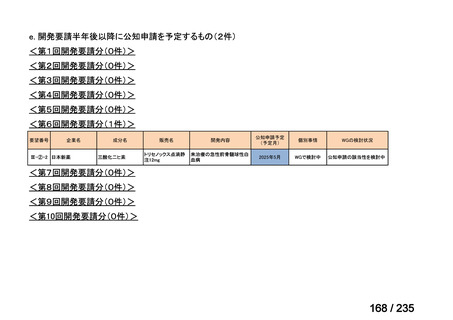
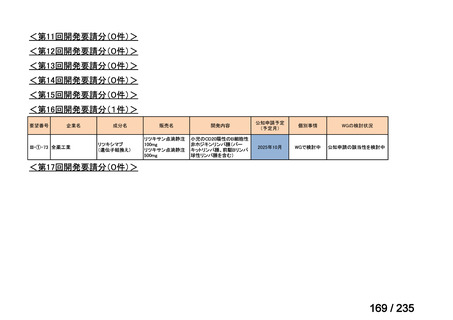
表 5 本薬、CLDM 及び PIPC/TAZ の用法・用量
最終月経後年齢(週) 負荷用量(mg/kg) 維持用量(mg/kg)
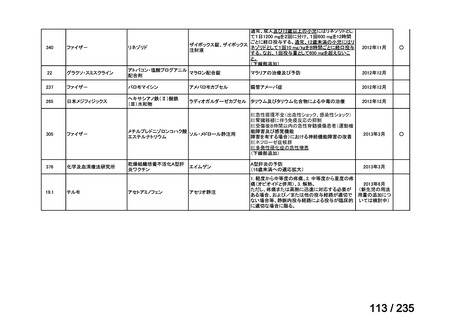
<34
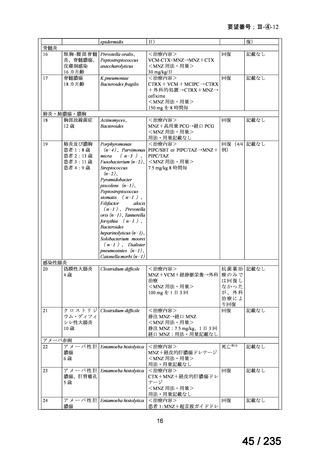
15
7.5
≧34-≦40
15
7.5
>40
15
7.5
≦32
none
5
>32-≦40
none
7
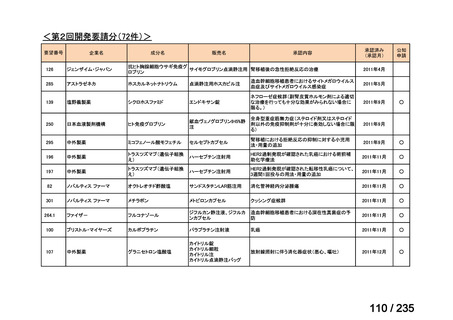
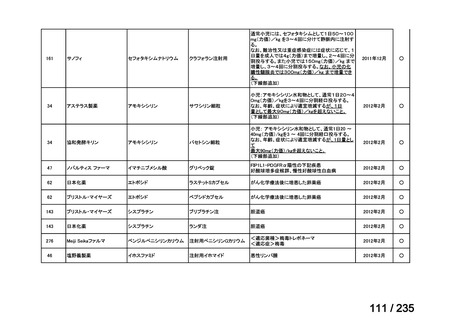
>40-≦60
none
9
≦30
none
100
>30
none
80
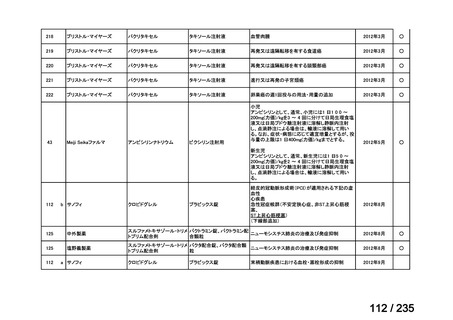
投与間隔(時間)
12
8
6
8
8
8
8
6
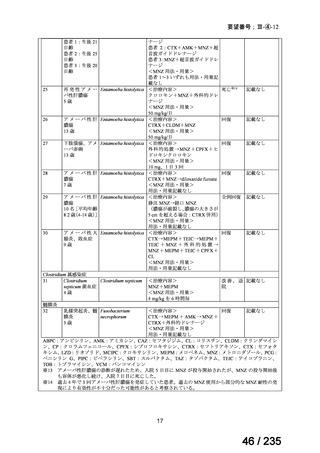
試験薬が 1 回以上投与された 178 例(ABPC+GM+本薬群:62 例、ABPC+GM+CLDM
群:46 例、PIPC/TAZ+GM 群:70 例)※7 が有効性及び安全性の解析対象集団とされた。
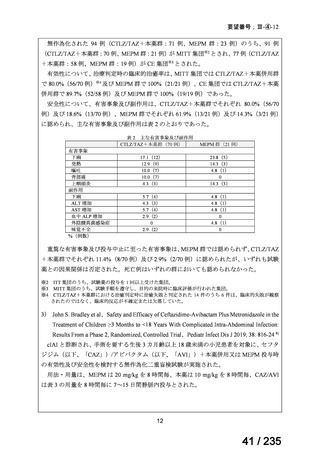
有効性について、治療終了 30 日後の治療成功※8 の達成率は、ABPC+GM+本薬群 81%
(50/62 例)、ABPC+GM+CLDM 群 87%(40/46 例)及び PIPC/TAZ+GM 群 80%(56/70
例)であった。
安全性について、有害事象※9 は ABPC+GM+本薬群 56.5%(35/62 例)、ABPC+GM+
CLDM 群 50.0%(23/46 例)及び PIPC/TAZ+GM 群 52.9%(37/70 例)に認められ、そのう
ち、ABPC+GM+本薬群 1 例(血中尿素の増加)、ABPC+GM+CLDM 群 1 例(注射部位
滲出)及び PIPC/TAZ+GM 群 1 例(血管確保部位合併症)は試験薬との因果関係ありと判
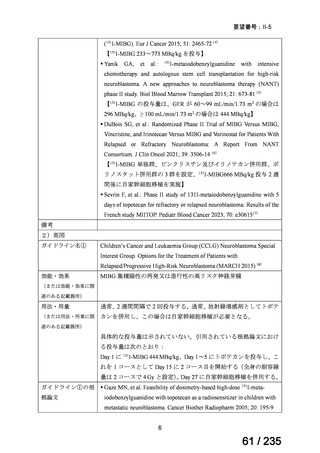
断された。重篤な有害事象※10 は、ABPC+GM+本薬群 22.6%(14/62 例)、ABPC+GM+
CLDM 群 17.4%(8/46 例)及び PIPC/TAZ+GM 群 15.7%(11/70 例)に認められたが、いず
れも試験薬との因果関係は否定された。
登録遅延のため、試験開始から 18 カ月後のプロトコル修正により、標準治療として同様の抗生物質を投
与されている乳児も無作為化せずに登録可能になった。そのため、178 例のうち、127 例(ABPC+GM+本
薬群:45 例、ABPC+GM+CLDM 群:40 例、PIPC/TAZ+GM:42 例)は無作為化されたが、51 例(ABPC
+GM+本薬群:17 例、ABPC+GM+CLDM 群:6 例、PIPC/TAZ+GM:28 例)は無作為化されなかった。
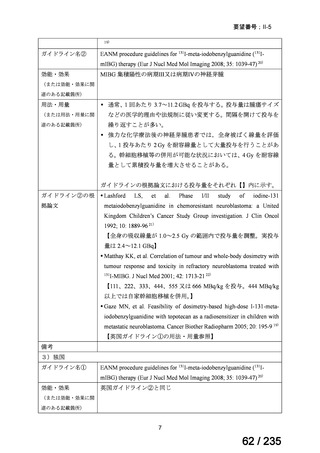
※8 以下のすべての基準を満たす場合に治療成功とされた。
1)生存、2)無菌部位からの細菌および真菌の血液培養が陰性、3)SNAPⅡの基準に基づく臨床的治癒ス
コア>4
※9 有害事象は、試験薬投与終了後 3 日目までの事象が記録された。
※10 重篤な有害事象は、試験薬投与終了後 30 日目までの事象が記録された。
※7
5) Sarah Jane Commander et al、Safety of Metronidazole in Late Preterm and Term Infants with
Complicated Intraabdominal Infections、Pediatr Infect Dis J 2020; 39: e245-8 10)
cIAI と診断された、生後 121 日齢未満の小児患者(55 例)を対象に、本薬の有効性及び
安全性を検討する非盲検単群試験が実施された。
14
43 / 235