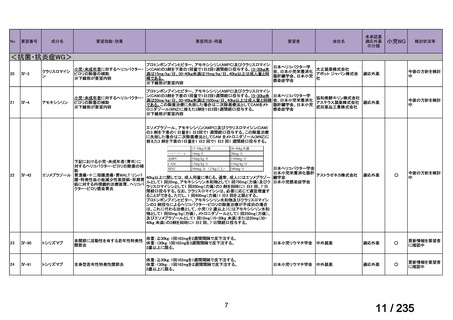
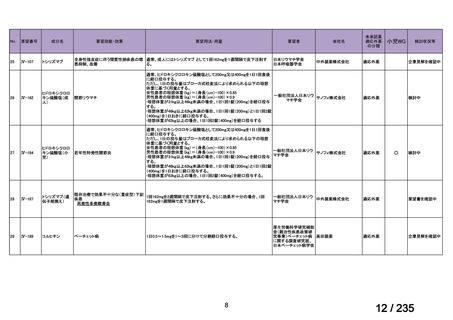
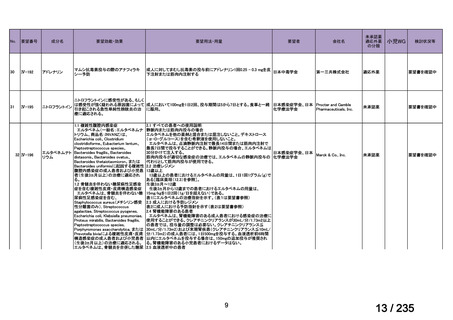
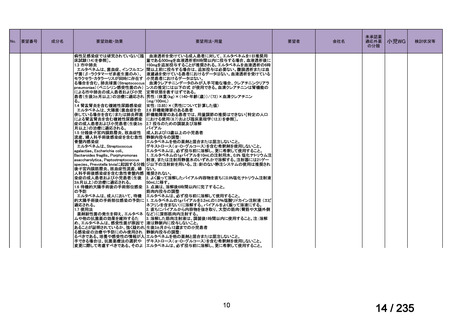
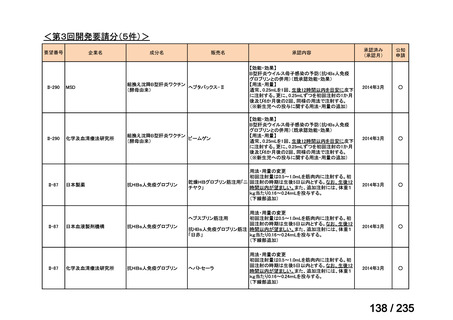
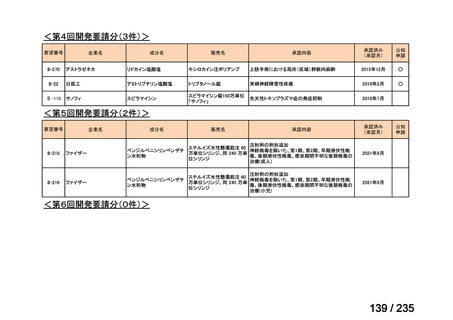
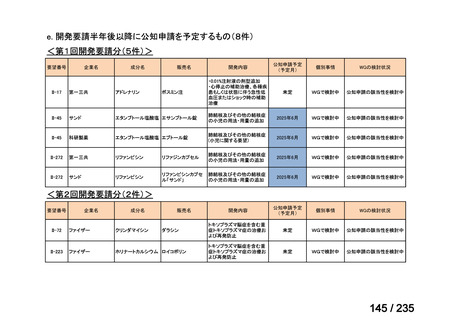
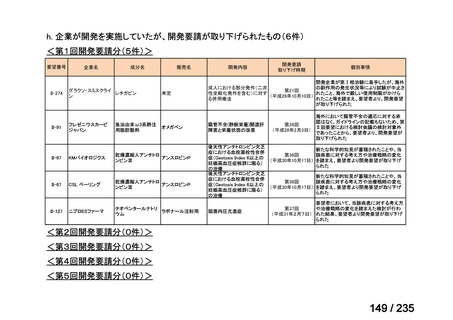
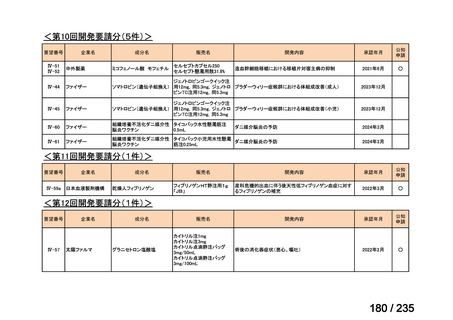
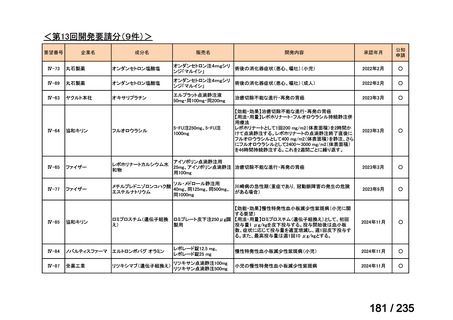
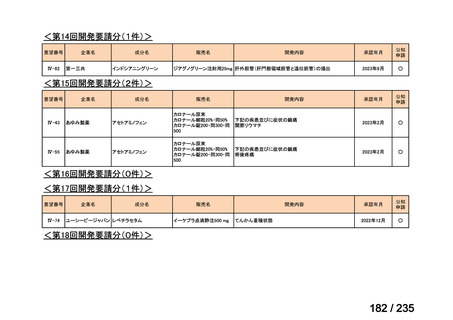
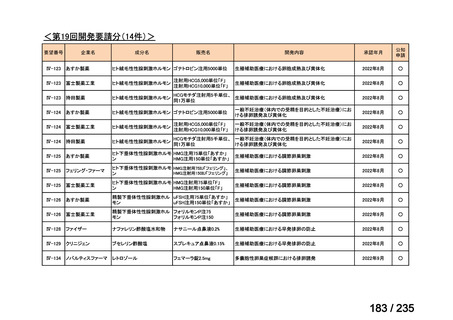
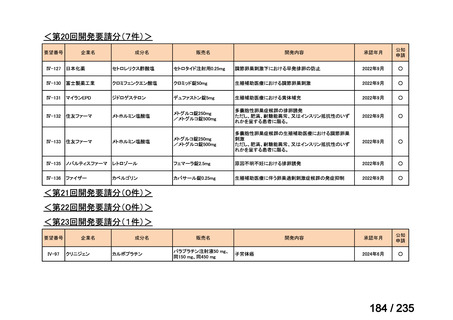
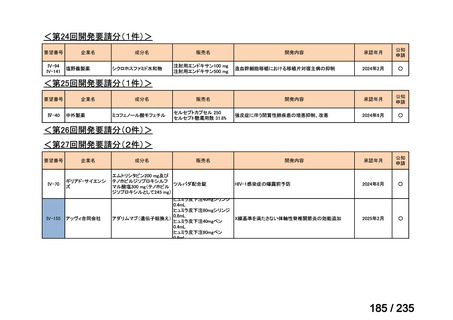
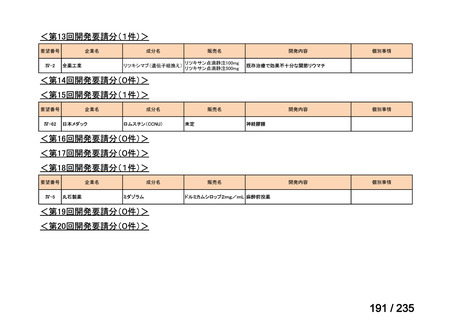
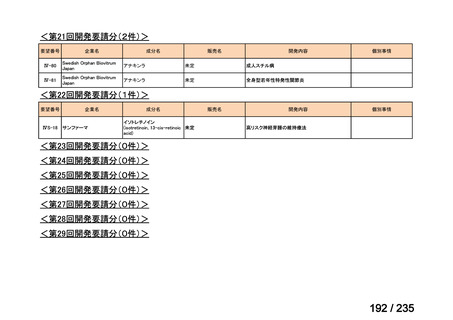
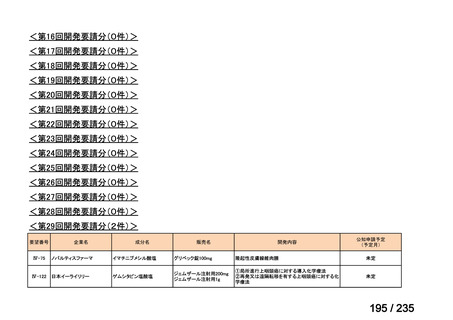
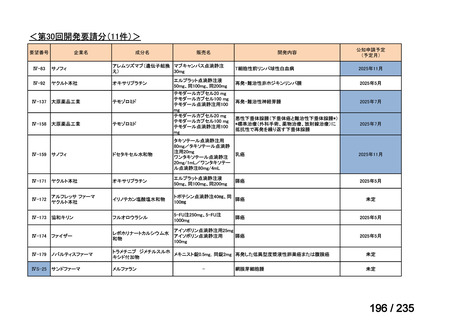
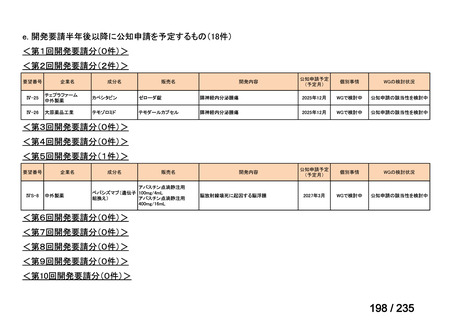
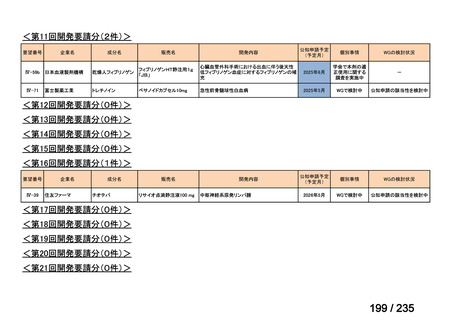
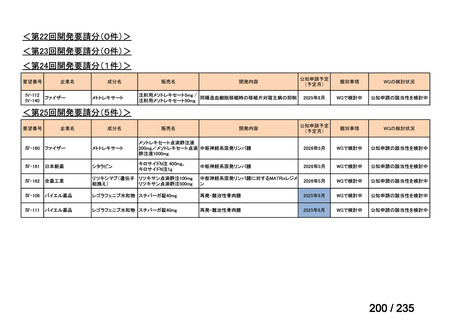
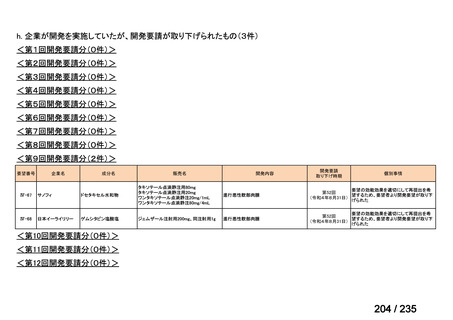
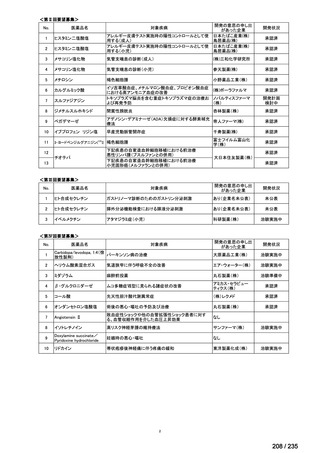
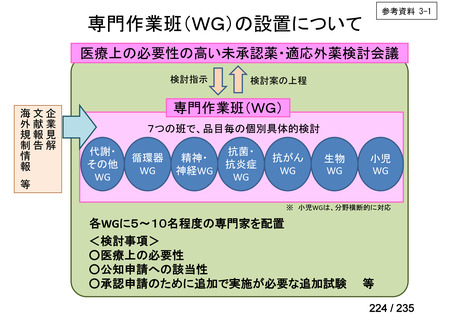
会議資料 (71 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
投与し、その後、自家幹細胞移植を行うこととされた。なお、131I-MIBG の投与量について、
試験開始時点では 666 MBq/kg と設定されていたものの、晩期の有害事象が懸念され試験途
中から 444 MBq/kg に変更された。
有効性について、5 年 OS 率及び 5 年 EFS 率はそれぞれ 72.4±6.4%及び 58.3±6.9%であ
った。
安全性について、131I-MIBG の投与中及び投与後における急性の有害事象は認められなか
った。131I-MIBG 投与後に Grade 3 以上の非血液毒性として、腹痛及び下痢各 15 例(34.9%)、
嘔吐 5 例(11.6%)
、肝酵素上昇及び肝中心静脈閉塞症(VOD)各 1 例(2.3%)が認められ
た。
8)Kraal KC, et al. Upfront treatment of high-risk neuroblastoma with a combination of 131I-MIBG
and topotecan. Pediatr Blood Cancer. 2015;62(11):1886-91. 34)
初発の高リスク神経芽腫患者 16 例(1.6~8.3 歳)を対象に、131I-MIBG とトポテカンとの
併用投与の有効性及び安全性を検討することを目的とした第Ⅱ相試験が実施された。
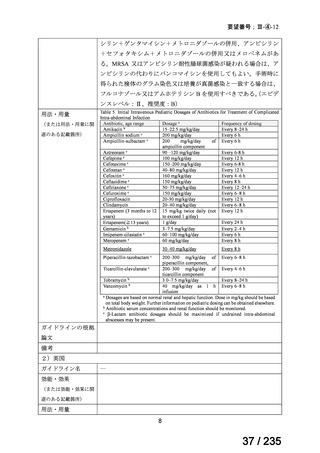
用法・用量について、131I-MIBG 7.4 GBq と 5 日間のトポテカン 0.7 mg/m2 の静脈内投与が
行われ、4 週間後に 131I-MIBG 5.6 GBq と 5 日間のトポテカン 0.7 mg/m2 の静脈内投与が行
われた。その後、ビンクリスチン 1.5 mg/m2、カルボプラチン 400 mg/m2、teniposide(本邦
未承認)150 mg/m2 及びイホスファミド 3,000 mg/m2 の投与が 4 週間間隔で 4 回投与され、
遠隔転移がない場合には手術が行われた後に、カルボプラチン 800 mg/m2 及びメルファラ
ン 180 mg/m2 による骨髄破壊的な治療後に自家幹細胞移植が実施された。
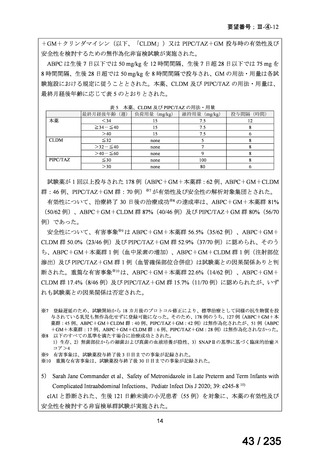
有効性について、主要評価項目である INRC に基づく奏効率は 57%(9/16 例)であった。
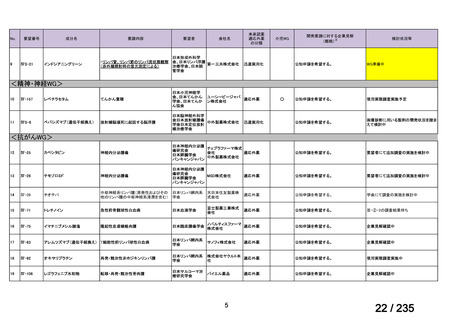
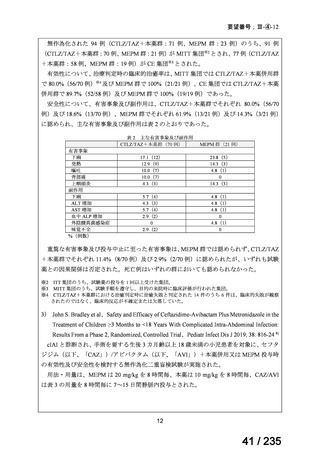
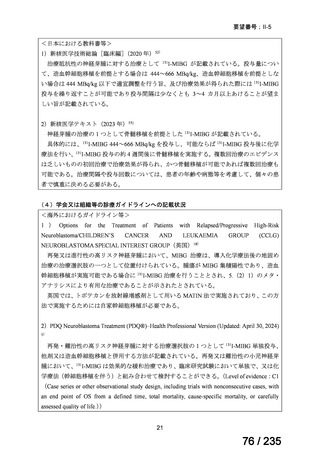
安全性について、認められた Grade 3 以上の血液毒性は下表のとおりであった。
例数(例)
血小板減少症
1 コース後(16 例)
2 コース後(15 例)
Grade 3
2
4
好中球減少症
Grade 4
4
5
Grade 3
6
4
Grade 4
2
5
ヘモグロビン減少症
Grade 3
7
7
Grade 4
4
1
9)Seo ES, et al. Response-adapted consolidation therapy strategy for patients with metastatic highrisk neuroblastoma: Results of the SMC NB-2014 study. Pediatr Blood Cancer 2024; 71: e31173 35)
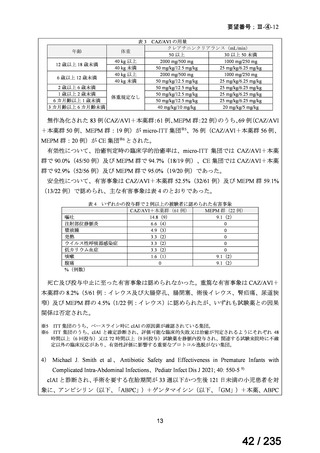
MIBG 集積陽性の遠隔転移を有する高リスク神経芽腫患者 85 例を対象とした第Ⅱ相試験
が実施された。
用法・用量について、導入化学療法を実施後に、地固め療法として、MIBG 集積陽性例で
はカルボプラチンとエトポシドとシクロホスファミドを組み合わせた大量化学療法、MIBG
集積陽性例では大量化学療法とその後の 131I-MIBG 投与(666 又は 444 MBq/kg)
、131I-MIBG
投与 21 日後に自家幹細胞移植が実施された。MIBG 集積陽性例において、初回の 131I-MIBG
投与の効果が認められた患者では 2 回目の 131I-MIBG 投与が実施された。その後すべての
16
71 / 235