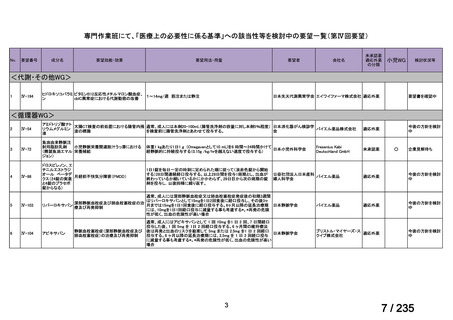
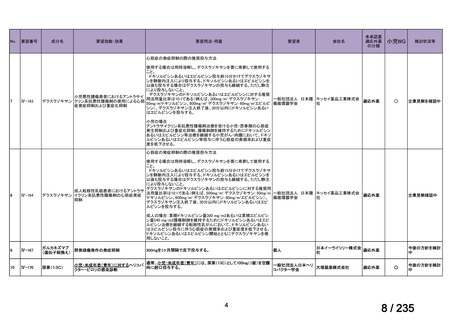
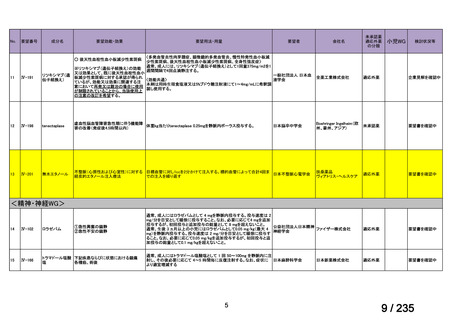
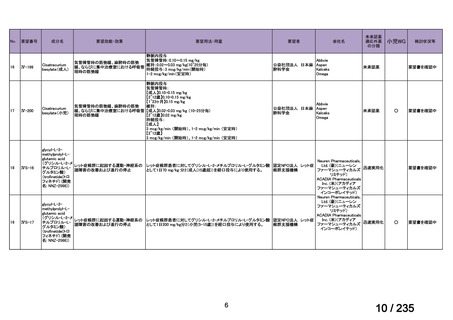
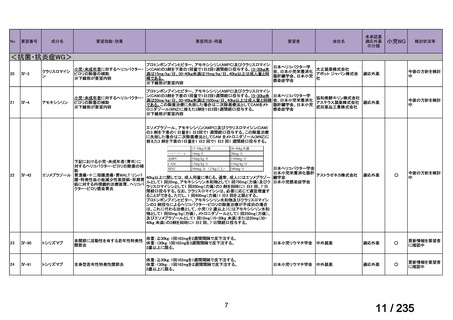
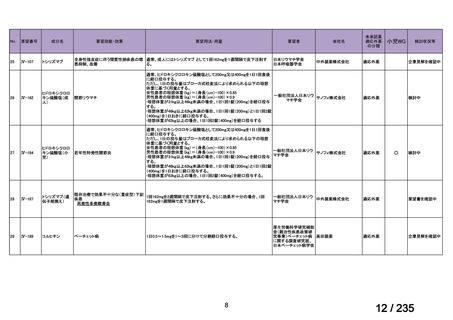
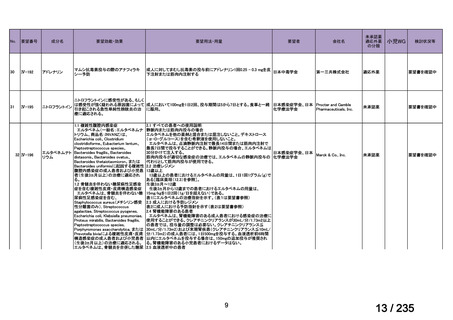
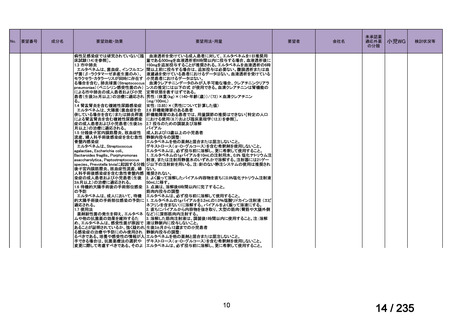
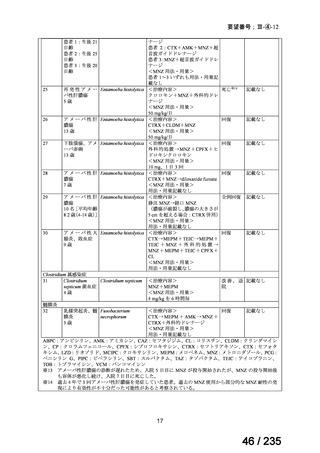
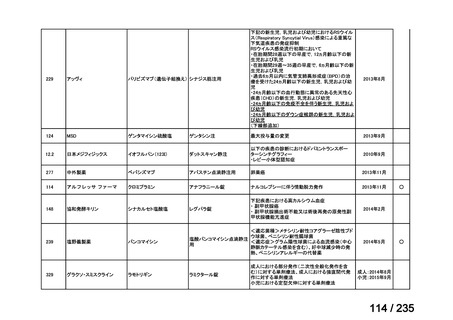
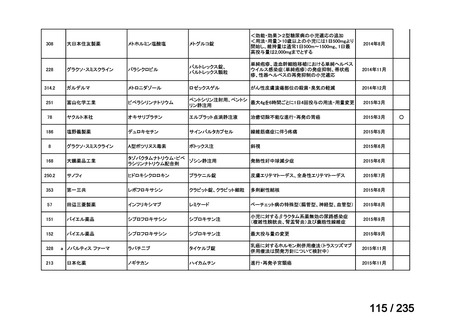
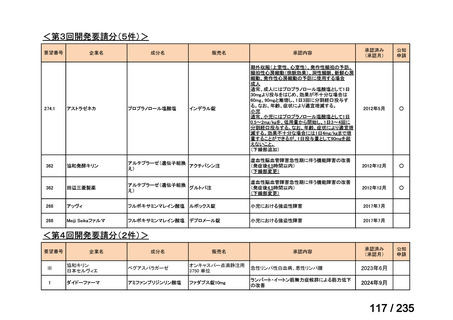
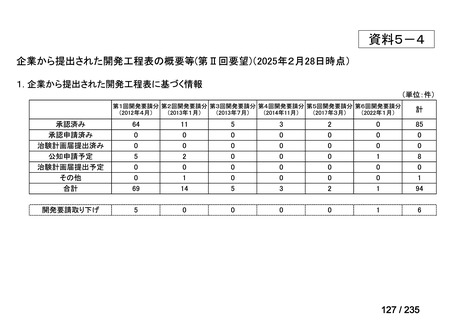
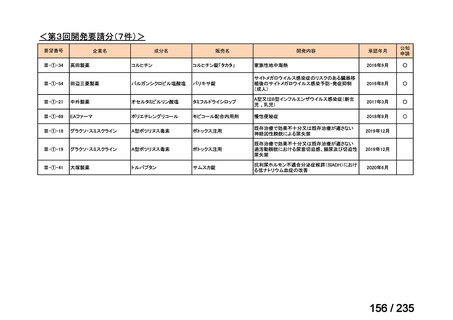
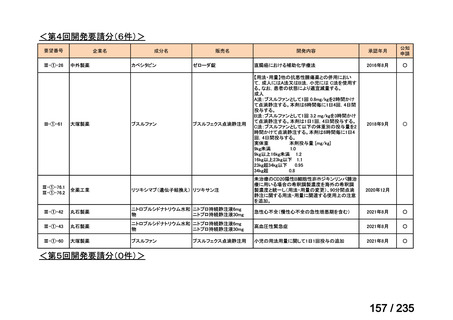
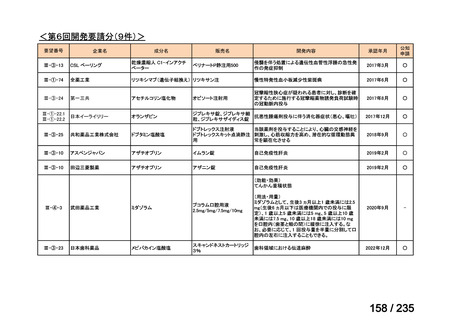
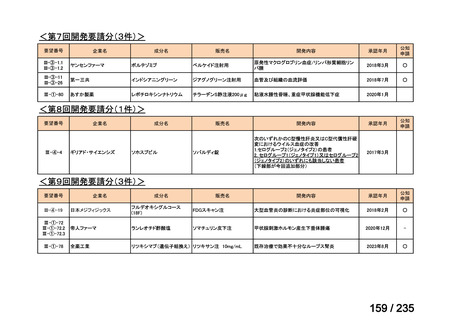
会議資料 (67 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
131
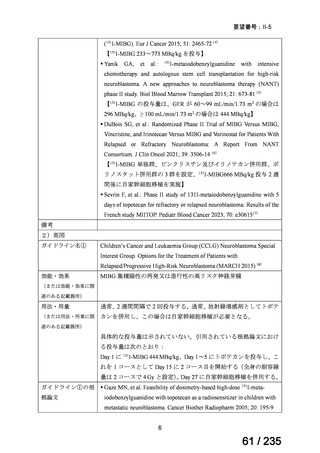
I-MIBG 投与後 3 カ月以内に死亡に至った有害事象はニューモシスチス肺炎、毛細血管漏
出症候群、疾患進行及び真菌性敗血症各 1 例であった。4 例の患者が、131I-MIBG 投与と関
連する可能性がある骨髄異形成症候群(以下、
「MDS」)/急性骨髄性白血病(以下、
「AML」
)
により死亡した。
2 ) Johnson K, et al. Safety and efficacy of tandem 131I-metaiodobenzylguanidine infusions in
relapsed/refractory neuroblastoma. Pediatr Blood Cancer 2011; 57: 1124-9 12)
初回の 131I-MIBG 治療に対して効果があり(SD を含む)、末梢血細胞移植が実施可能
な MIBG 集積陽性の再発神経芽腫患者 76 例(1~19 歳)を対象に、2 回目の 131I-MIBG 投
与の有効性及び安全性を検討することを目的とした非対照試験が実施された。
用法・用量について、初回及び 2 回目のいずれも 131I-MIBG 666 MBq/kg が 2 時間かけて
静脈内投与された。
有効性について、初回治療における INRC に基づく奏効率[95%信頼区間(以下、
「CI」)]
は 30[21, 41]%(37/76 例)であった。初回治療を受けた 41/76 例に 2 回目の治療が実施
され、2 回目の治療の INRC に基づく奏効率[95%CI]は 29[18, 45]%(12/41 例)であっ
た。
安全性について、以下のとおりであった。
血液毒性:初回治療を受けた 61/76 例(80%)に血小板輸血が行われ、17/76 例(22.4%)
は好中球減少又は血小板減少が持続したために末梢血細胞移植が行われた。2 回目の治療
後には 35/41 例(85%)に末梢血幹細胞移植が行われた。
非血液毒性:Grade 3 以上の有害事象は、初回治療後に発熱/好中球減少 9 例、肝機能障害
2 例、甲状腺機能異常 1 例、2 回目の治療後に発熱/好中球減少 6 例、肝機能障害 1 例であ
った。
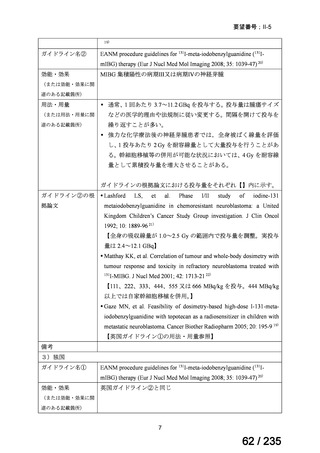
併用投与
3)DuBois SG, et al. Randomized Phase II Trial of MIBG Versus MIBG, Vincristine, and Irinotecan
Versus MIBG and Vorinostat for Patients With Relapsed or Refractory Neuroblastoma: A Report
FromNANT Consortium. J Clin Oncol 2021; 39: 3506-14 16)
再発又は難治性の MIBG 集積陽性の神経芽腫患者 114 例(1.8~28.1 歳)を対象に、
131
I-MIBG を用いた 3 つのレジメンを比較することを目的とした第Ⅱ相試験が実施された。
用法・用量について、131I-MIBG 666 MBq/kg が Day 1 に投与され、その 2 週間後に自家末
梢血幹細胞移植が実施された。初回治療により疾患進行が認められない場合は、2 回目の治
療が可能とされた。併用薬はそれぞれ以下のとおりとされた。
A 群:併用薬なし(単独投与)
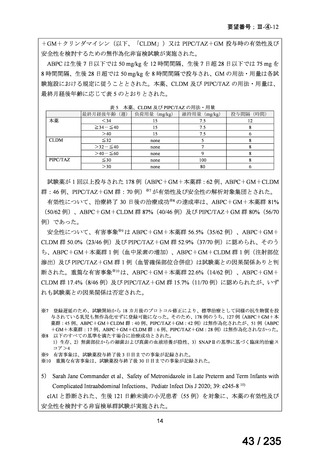
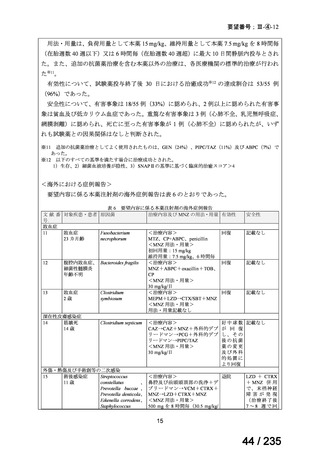
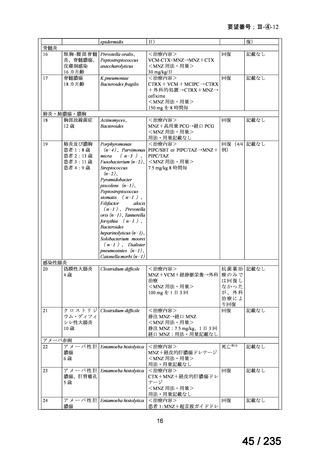
B 群:ビンクリスチン 2 mg/m2 を Day 0 に静脈内投与、イリノテカン 50 mg/m2 を Day 0~4
に静脈内投与
C 群:ボリノスタット 180 mg を 1 日 1 回、Day 1~12 に経口投与
12
67 / 235