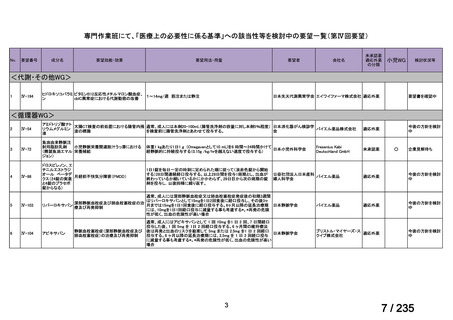
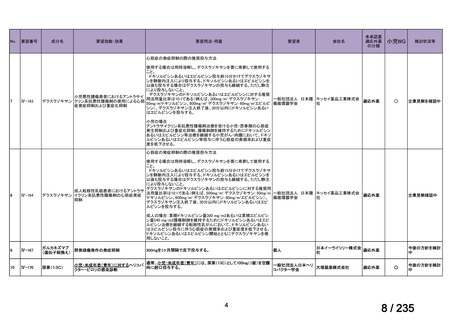
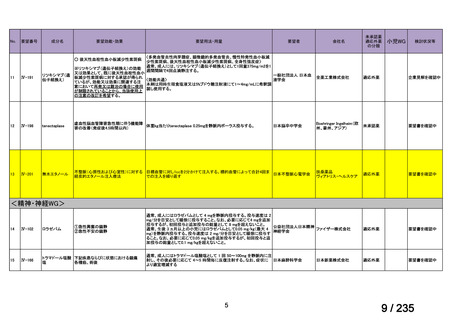
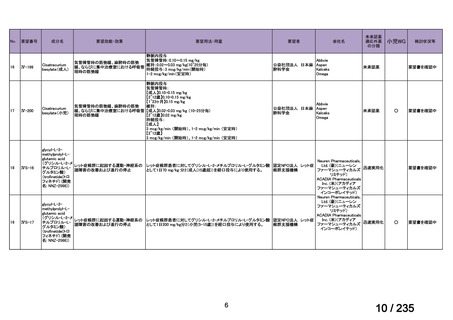
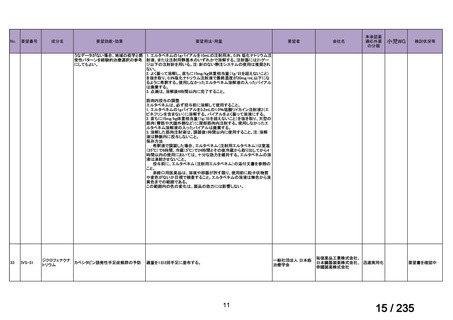
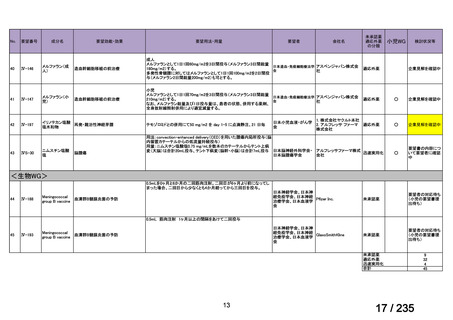
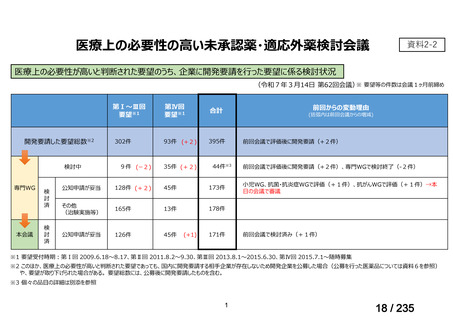
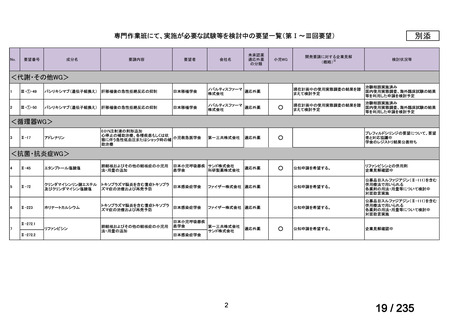
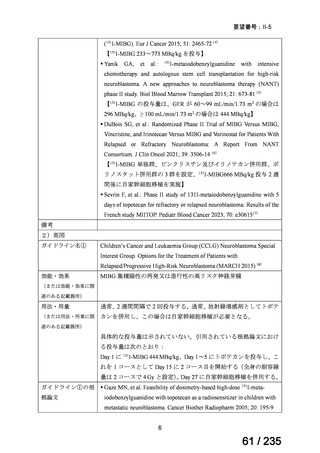
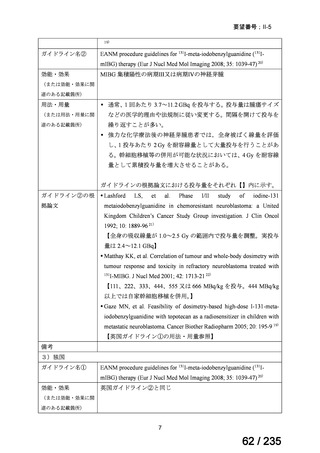
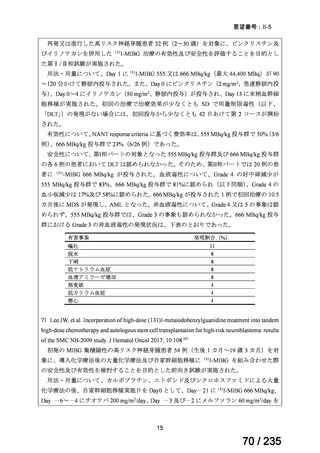
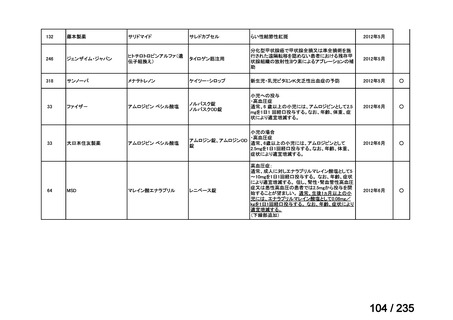
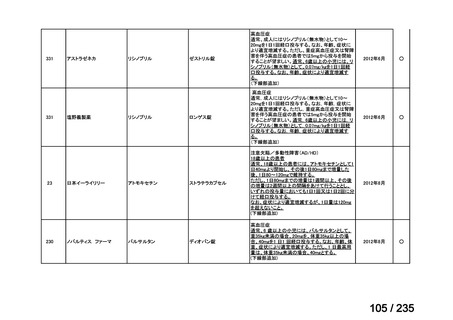
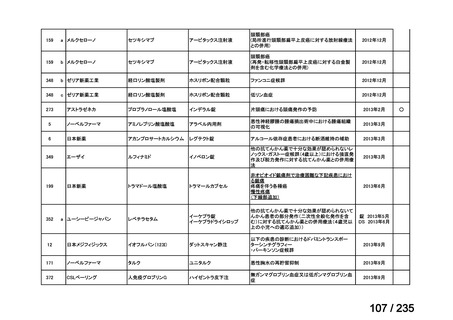
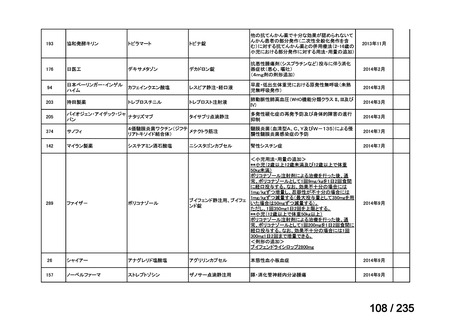
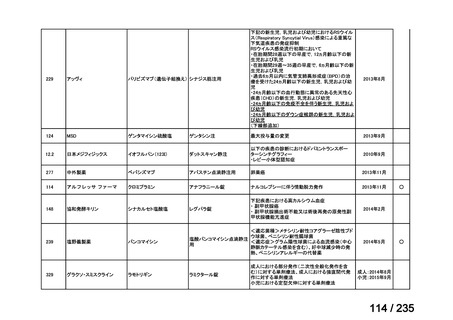
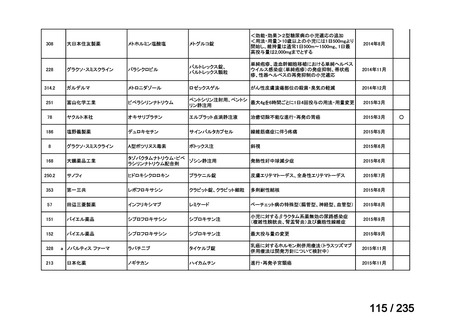
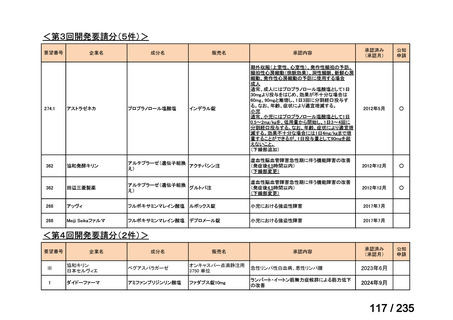
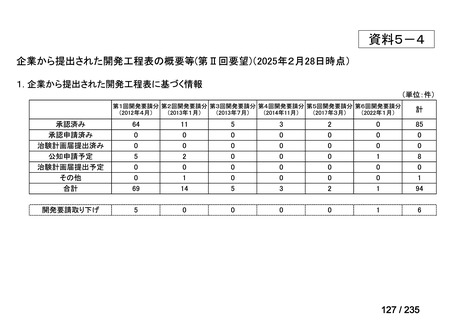
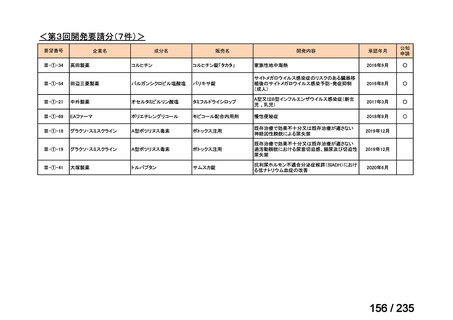
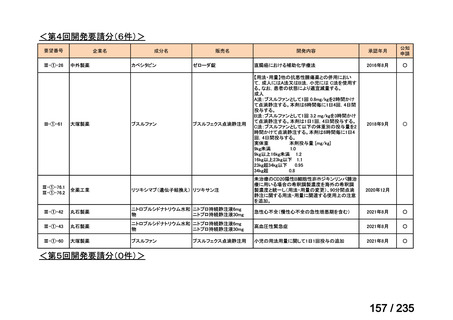
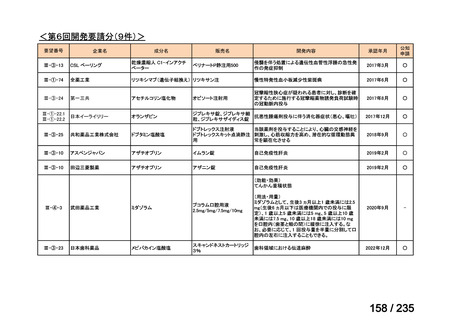
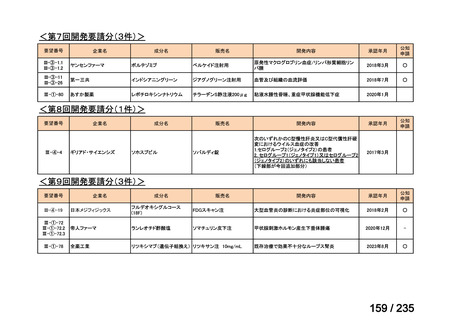
会議資料 (50 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
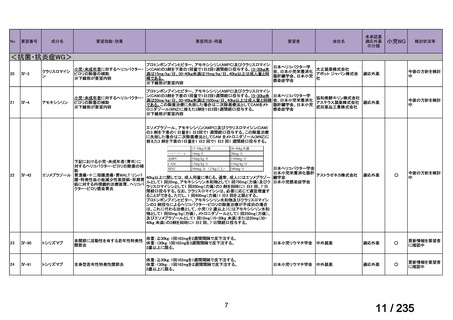
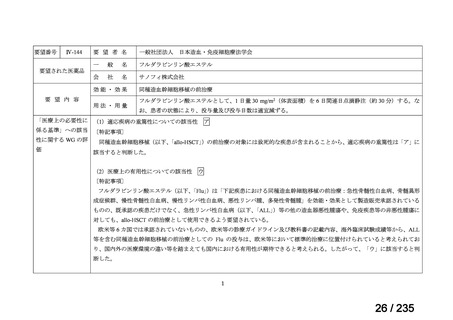
(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性の総合評価につ
いて
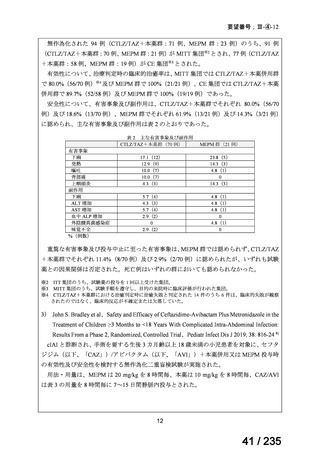
小児を対象に実施された海外臨床試験において、本薬注射剤投与群で認められた主な有
害事象は、下痢、腹痛、嘔吐、発熱、AST 増加、ALT 増加等、成人において報告されてい
る既知の事象であった。本薬との因果関係が否定されなかった死亡例は認められなかった
(5.(1)参照)
。
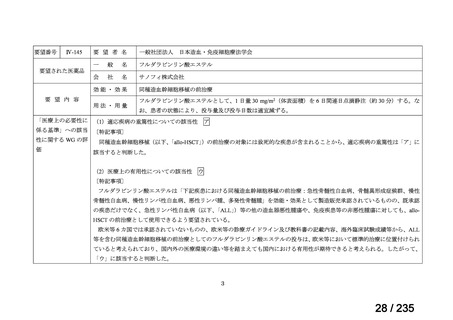
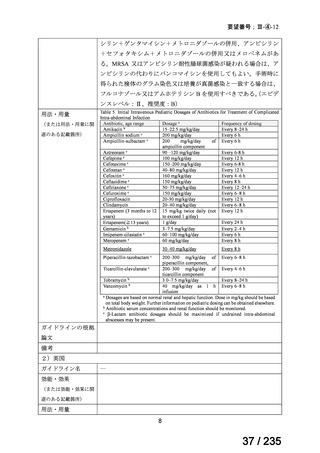
また、ファイザー社の安全性データベース(データカットオフ:2024 年 10 月 31 日)で
は、本薬注射剤が投与された 18 歳未満の患者 222 例で認められた有害事象が報告されてい
た。主な有害事象は表 8 に示すとおり、嘔吐、悪心、ALT 増加、下痢、末梢神経障害、発
熱等、いずれも成人において報告されている既知の事象であった。
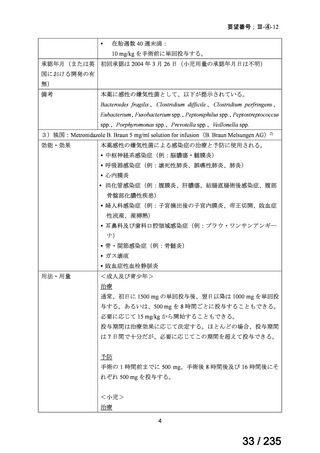
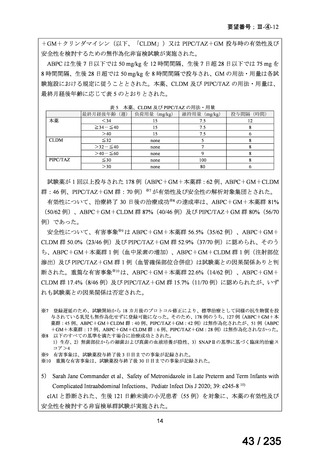
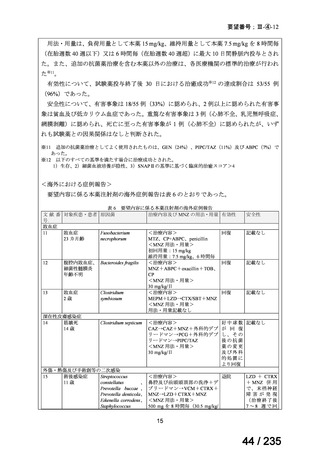
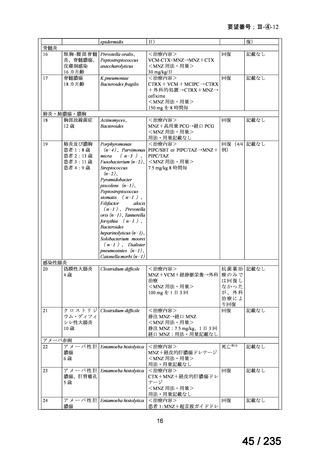
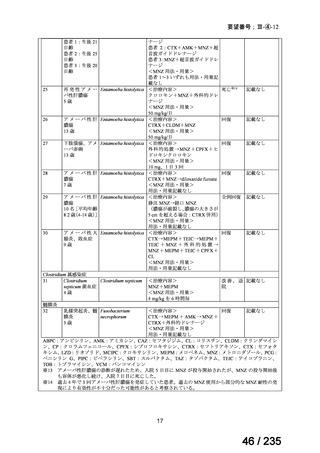
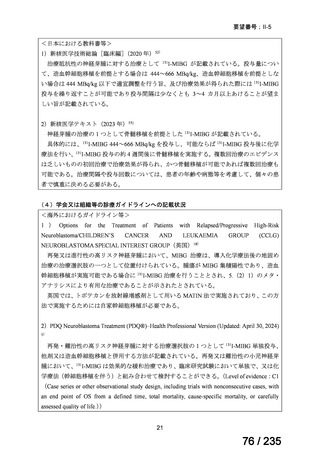
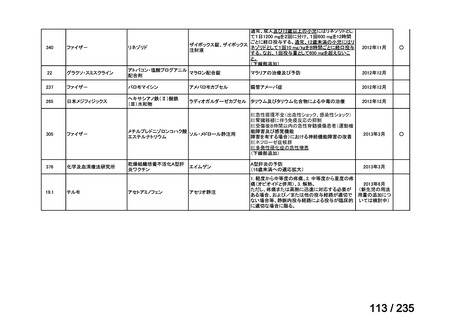
表 8 18 歳未満の患者で認められた主な有害事象 a)
Preferred Term
報告数
40
薬効不十分
33
適応外使用
26
製品使用に関する問題
17
嘔吐
10
悪心
7
AST 増加
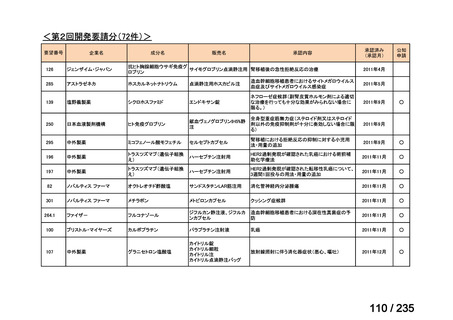
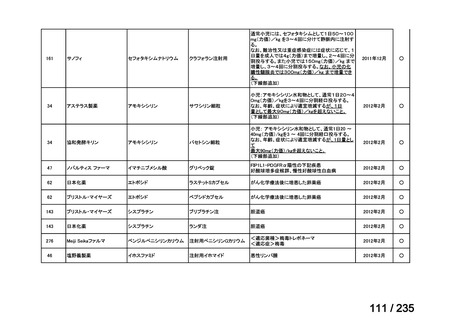
7
下痢
7
抹消神経障害
7
発熱
6
薬剤性過敏症症候群
5
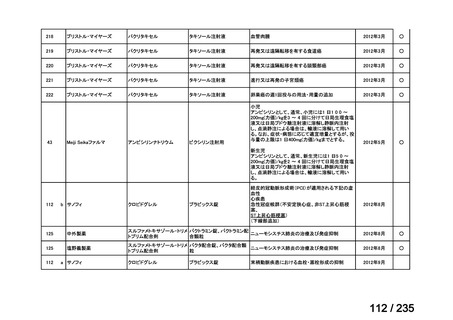
状態の悪化
a) ファイザー社の安全性データベース(2024 年 10 月 31 日データカットオフ)
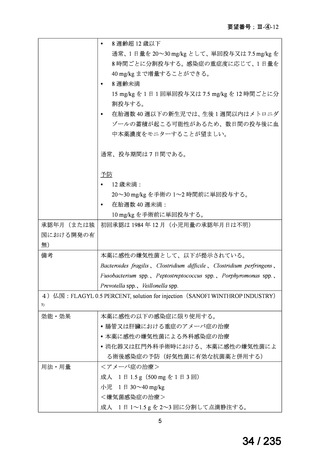
検討会議は以下のように考える。
小児を対象に実施された海外臨床試験等において認められた主な有害事象は、成人にお
いて認められた既知の事象であり、小児患者で特有のリスクは認められていない。また、
成人の嫌気性菌感染症等における本薬の薬物動態及び安全性に臨床上問題となるような国
内外差が認められていないこと(平成 26 年 5 月 14 日付けアネメトロ点滴静注液 500 mg 審
査報告書 参照)を踏まえると、成人に対する投与時と同様のリスク管理がなされるのであ
れば、日本人の小児患者における安全性は管理可能と考える。
(3)要望内容に係る公知申請の妥当性について
上記(1)及び(2)の内容、海外の承認状況、国内外の診療ガイドラインの記載内容等
を踏まえ、日本人小児における本薬注射剤の有効性は医学薬学上公知と判断可能であり、
安全性は許容可能と判断できることから、公知申請は可能と考える。
8.効能・効果及び用法・用量等の記載の妥当性について
(1)効能・効果について
効能・効果については、以下のとおりとすることが適当と検討会議は考える。その妥当
21
50 / 235