会議資料 (77 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
3)2017 GPOH Guidelines for Diagnosis and Treatment of Patients with Neuroblastic Tumors 23)
131
I-MIBG による治療は、再発又は難治性の神経芽腫患者に対して単独投与又は放射性増
感作用がある抗悪性腫瘍薬と併用投与することで有効性が示されている。最新の研究では、
初発の神経芽腫患者に対しても骨髄毒性は管理可能であることが示されている。導入化学
療法完了後に MIBG 集積陽性の残存病変がある高リスクの神経芽腫患者には、骨髄破壊的
な化学療法及び幹細胞移植の前に 131I-MIBG 治療が検討される。131I-MIBG の 1 回あたりの
投与量は 444 MBq/kg が推奨される。
4)Consensus Guidelines for the Management of Patients with Neuroendocrine Tumors [Date of
Publication: February 2015, Updated: July 2015 (v1.1)] SCONET (Scottish Neuroendocrine Tumor
Group) (英国)54)
131
I-MIBG は、I-MIBG 集積陽性の転移性褐色細胞腫/パラガングリオーマ/神経芽細胞腫
に対する第一選択薬である。
<日本におけるガイドライン等>
1)小児がん診療ガイドライン(2016 年版)/日本小児血液・がん学会 55)
131
I-MIBG 治療について、有効性は再発・難治例で示されているものの、初発例に対する有
効性は明らかでない旨が記載されている(推奨グレード 2C)
(5.(1)1)の公表論文等を引
用)。また、造血細胞の救援を行わない場合の 131I-MIBG の最大耐用量は 444 MBq/kg、
666 MBq/kg を投与する場合は、自家造血細胞移植等の併用が行われている旨が記載されて
いる。
2)神経内分泌腫瘍に対する 131I-MIBG 内照射療法の適正使用ガイドライン案-2014 年改訂
-/日本核医学会分科会 腫瘍・免疫核医学研究会 56)
適応:手術不可能な難治性神経芽腫
用量:神経芽腫では 444 MBq/kg(自家造血幹細胞がない場合)、666 MBq/kg(自家造血
幹細胞がある場合)が一般的である。
131
る
I-MIBG の単独投与及び化学療法との併用投与、並びに初発の高リスク神経芽腫におけ
131
I-MIBG 投与について、関連する公表論文がまとめられている。
6.本邦での開発状況(経緯)及び使用実態について
(1)要望内容に係る本邦での開発状況(経緯)等について
国内開発なし
(2)要望内容に係る本邦での臨床試験成績及び臨床使用実態について
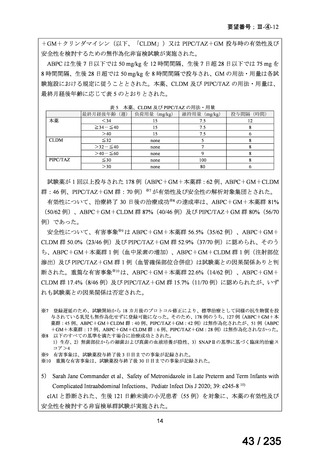
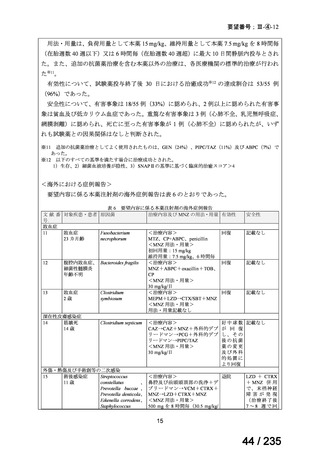
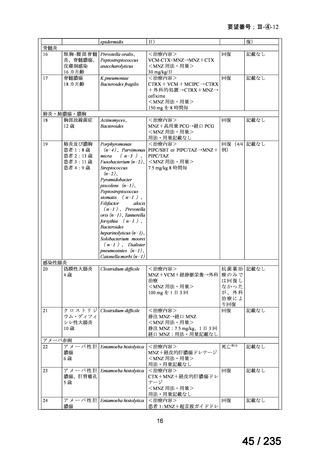
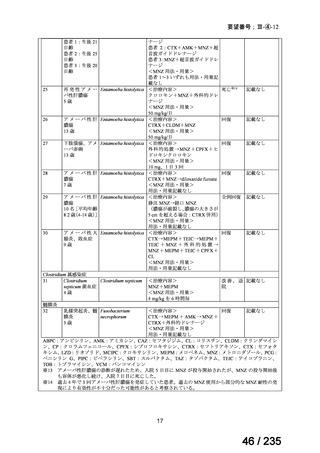
22
77 / 235