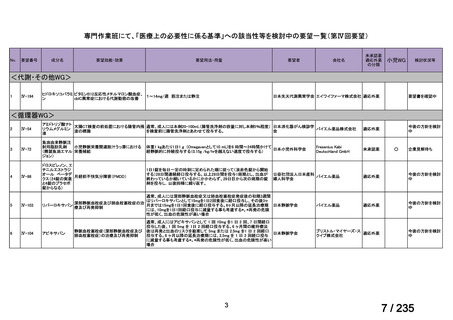
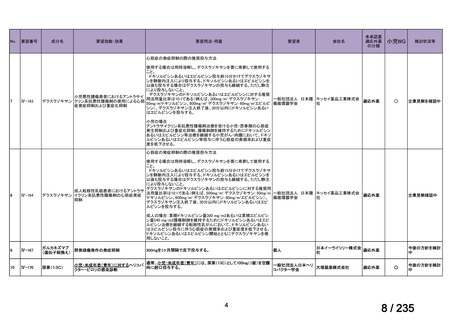
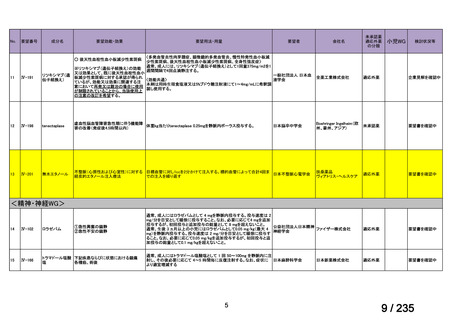
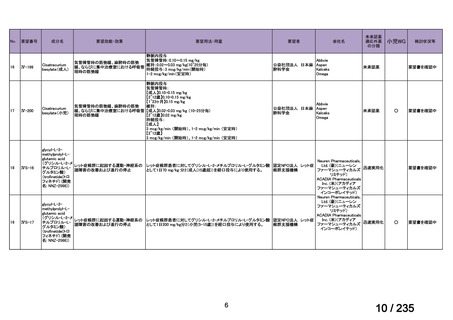
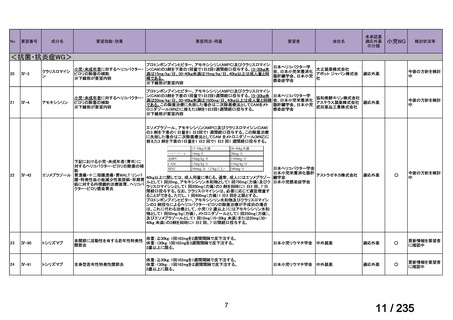
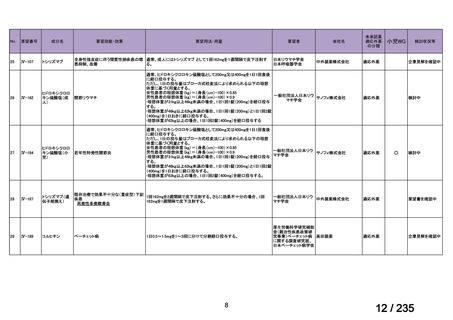
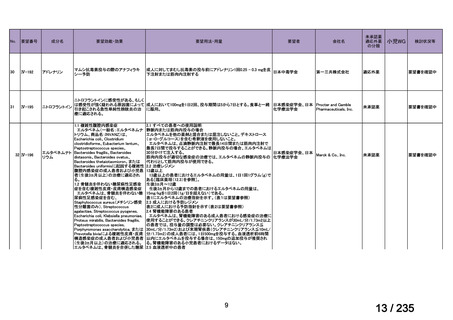
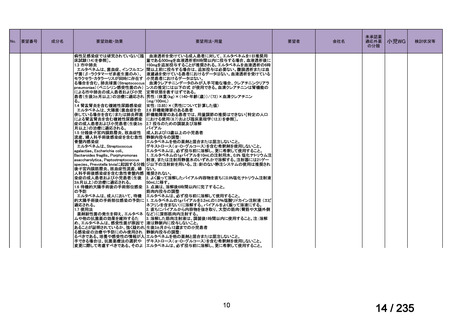
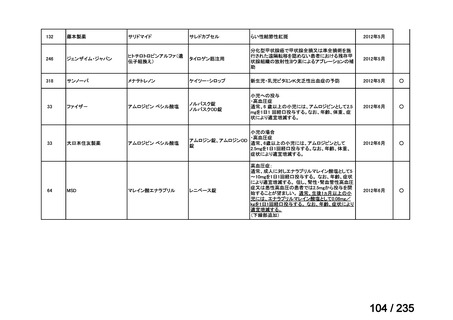
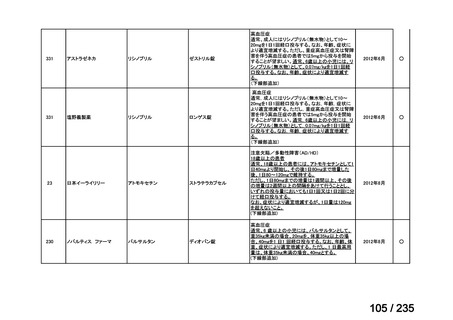
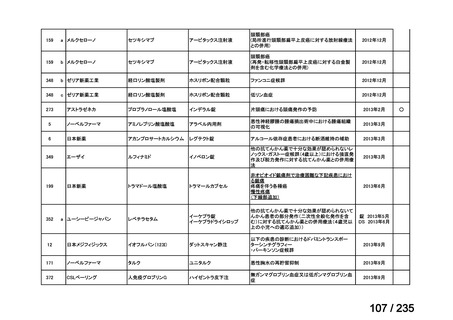
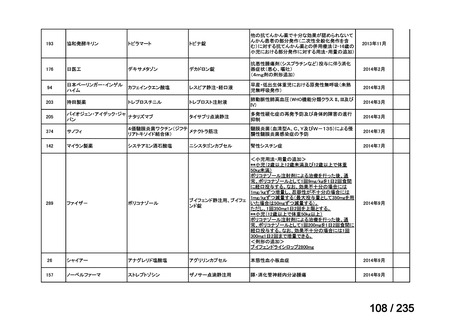
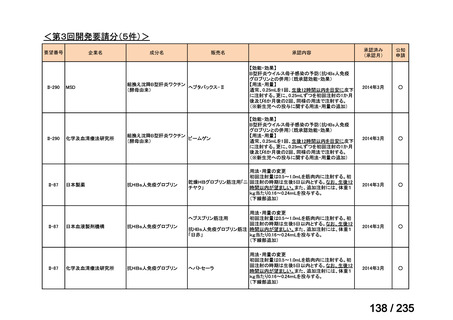
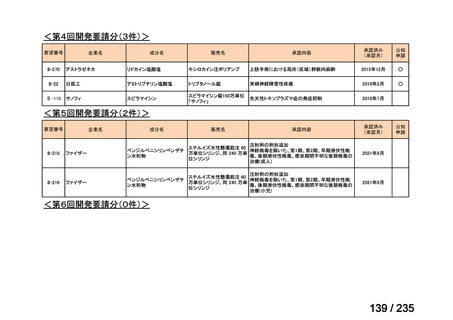
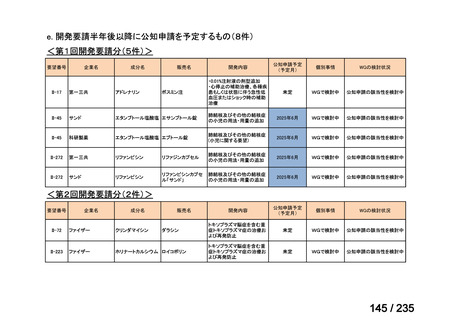
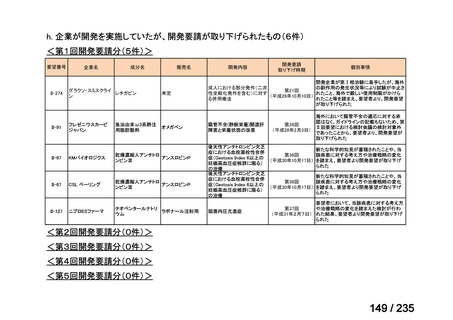
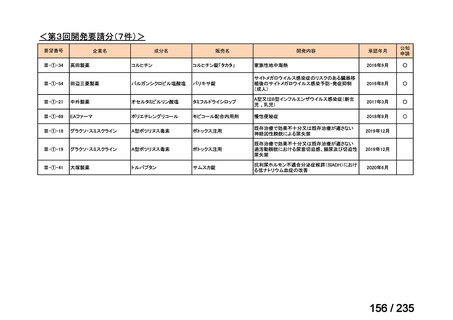
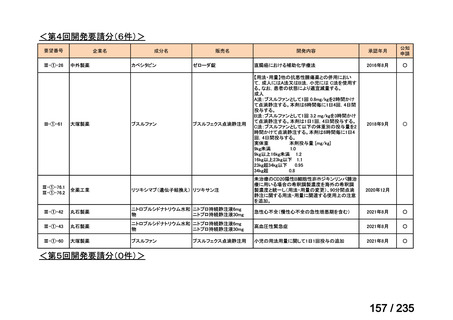
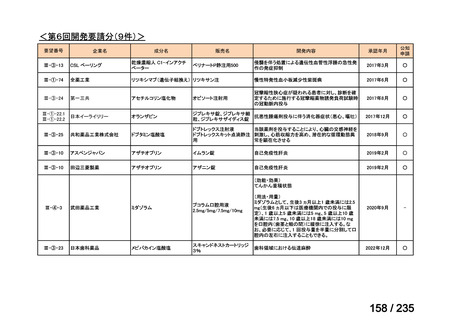
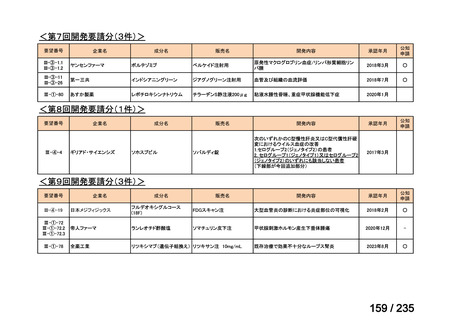
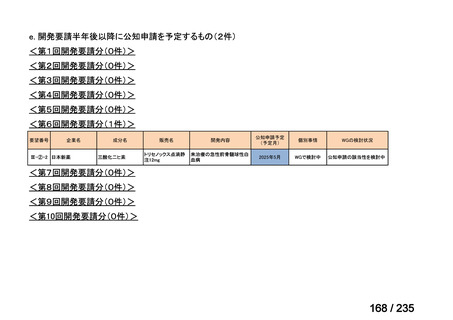
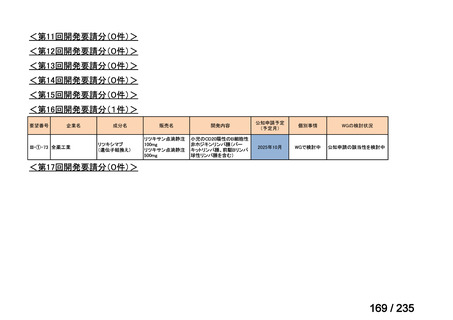
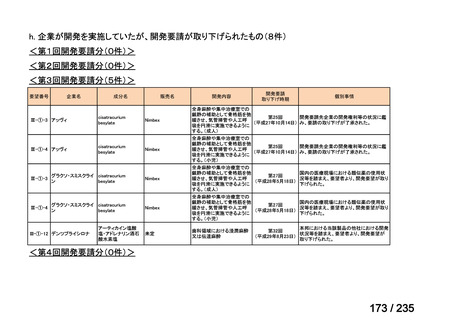
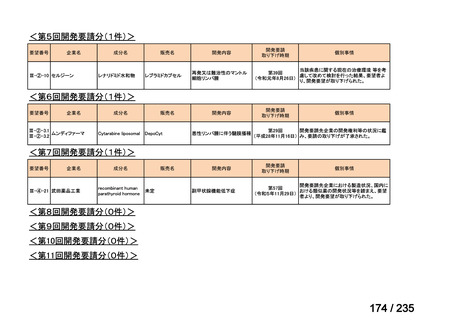
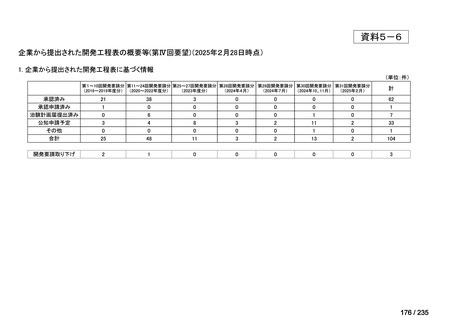
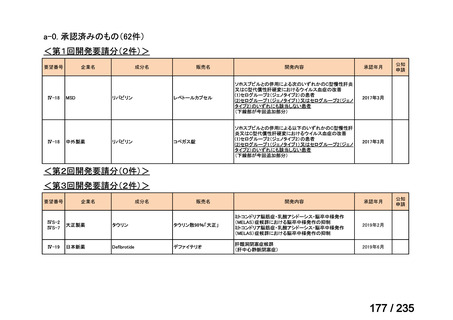
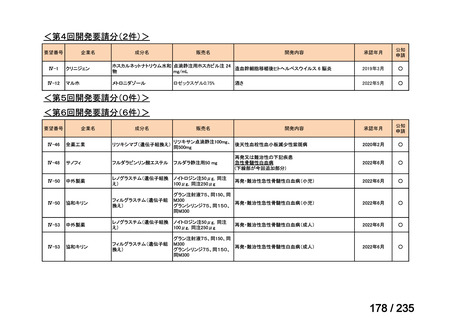
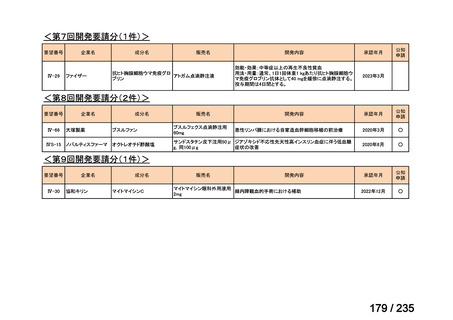
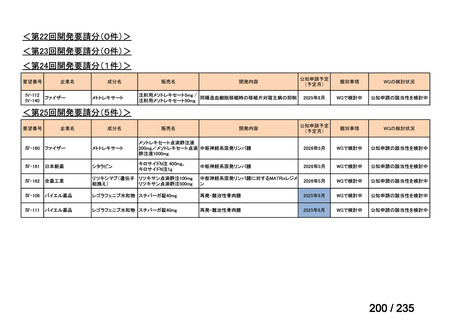
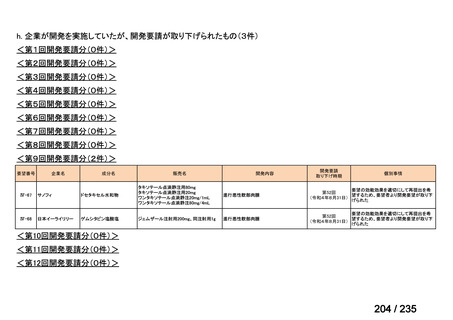
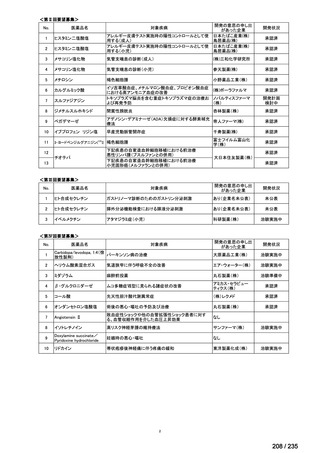
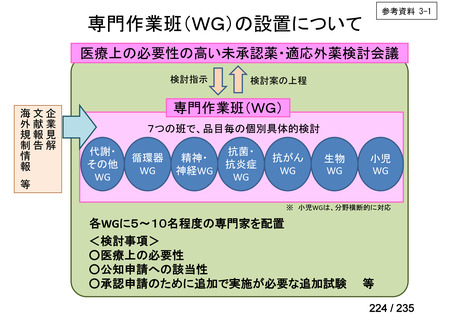
会議資料 (61 ページ)
出典
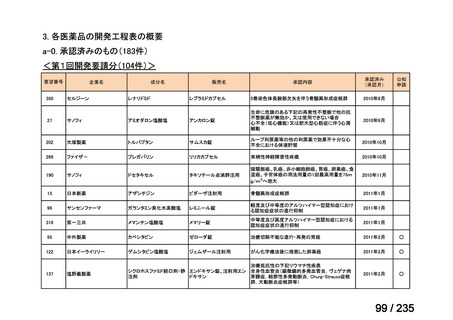
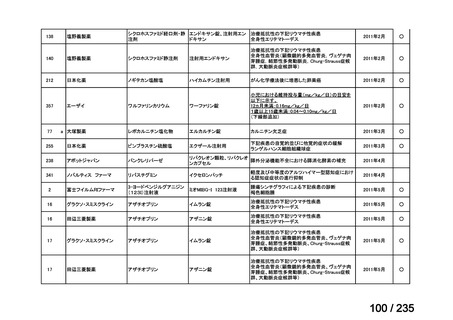
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(131I-MIBG). Eur J Cancer 2015; 51: 2465-72 14)
【131I-MIBG 233~773 MBq/kg を投与】
Yanik
GA,
et
131
al.:
I-metaiodobenzylguanidine
with
intensive
chemotherapy and autologous stem cell transplantation for high-risk
neuroblastoma. A new approaches to neuroblastoma therapy (NANT)
phase II study. Biol Blood Marrow Transplant 2015; 21: 673-81 15)
【131I-MIBG の投与量は、GFR が 60~99 mL/min/1.73 m2 の場合は
296 MBq/kg、≥ 100 mL/min/1.73 m2 の場合は 444 MBq/kg】
DuBois SG, et al.: Randomized Phase II Trial of MIBG Versus MIBG,
Vincristine, and Irinotecan Versus MIBG and Vorinostat for Patients With
Relapsed or Refractory Neuroblastoma: A Report From NANT
Consortium. J Clin Oncol 2021; 39: 3506-14 16)
【131I-MIBG 単独群、ビンクリスチン及びイリノテカン併用群、ボ
リノスタット併用群の 3 群を設定、131I-MIBG666 MBq/kg 投与 2 週
間後に自家幹細胞移植を実施】
Sevrin F, et al.: Phase II study of 131I-metaiodobenzylguanidine with 5
days of topotecan for refractory or relapsed neuroblastoma: Results of the
French study MIITOP. Pediatr Blood Cancer 2023; 70: e3061517)
備考
2)英国
ガイドライン名①
Children’s Cancer and Leukaemia Group (CCLG) Neuroblastoma Special
Interest Group. Options for the Treatment of Patients with
Relapsed/Progressive High-Risk Neuroblastoma (MARCH 2015) 18)
効能・効果
MIBG 集積陽性の再発又は進行性の高リスク神経芽腫
(または効能・効果に関
連のある記載箇所)
用法・用量
通常、2 週間間隔で 2 回投与する。通常、放射線増感剤としてトポテ
(または用法・用量に関
カンを併用し、この場合は自家幹細胞移植が必要となる。
連のある記載箇所)
具体的な投与量は示されていない。引用されている根拠論文におけ
る投与量は次のとおり:
Day 1 に 131I-MIBG 444 MBq/kg、Day 1~5 にトポテカンを投与し、こ
れを 1 コースとして Day 15 に 2 コース目を開始する(全身の耐容線
量は 2 コースで 4 Gy と設定)。Day 27 に自家幹細胞移植を併用する。
ガイドライン①の根
Gaze MN, et al. Feasibility of dosimetry-based high-dose 131I-meta-
拠論文
iodobenzylguanidine with topotecan as a radiosensitizer in children with
metastatic neuroblastoma. Cancer Biother Radiopharm 2005; 20: 195-9
6
61 / 235