会議資料 (58 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
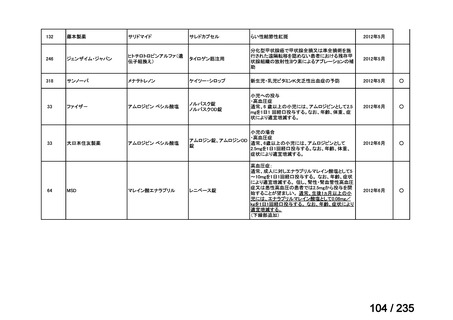
要がある。
6~8 カ月間間隔での繰り返し投与が検討可能である。用量制限因
子は骨髄毒性であり、累積 29.6 GBq までの投与が報告されてい
る。
承認年月(または英 1997 年 2 月 14 日
国における開発の有
無)
備考
要望された医薬品(販売名:ライアット MIBG-I131 静注)の承認は
ないため、他の 131I-MIBG 製剤の承認状況について記載した。
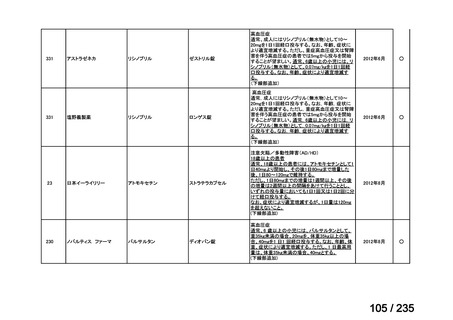
3)独国 3)
GE Healthcare MIBG-131 zur Therapie 185-493,3 MBq/ml Konzentrat zur Herstellung einer
Infusionslösung(GE Healthcare Buchler GmbH & Co. KG)
効能・効果
英国と同じ
用法・用量
英国と同じ
承認年月(または独 1997 年 4 月 25 日
国における開発の有
無)
備考
英国と同じ
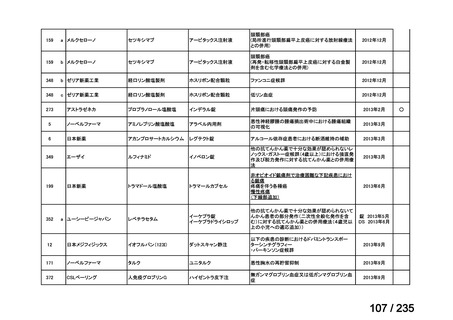
4)仏国 4)
Iobenguane (131I) for therapy CIS bio international 370 MBq/mL solution for injection(CIS bio
international)
効能・効果
英国と同じ
用法・用量
英国と同じ*
*:未熟児又は新生児に投与しない旨の注意喚起は記載されていない。
承認年月(または仏 1997 年 7 月 24 日
国における開発の有
無)
備考
英国と同じ
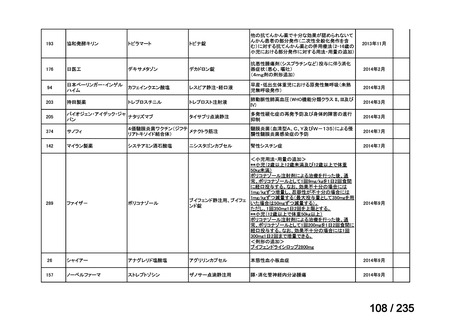
5)加国
効能・効果
該当なし
用法・用量
-
承認年月(または加 開発の有無:不明
国における開発の有
無)
備考
-
6)豪州
3
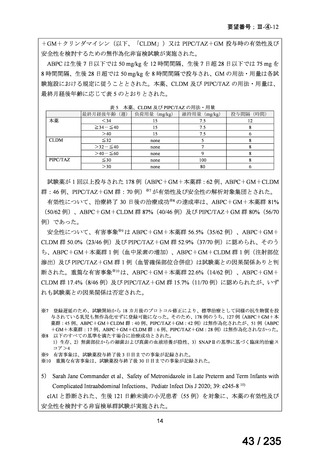
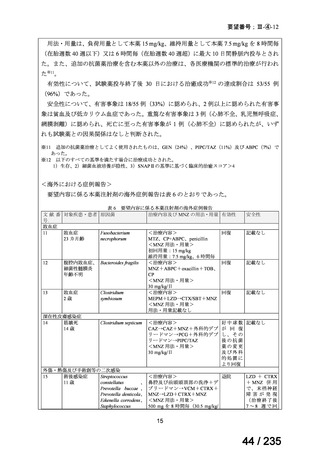
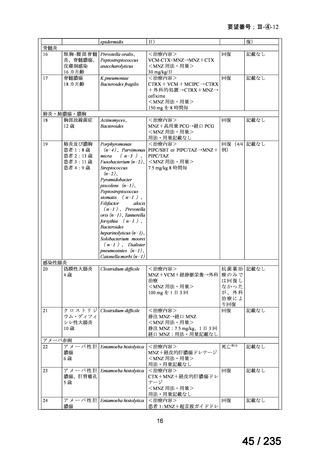
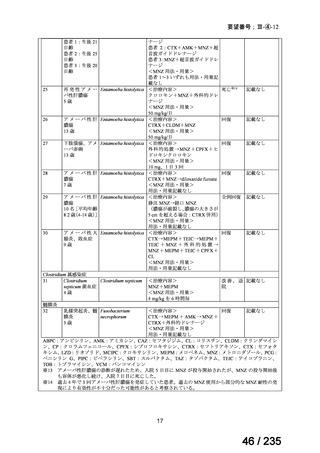
58 / 235