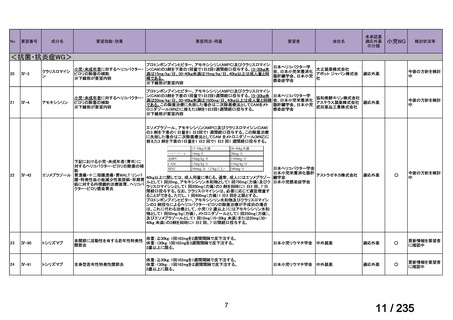
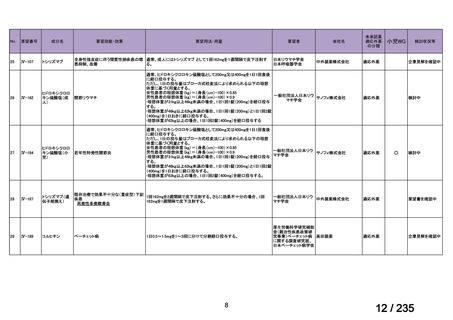
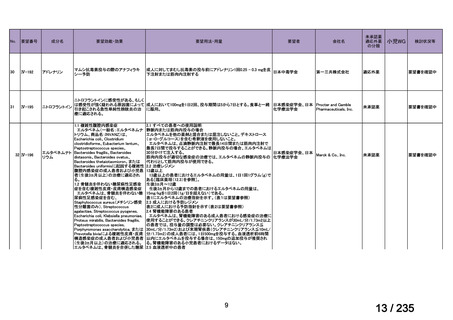
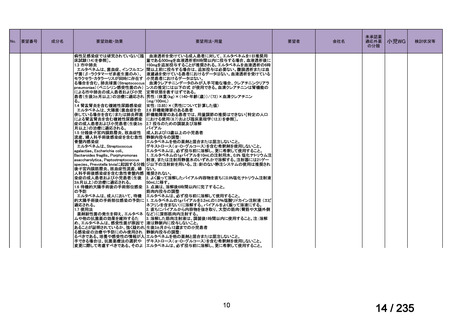
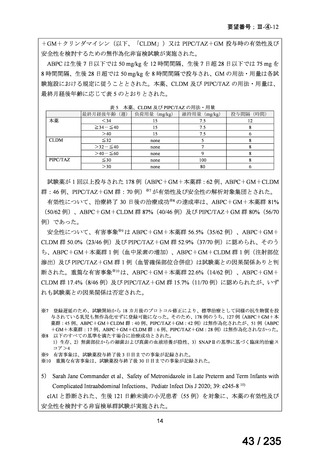
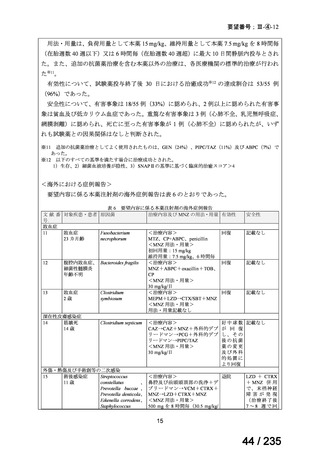
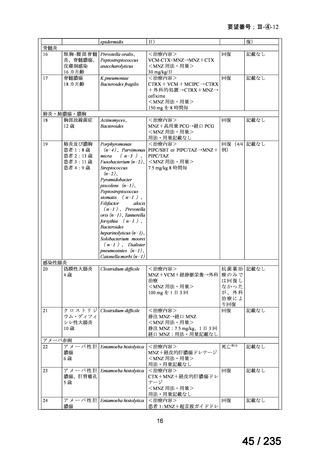
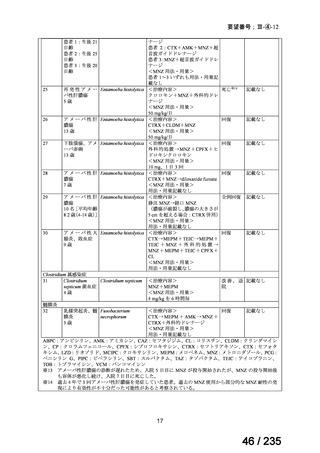
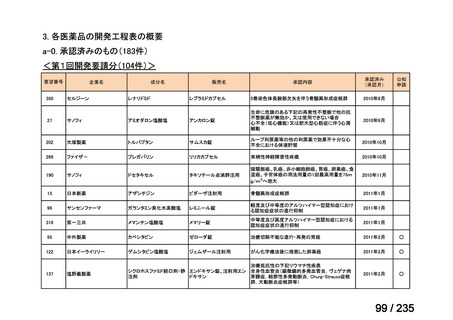
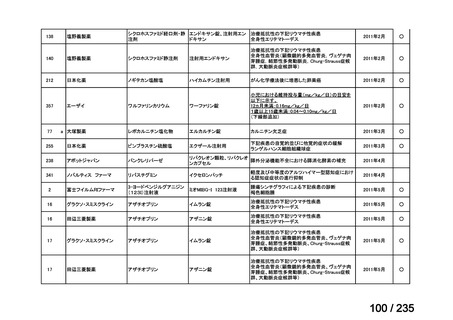
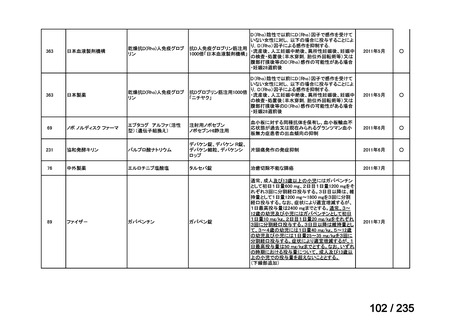
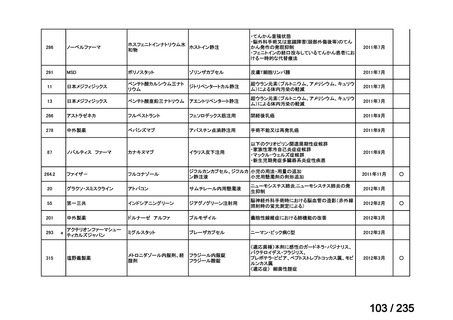
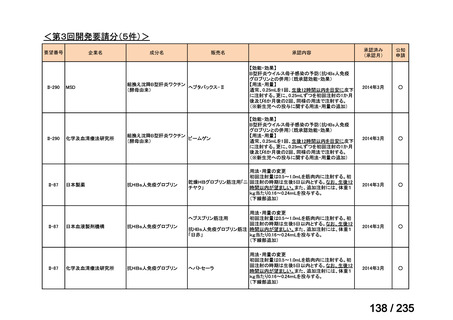
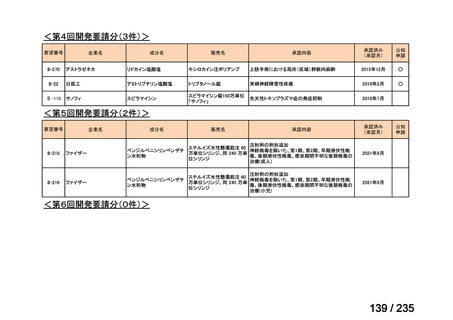
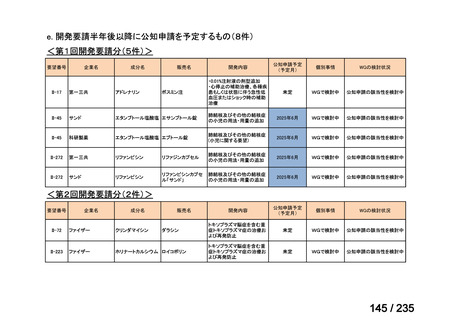
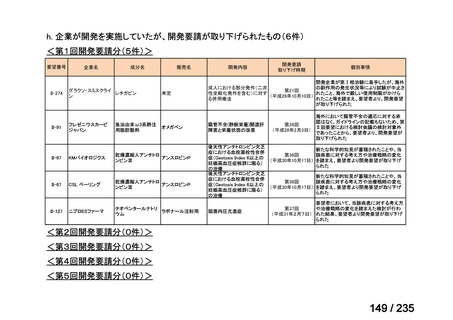
会議資料 (78 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
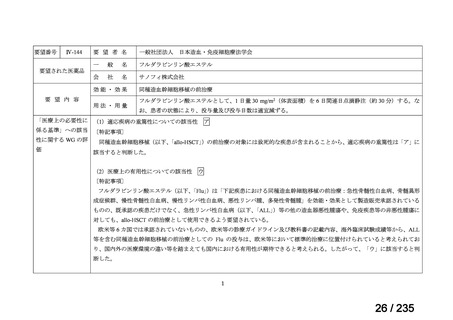
1)化学療法抵抗性神経芽腫に対する I-131 metaiodobenzylguanidine(MIBG)を用いた内照
射療法(jRCTs041180041)57)
MIBG 集積陽性の難治性神経芽腫患者 63 例(1~21 歳)を対象として、131I-MIBG の有効
性及び安全性を検討することを目的とした第Ⅱ相試験が先進医療 B の特定臨床研究として
実施された。
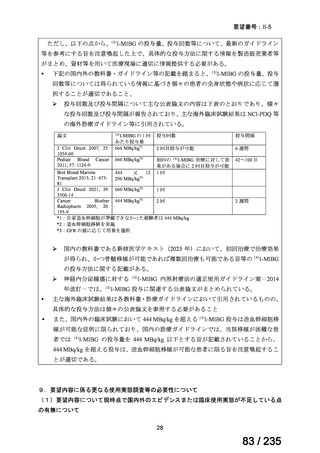
用法・用量について、131I-MIBG 111~666 MBq/kg が 1~3 回投与された。21/63 例で自家
移植、21/63 例で同種移植が実施された1。
有効性について、主要評価項目である RECIST に基づく奏効率は 39.7%(25/63 例)であ
った。
安全性について、26 例が死亡に至り、死因は原疾患の増悪 20 例、緑膿菌感染症 1 例、ア
スペルギルス肺炎 1 例、呼吸器不全 2 例、腎不全 1 例、骨髄移植関連合併症 1 例であった。
早期(放射線管理区域退出まで)に認められた有害事象(治療開始前からの骨機能低下を
除く)は、いずれも Grade 2 以下の事象であった。
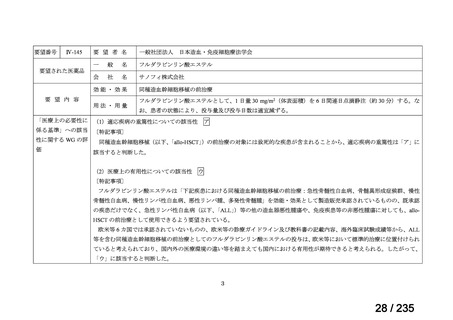
131
I-MIBG の投与量について関連学会(日本核医学会及び日本小児血液・がん学会)より、
以下の旨が説明されている。
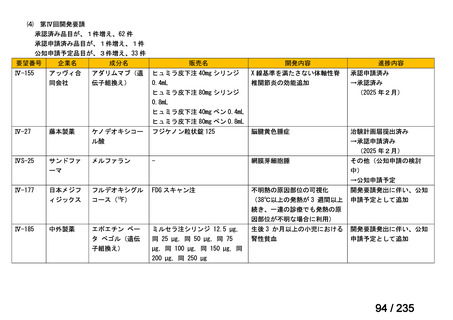
5.(1)の<国内臨床試験>に記載された先進医療 B の特定臨床研究(jRCTs041180030)
では、7/8 例で 7.4 GBq を超える 131I-MIBG が投与され、最大投与量は 18.37 GBq であ
った。安全性について、大量化学療法及び造血幹細胞移植との併用において、治療関連
死亡はなく、全例で生着が確認された。生着時期は海外の報告と類似しており、治療中
の有害事象としては嘔吐(85.7%)、倦怠感(71.4%)、悪心(71.4%)
、腹痛(57.1%)、
発熱腹痛(71.4%)、下痢(42.9%)、発熱性好中球減少症(42.9%)が報告されている。
これらの有害事象は、131I-MIBG 治療を併用しない大量化学療法及び造血幹細胞移植で
も認められる合併症であり頻度・重症度ともに既存の報告と差は認められなかった。
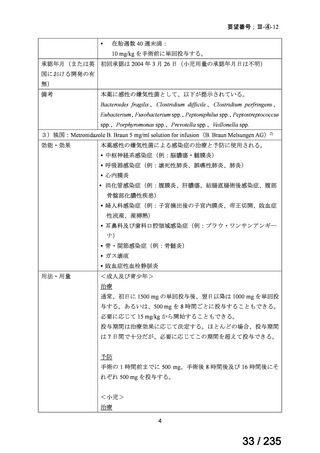
6.(2)1)の先進医療 B の特定臨床研究(jRCTs041180041)では、56/63 例で 7.4 GBq
を超える 131I-MIBG が投与され、最大投与量は 24.42 GBq であった。7.4 GBq を超える
投与を受けた患者 56 例のうち、経過観察期間中に 23 例が死亡に至り、死因は、原疾
患の増悪 18 例、継続治療の合併症 5 例であった。いずれも、試験薬との因果関係は否
定された。131I-MIBG 投与後 3 カ月以内に認められた初発・再発患者別の骨髄機能低下
に関連する有害事象は、貧血(初発患者:Grade 3 が 3 例(15.8%)、Grade 4 が 1 例
(5.3%)、再発患者:Grade 3 が 7 例(18.9%)、Grade 4 が 1 例(2.7%))、白血球減少(初
発患者:Grade 3 が 5 例(26.3%)
、Grade 4 が 5 例(26.3%)
、再発患者:Grade 3 が 8 例
(21.6%)、Grade 4 が 9 例(24.3%)
)及び血小板減少(初発患者:Grade 3 が 1 例(5.3%)、
Grade 4 が 5 例(26.3%)
、再発患者:Grade 3 が 5 例(13.5%)
、Grade 4 が 9 例(24.3%))
であった。
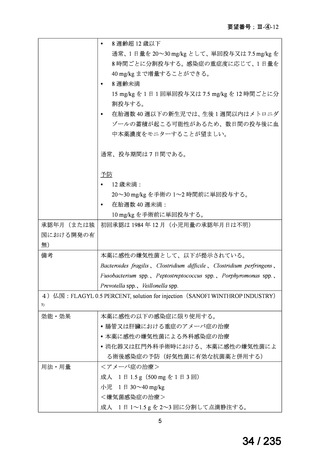
1 131
I-MIBG 治療後に自家移植 21 例、同種移植 21 例、放射線外照射 24 例及び/又は 13-cis-レチノイン酸 11 例が
実施された(重複を含む)
。
23
78 / 235