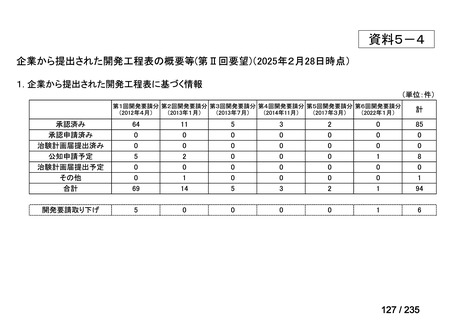
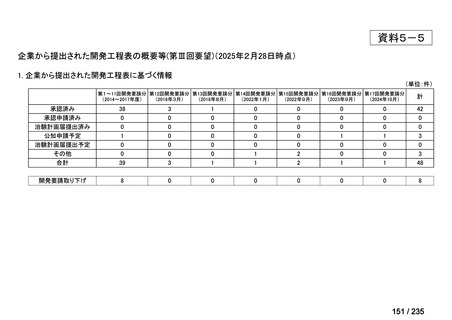
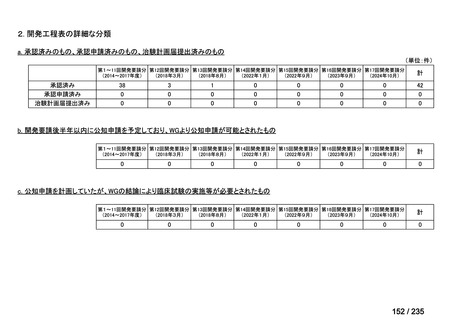
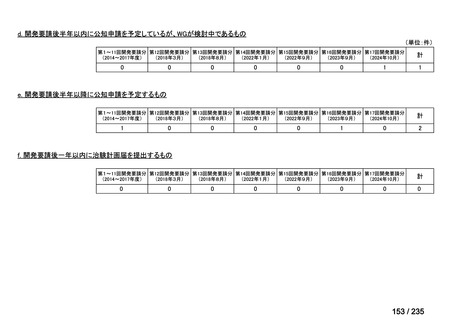
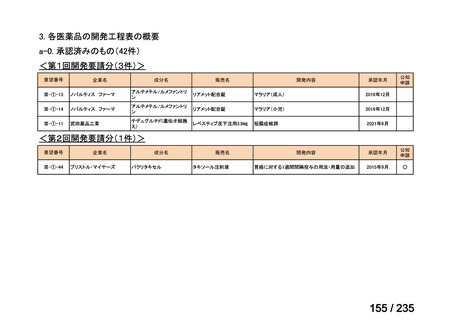
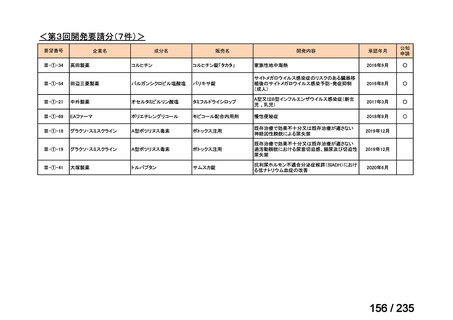
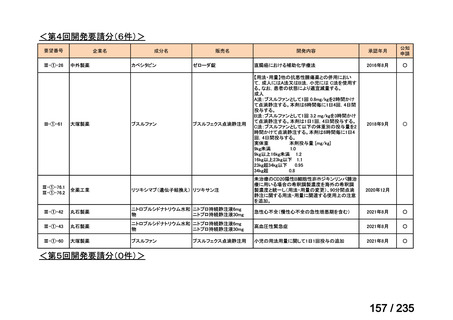
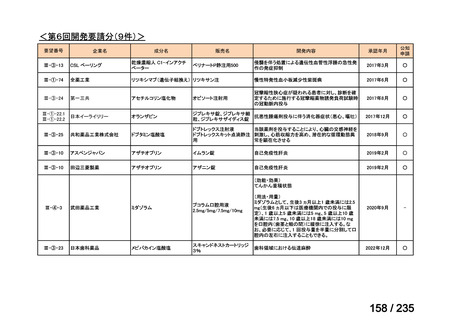
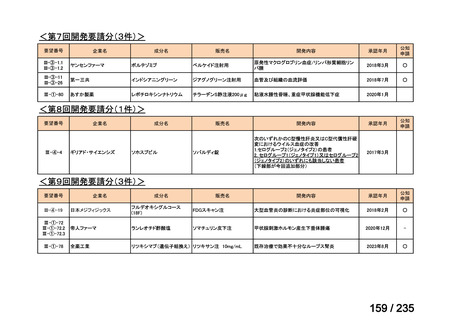
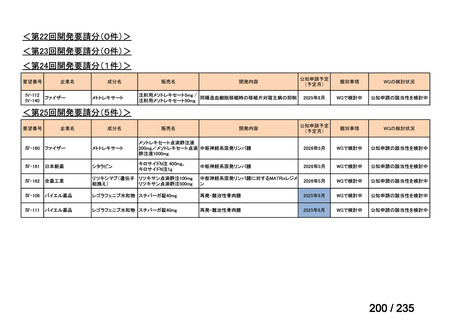
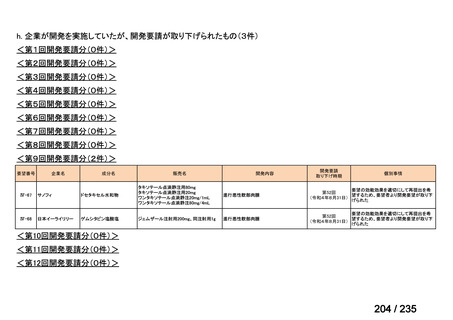
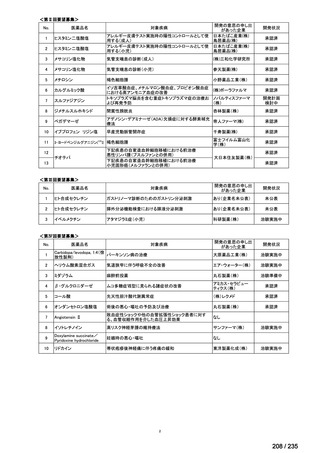
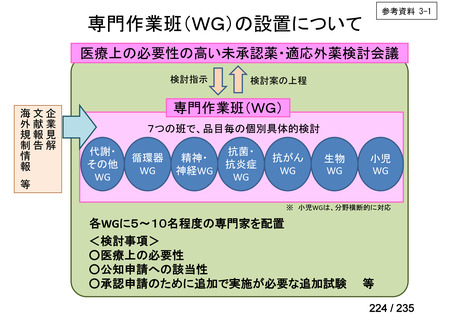
会議資料 (70 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
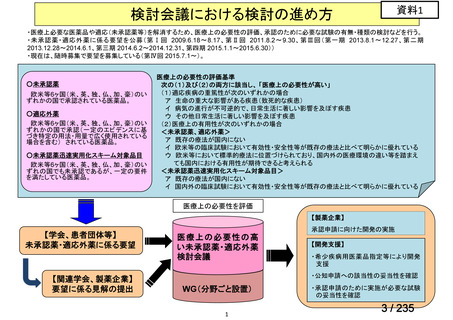
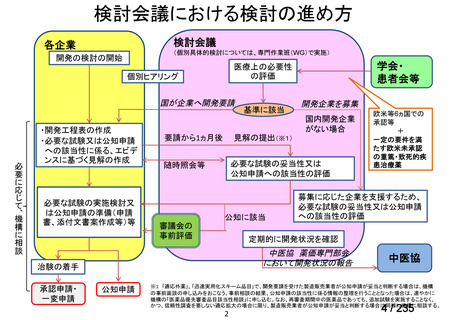
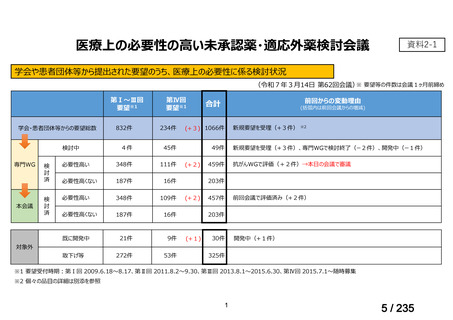
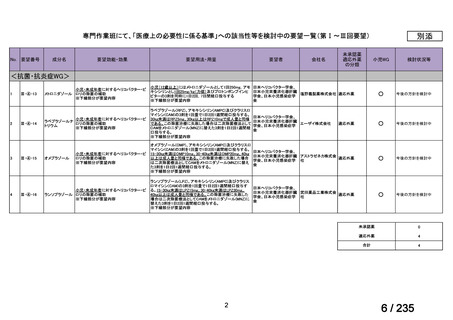
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
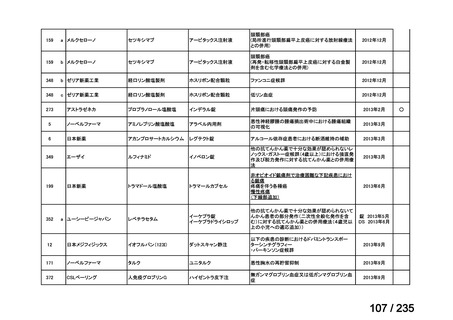
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
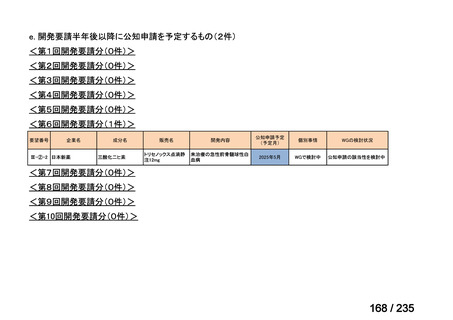
再発又は進行した高リスク神経芽腫患者 32 例(2~30 歳)を対象に、ビンクリスチン及
びイリノテカンを併用した 131I-MIBG 治療の有効性及び安全性を評価することを目的とし
た第Ⅰ/Ⅱ相試験が実施された。
用法・用量について、Day 1 に 131I-MIBG 555 又は 666 MBq/kg(最大 44,400 MBq)が 90
~120 分かけて静脈内投与された。また、Day 0 にビンクリスチン(2 mg/m2、急速静脈内投
与)、Day 0~4 にイリノテカン(50 mg/m2、静脈内投与)が投与され、Day 13 に末梢血幹細
胞移植が実施された。初回の治療で治療効果が少なくとも SD で用量制限毒性(以下、
「DLT」)の発現がない場合には、初回投与から少なくとも 42 日あけて第 2 コースが開始
された。
有効性について、NANT response criteria に基づく奏効率は、555 MBq/kg 投与群で 50%(3/6
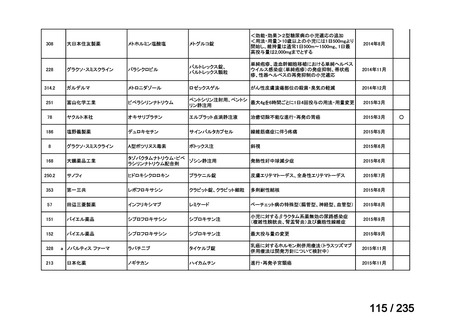
例)、666 MBq/kg 投与群で 23%(6/26 例)であった。
安全性について、第Ⅰ相パートの対象となった 555 MBq/kg 投与群及び 666 MBq/kg 投与群
の各 6 例の患者において DLT は認められなかった。そのため、第Ⅱ相パートでは 20 例の患
者に 131I-MIBG 666 MBq/kg が投与された。血液毒性について、Grade 4 の好中球減少が
555 MBq/kg 投与群で 83%、666 MBq/kg 投与群で 81%に認められ(以下同順)、Grade 4 の
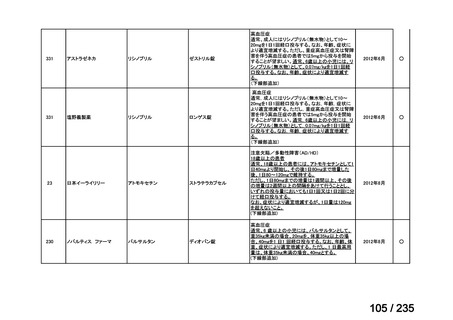
血小板減少は 17%及び 58%に認められた。666 MBq/kg が投与された 1 例で初回治療の 10.5
カ月後に MDS が発現し、AML となった。非血液毒性について、Grade 4 又は 5 の事象は認
められず、555 MBq/kg 投与群では、Grade 3 の事象も認められなかった。666 MBq/kg 投与
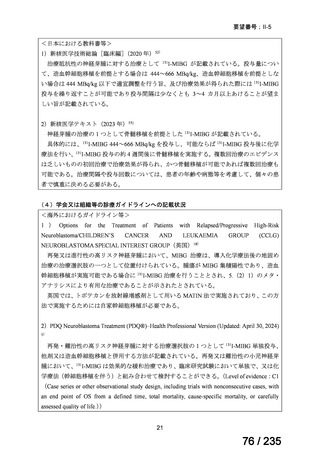
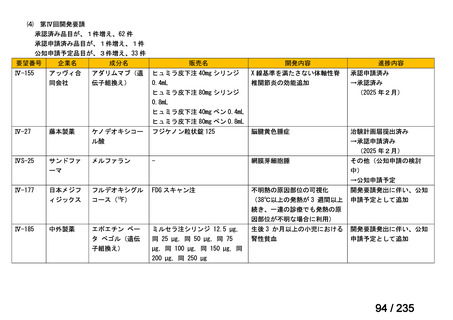
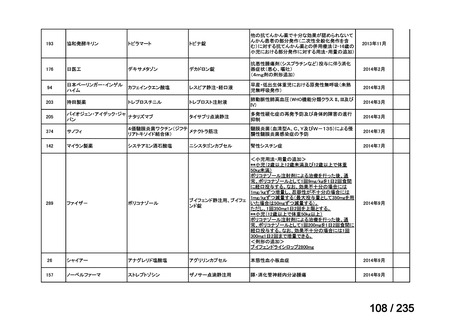
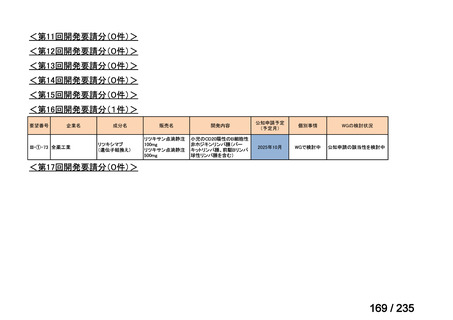
群における Grade 3 の非血液毒性の発現状況は、下表のとおりであった。
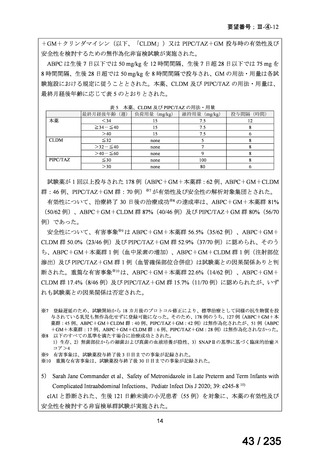
有害事象
発現割合(%)
11
8
8
8
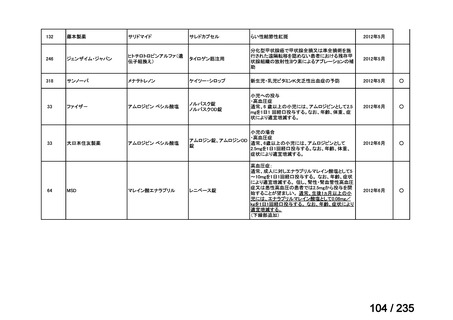
8
4
4
4
嘔吐
脱水
下痢
低ナトリウム血症
血清アミラーゼ増加
無食欲
低カリウム血症
悪心
7)Lee JW, et al. Incorporation of high-dose (131)I-metaiodobenzylguanidine treatment into tandem
high-dose chemotherapy and autologous stem cell transplantation for high-risk neuroblastoma: results
of the SMC NB-2009 study. J Hematol Oncol 2017; 10:108 33)
初発の MIBG 集積陽性の高リスク神経芽腫患者 54 例(生後 1 カ月~19 歳 3 カ月)を対
象に、導入化学療法後の大量化学療法及び自家幹細胞移植に 131I-MIBG を組み合わせた際
の安全性及び有効性を検討することを目的とした前向き試験が実施された。
用法・用量について、カルボプラチン、エトポシド及びシクロホスファミドによる大量
化学療法の後、自家幹細胞移植実施日を Day0 として、Day-21 に 131I-MIBG 666 MBq/kg、
Day -6~-4 にチオテパ 200 mg/m2/day、Day -3 及び-2 にメルファラン 60 mg/m2/day を
15
70 / 235