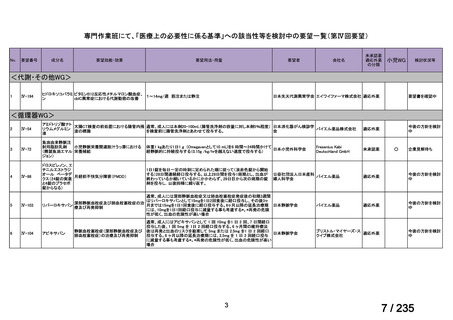
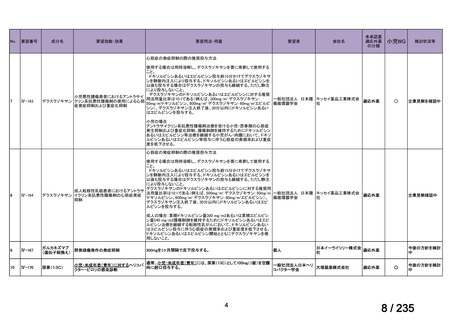
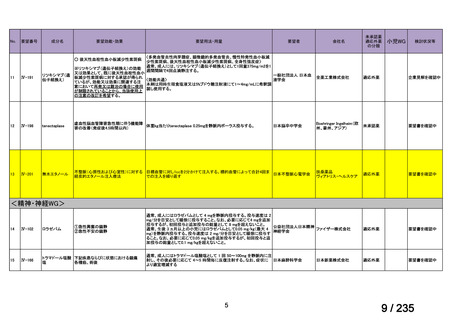
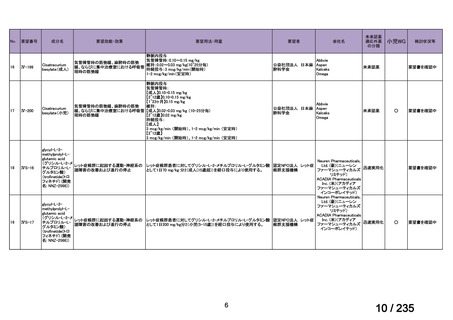
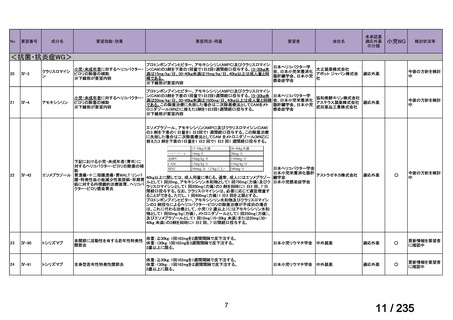
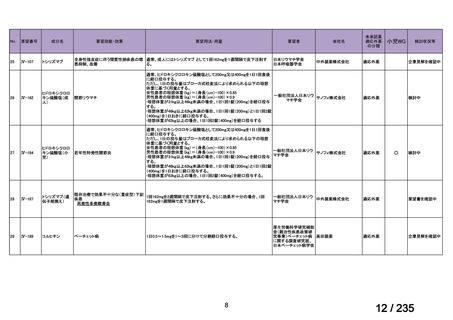
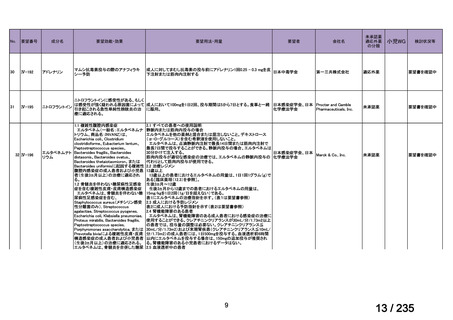
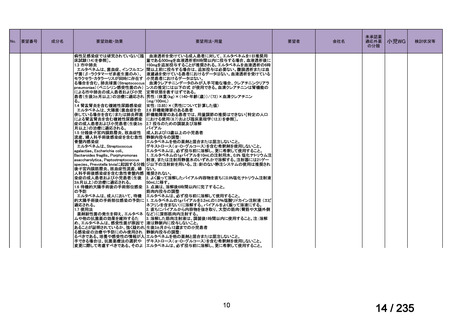
会議資料 (75 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(3)教科書等への標準的治療としての記載状況
<海外における教科書等>
1)Pizzo & Poplack’s Pediatric Oncology(8th Edition, 2021)47)
131
I-MIBG は再発又は難治性の神経芽腫に対する治療に用いられてきた旨(5.(1)1)の
公表論文等を引用)、欧州の臨床試験では初発治療として用いられている旨(5.(1)8)の
公表論文等を引用)、及び投与量が 444 MBq/kg を超える場合は自家血幹細胞移植が必要で
ある旨が記載されている。また、COG 及び European consortia は初発の患者を対象とした
131
I-MIBG の臨床試験(NCT03126916)を開始した旨が記載されている。
2)Neuroblastoma. Clinical and Surgical Management (2020)48)
5.(1)1)の公表論文を引用し、再発神経芽腫に対する 131I-MIBG は、単施設又は NANT
コンソーシアムによる試験で、単剤又は他剤との併用で 30%~40%の奏効率を示しており、
古くから有効な治療法として存在している旨が記載されている。また、ANBL1531 試験
(NCT03126916)の実施について記載されている。
3)NEUROBLASTOMA Molecular Mechanisms and Therapeutic Interventions(2019)49)
131
I-MIBG 単独投与について、再発神経芽腫患者に最大耐容量である 666 MBq/kg を投与
したときの奏効率(CR+PR)は 30%であった(5.(1)1)の公表論文等を引用)
。また、第
Ⅰ相試験において、555 MBq/kg 以上を投与した際に重度の血液毒性が認められた。そのた
め、治療効果を得るためには、自家幹細胞移植が必要となる。131I-MIBG とカルボプラチン、
エトポシド及びメルファランの投与並びに幹細胞移植と組み合わることは比較的安全であ
り、444 MBq/kg の用量で忍容可能であることが明らかになっている。しかしながら、再発
又は進行性の患者 50 例が登録された第Ⅱ相試験において、奏効率が 10%(4/41 例)と低か
った。導入化学療法後に PR となった患者に対して 131I-MIBG 治療を実施した際により高い
奏効率(38%(3/8 例)
)が得られた。そのため、131I-MIBG 治療は今後開始する COG の初
発の高リスク神経芽腫に対して有効性を検証する第Ⅲ相臨床試験(NCT03126916)に組み
込まれることとなった。
4)UpToDate(2024)50)
COG による ANBL1531 試験(NCT03126916)の実施について記載されている(試験の実
施根拠として 5.(1)8)の公表論文を引用)
。
131
I-MIBG は再発神経芽腫に有効である旨が記載されている(5.(1)3)及び(2)1)の
公表論文を引用)
。
5)RUDOLPH’S PEDIATRICS(21st Edition,2003)51)
神経芽腫における放射線治療の 1 つとして 131I-MIBG に言及されている。
20
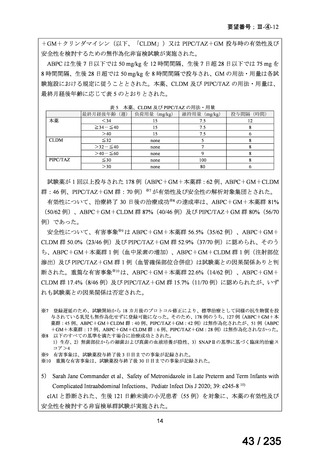
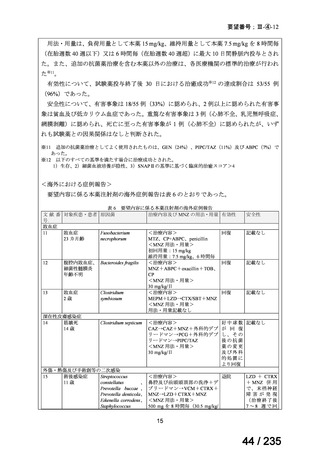
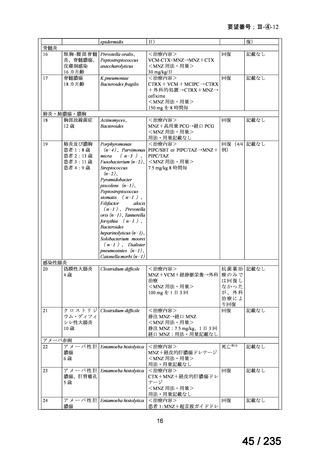
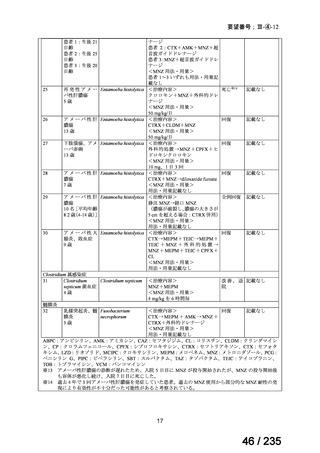
75 / 235