会議資料 (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
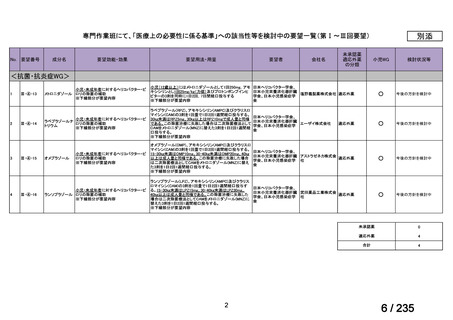
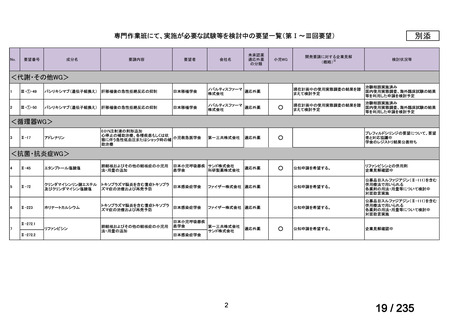
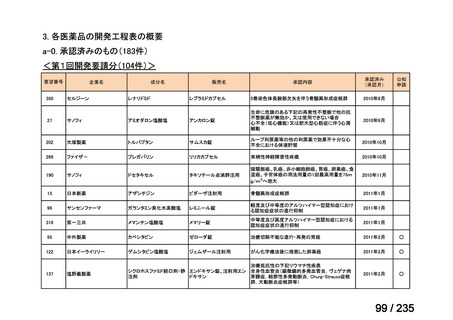
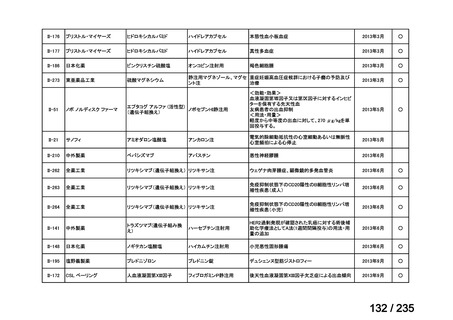
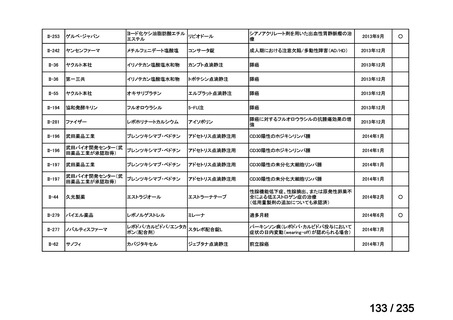
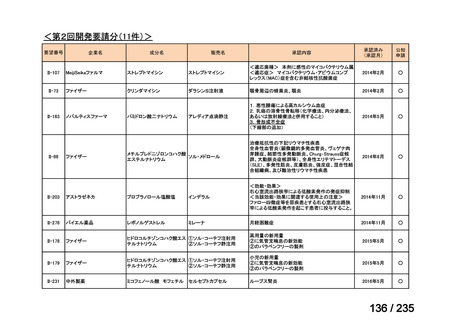
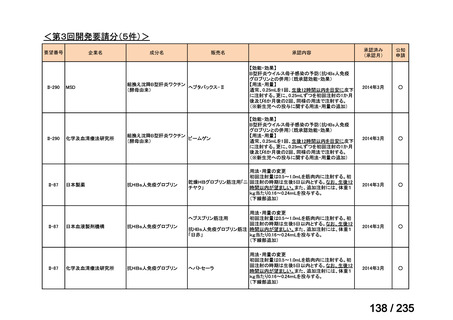
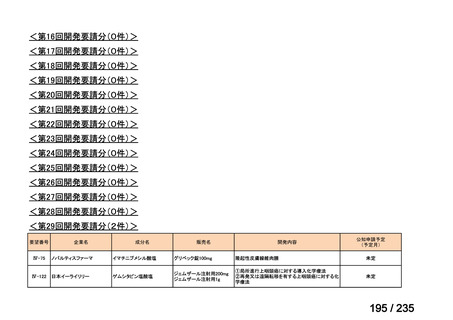
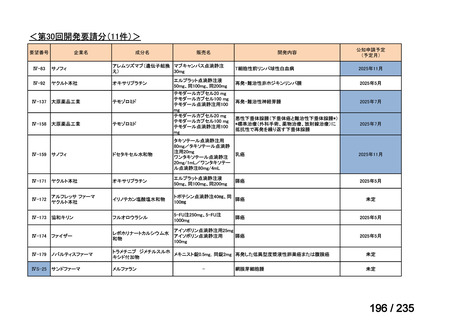
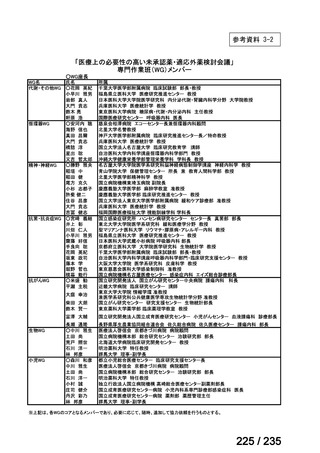
要望番号
成分名
要請内容
要望者
会社名
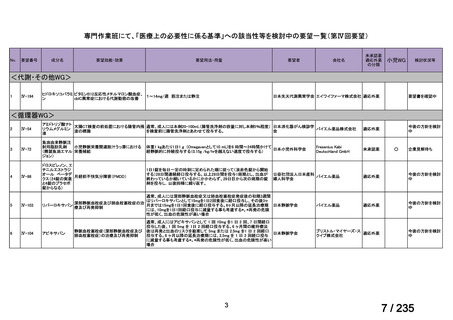
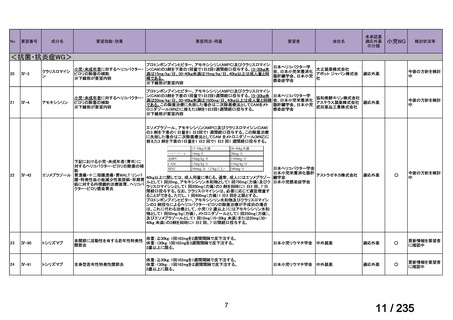
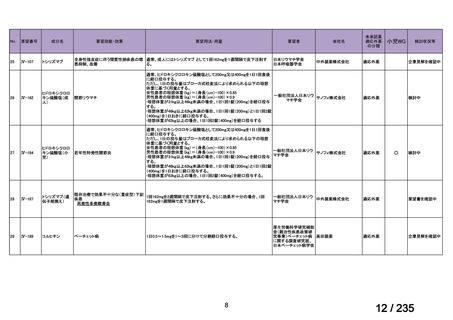
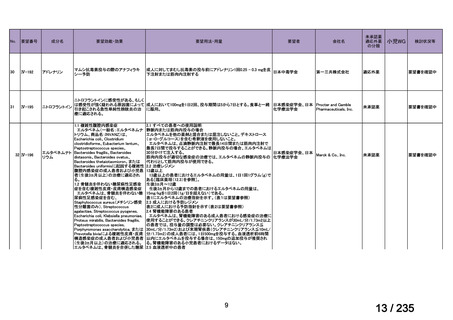
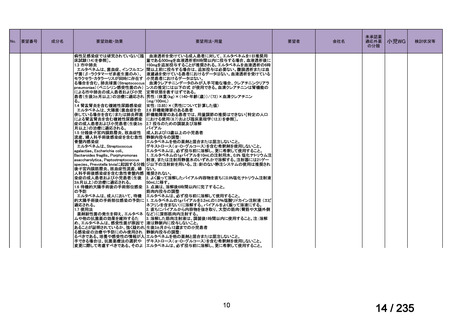
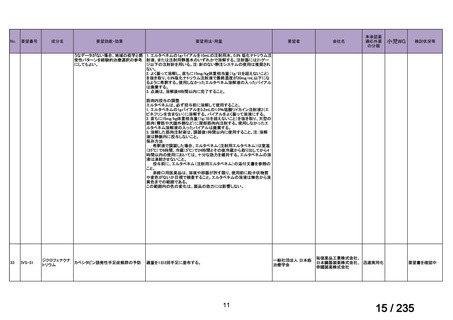
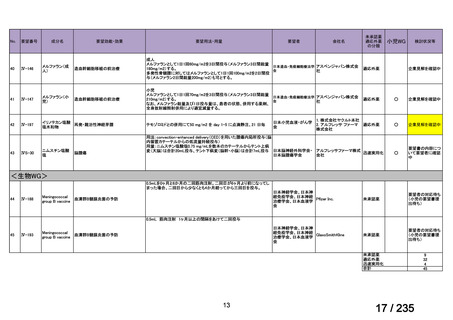
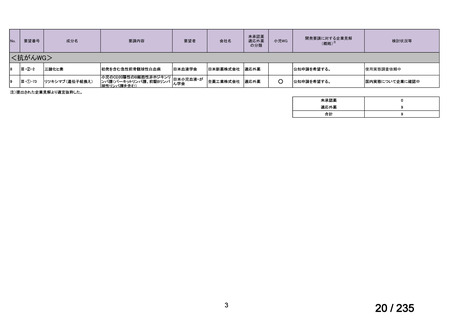
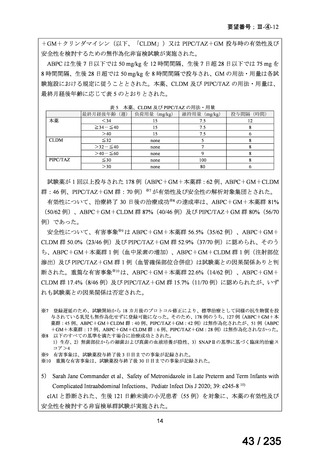
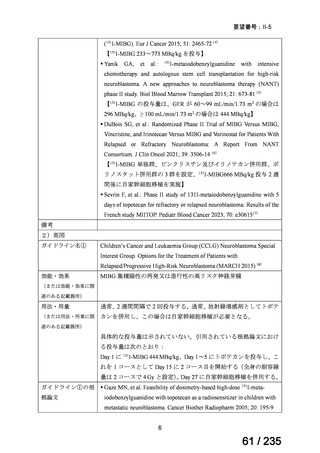
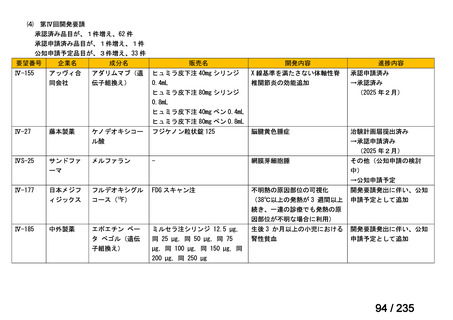
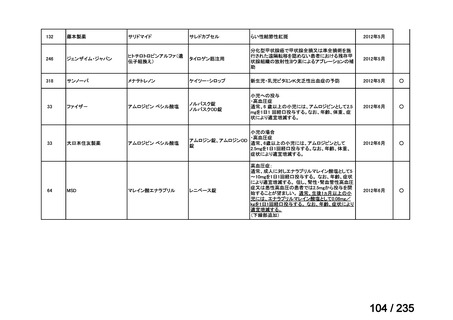
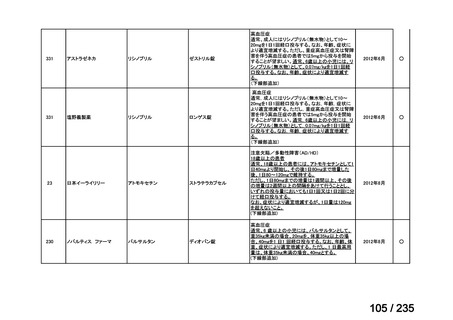
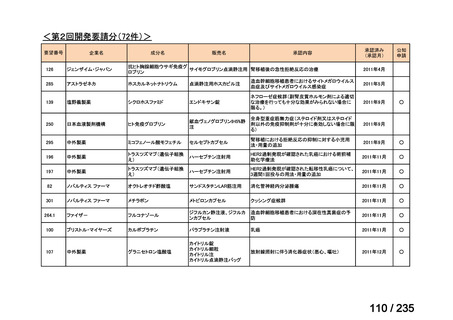
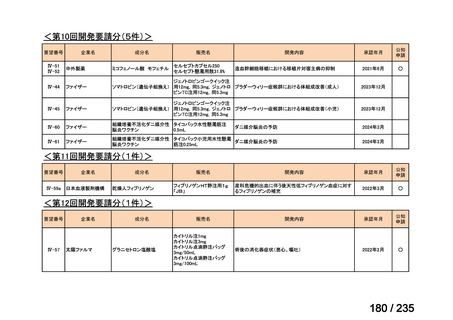
33
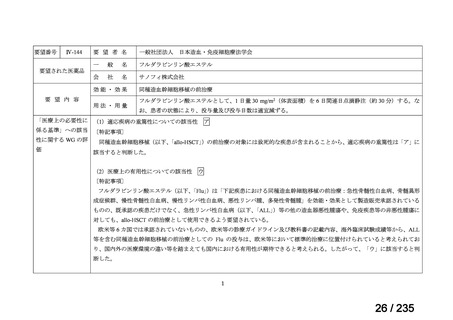
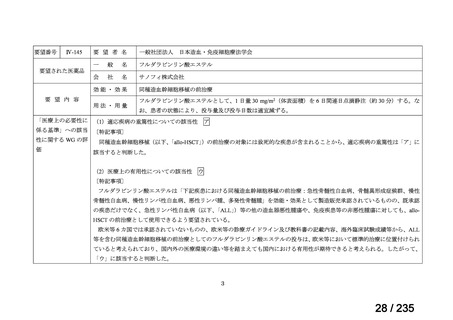
Ⅳ-183
再発又は難治性病変に対する治療後に疾患
Naxitamab-gqgk[Naxitamab, ナキシ
進行を認めないものの骨及び/又は骨髄に 神経芽腫の会
タマブ]
病変の残存した高リスク神経芽腫
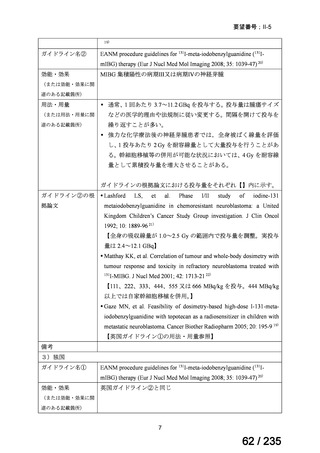
34
Ⅳ-190
ペムブロリズマブ(遺伝子組換
え)
がん化学療法後に増悪した絨毛性腫瘍
(絨毛癌*、PSTT、ETT)
*
臨床的絨毛癌、high-risk GTN を含む
日本産科婦人科学
会/日本婦人科腫
MSD株式会社
瘍学会/日本絨毛
性疾患研究会
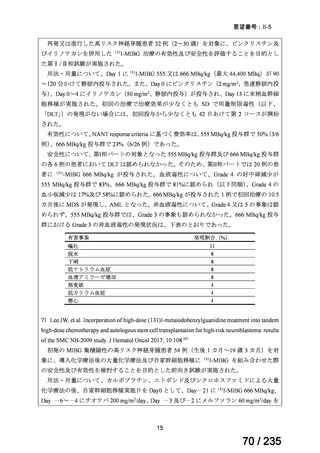
35
ⅣS-25
メルファラン
網膜芽細胞腫
小児血液・がん学
会
ノーベルファーマ株
式会社
サンドファーマ株式
会社
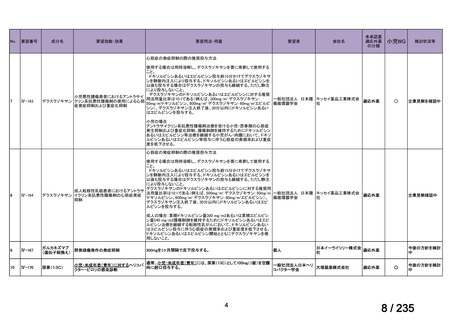
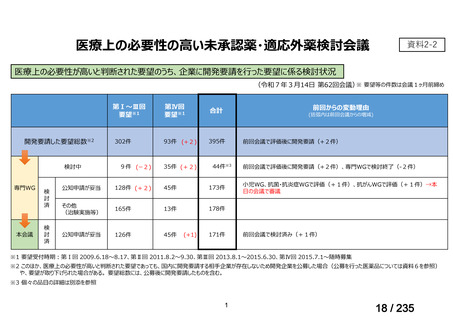
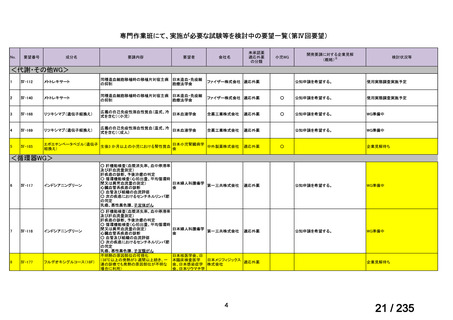
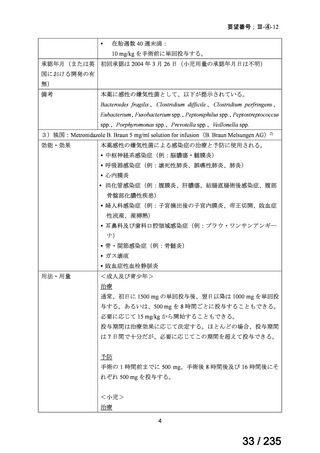
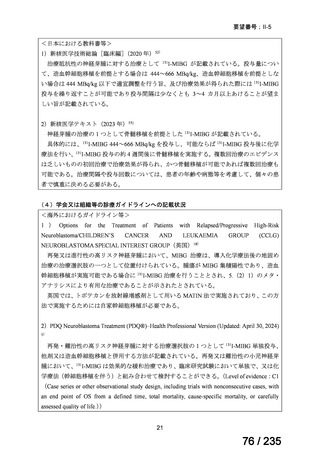
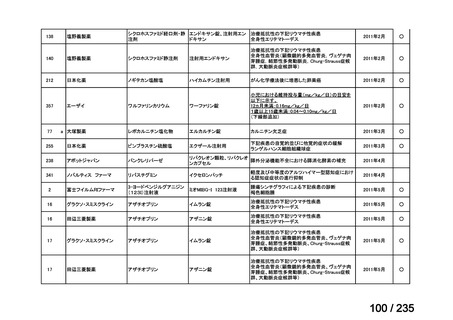
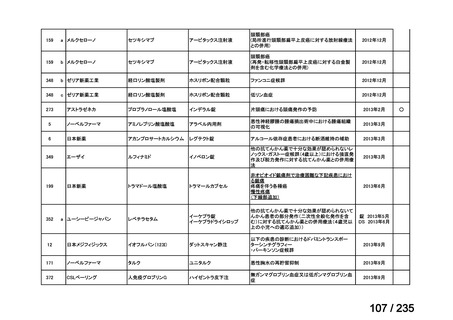
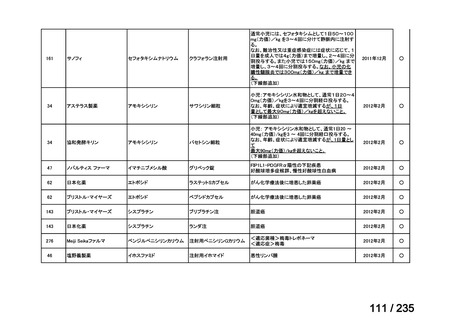
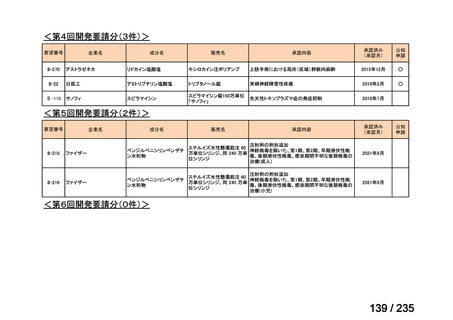
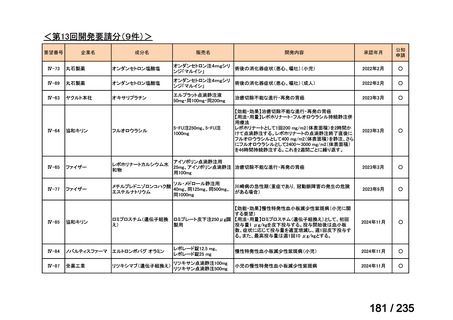
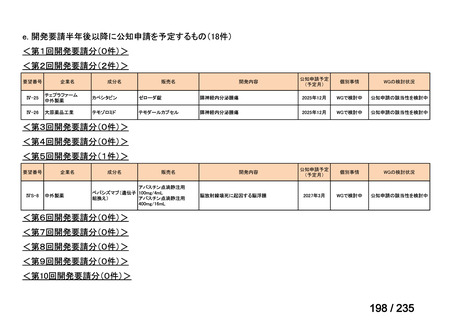
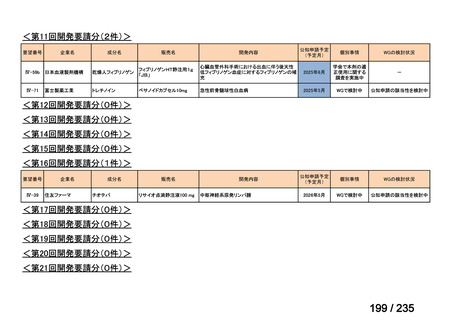
未承認薬
適応外薬
の分類
小児WG
開発要請に対する企業見解
注
(概略)
検討状況等
未承認薬
治験の実施を検討する。
-
適応外薬
申請方法について検討中。
企業見解確認中
公知申請を検討中。
公知申請の該当性に係る企業見解未提
出
迅速実用化
○
注)提出された企業見解より適宜抜粋した。
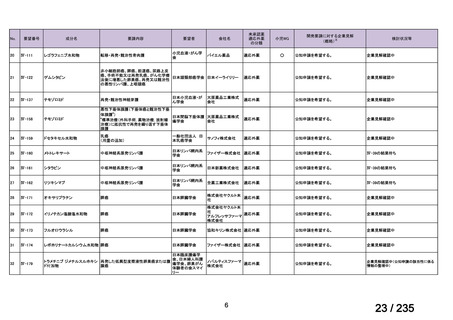
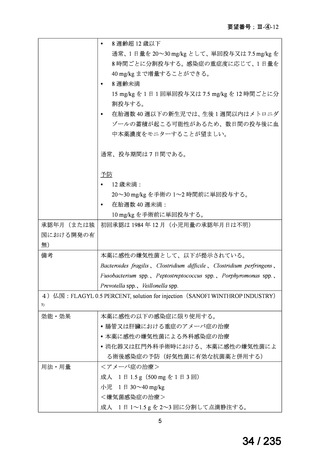
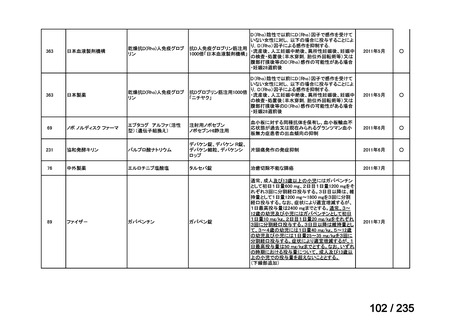
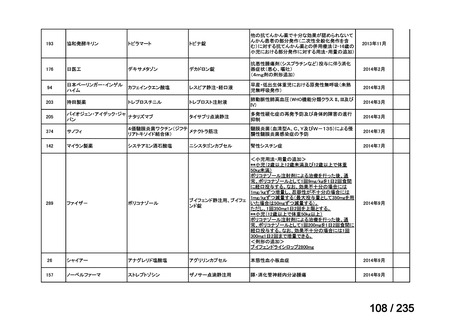
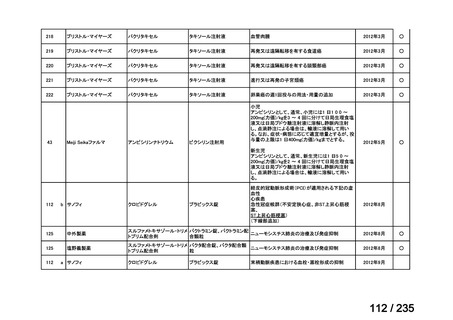
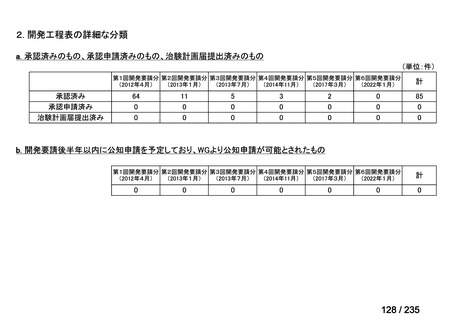
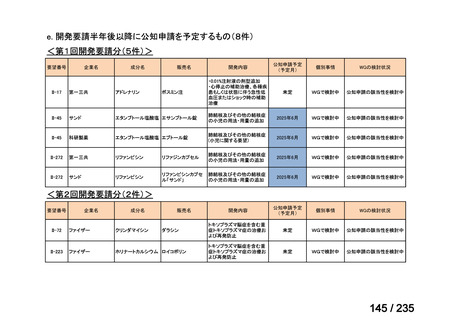
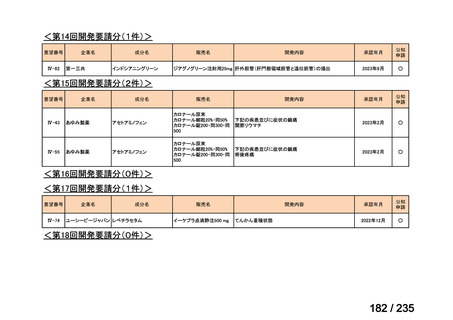
7
未承認薬
1
適応外薬
31
迅速実用化
3
合計
35
24 / 235