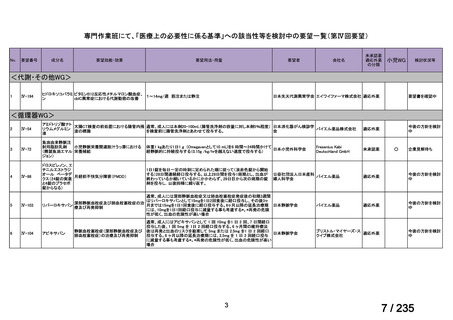
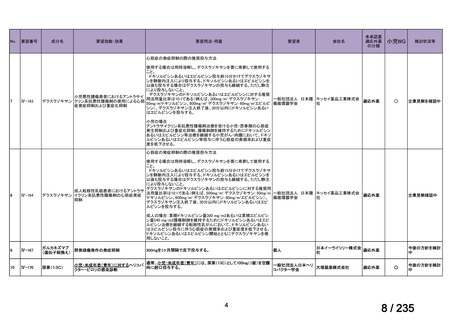
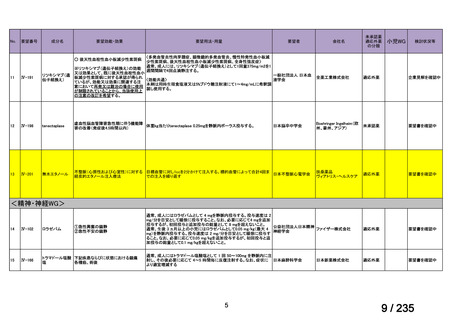
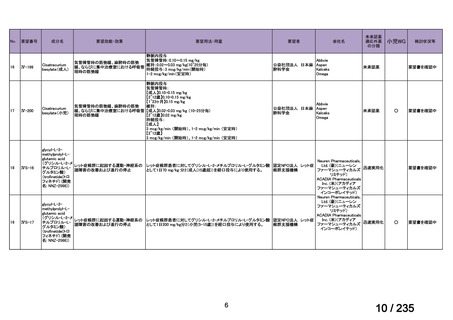
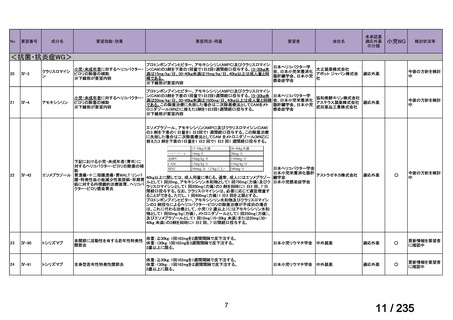
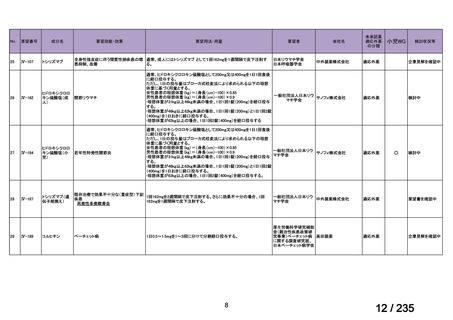
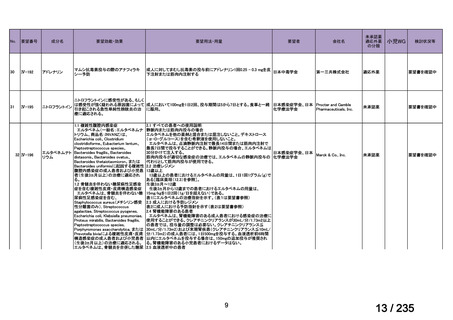
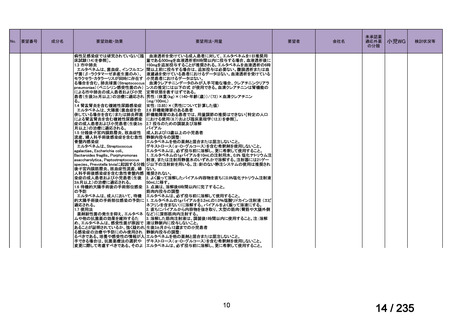
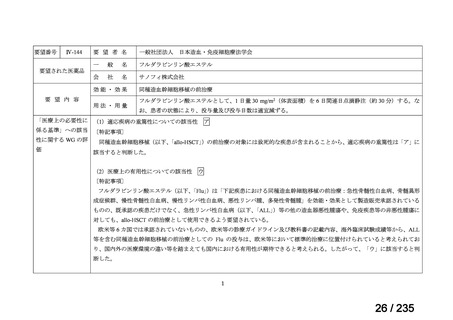
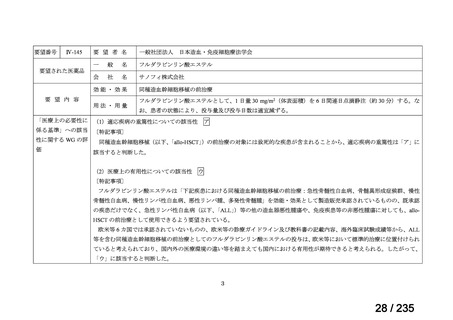
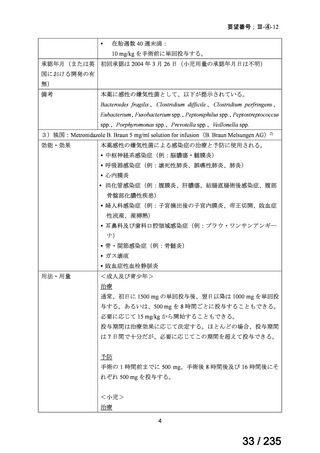
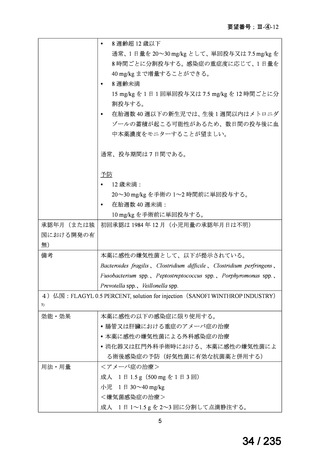
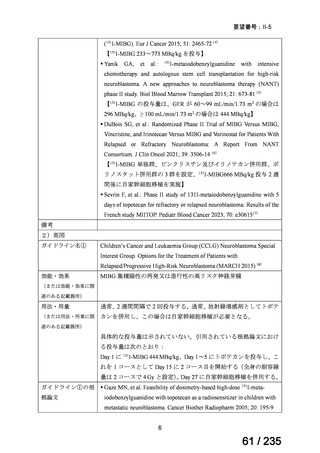
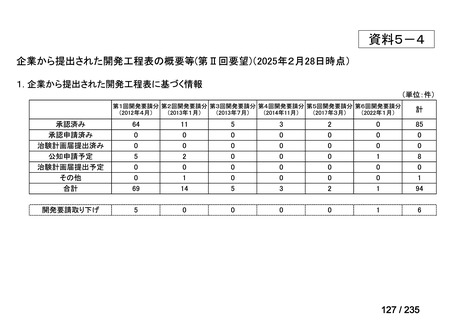
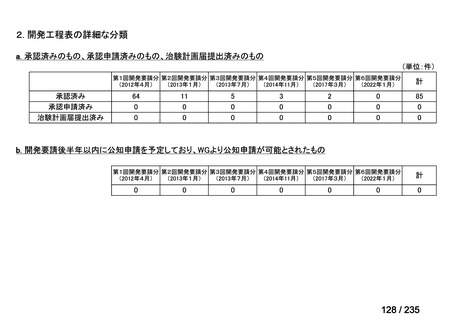
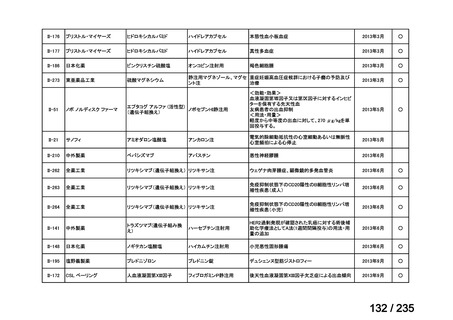
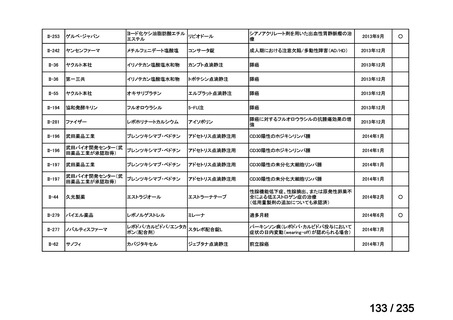
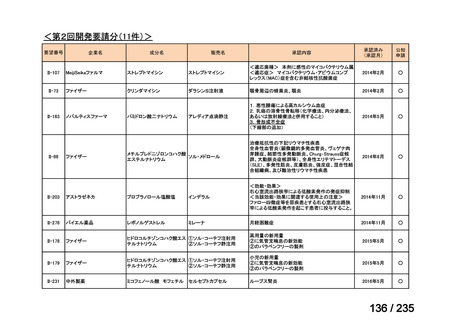
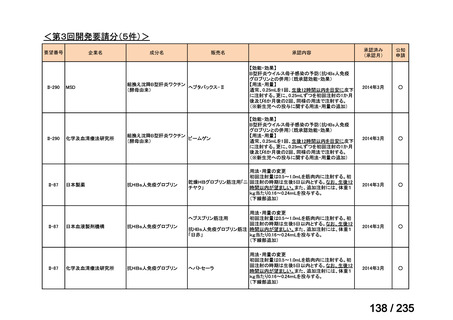
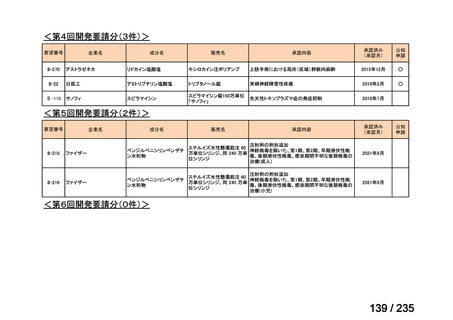
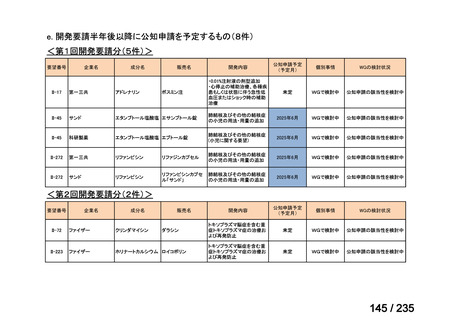
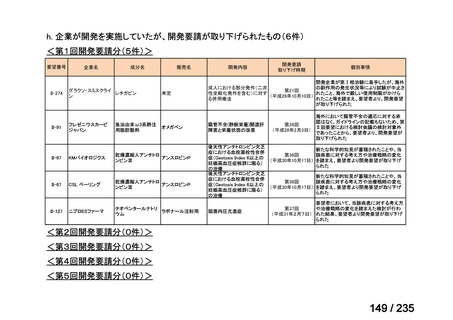
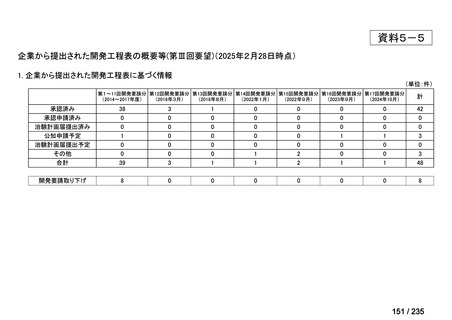
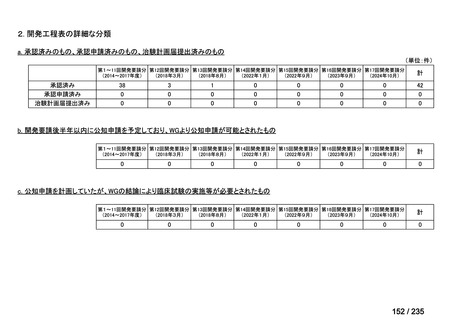
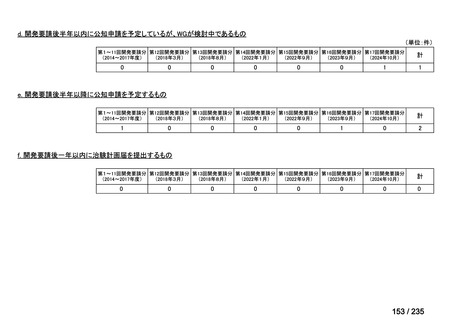
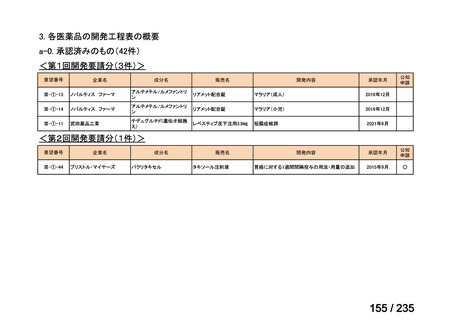
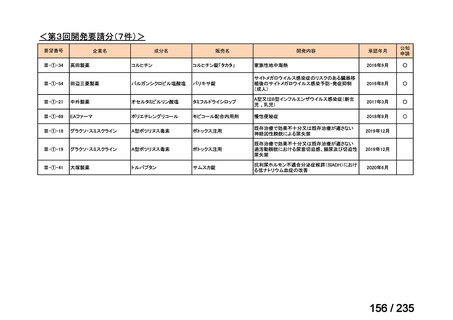
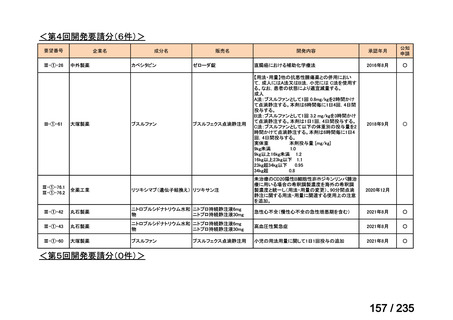
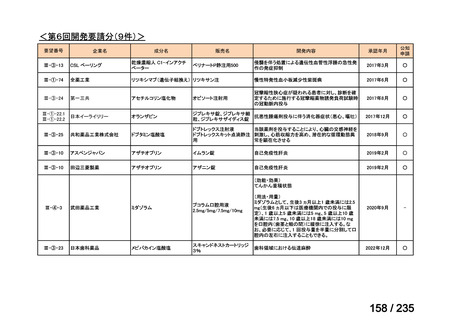
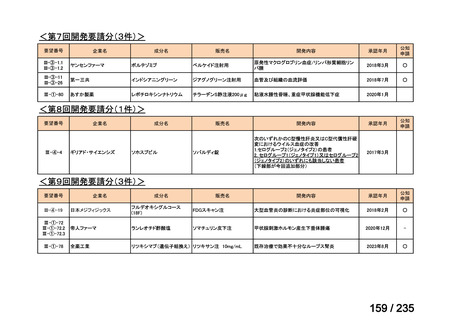
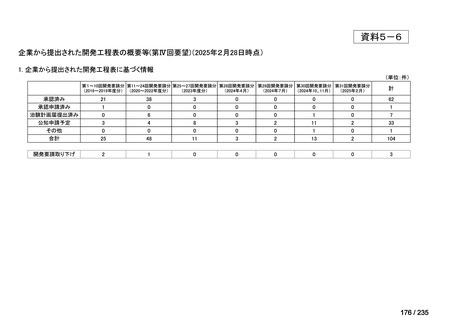
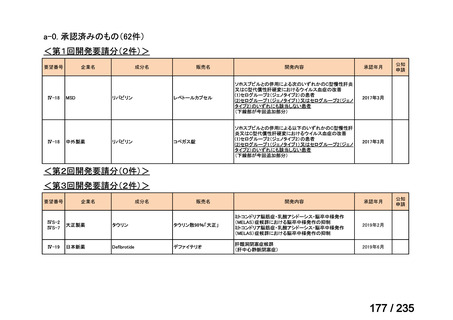
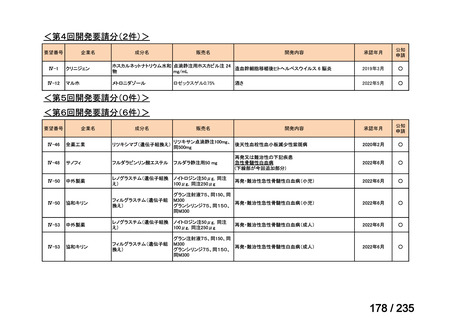
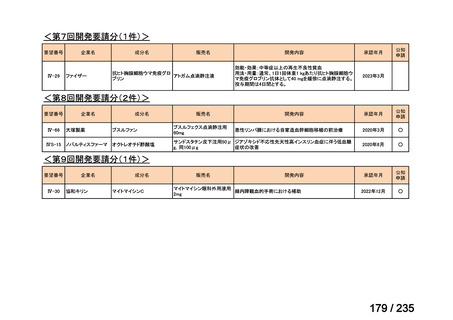
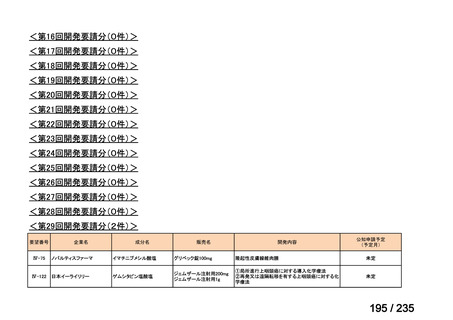
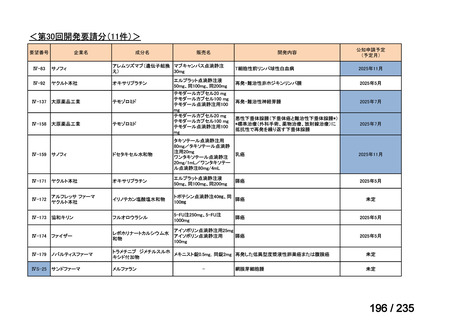
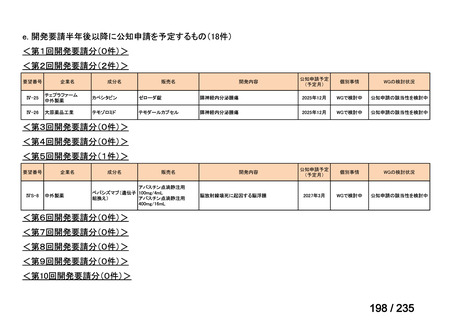
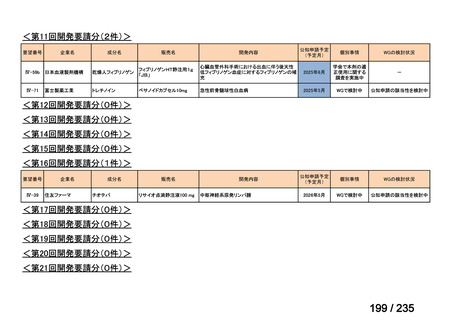
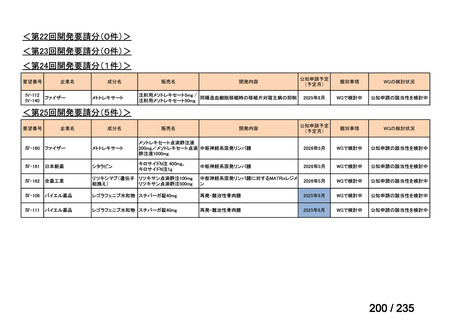
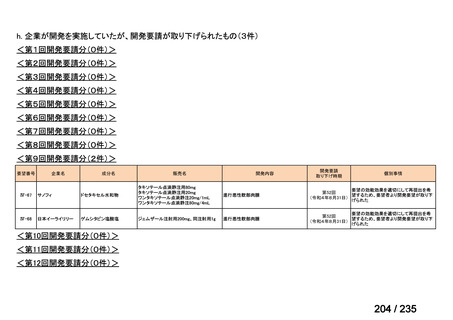
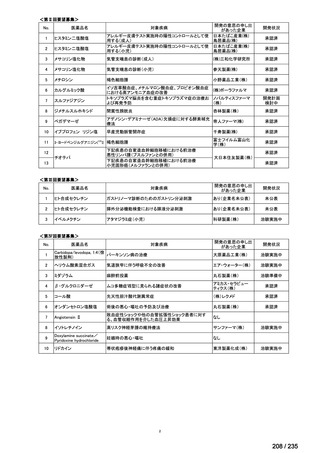
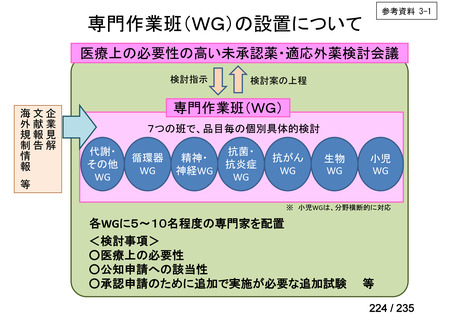
会議資料 (41 ページ)
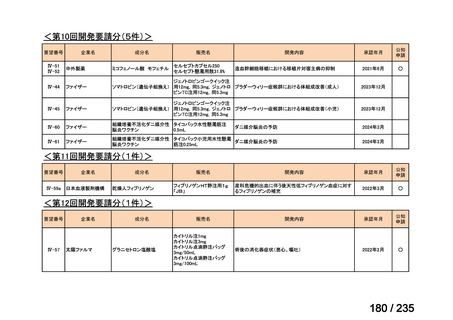
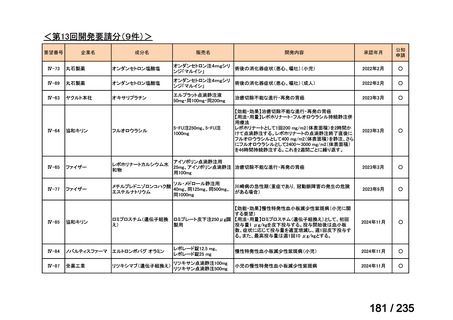
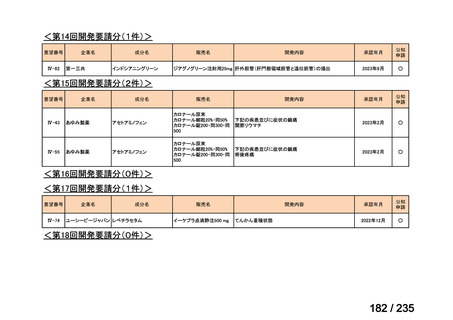
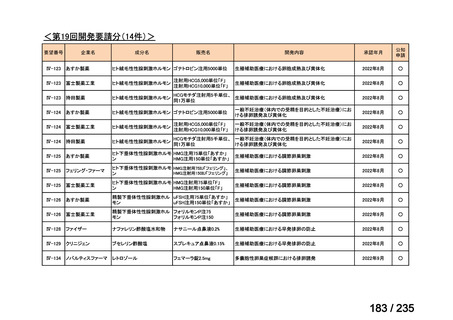
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
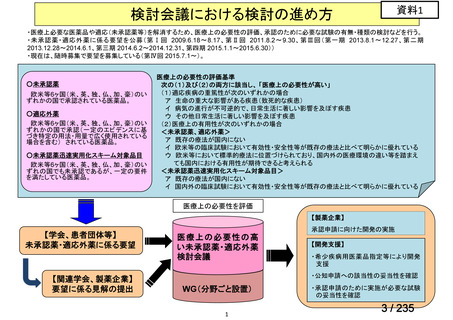
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
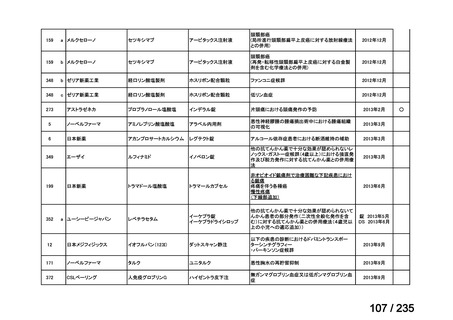
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
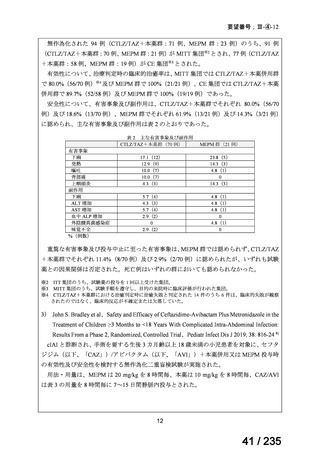
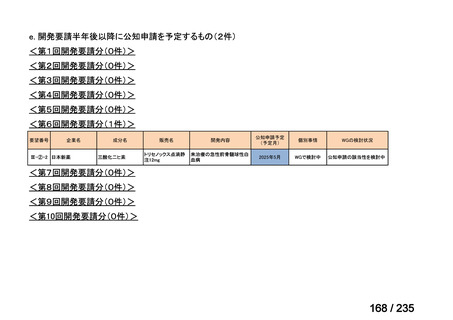
無作為化された 94 例(CTLZ/TAZ+本薬群:71 例、MEPM 群:23 例)のうち、91 例
(CTLZ/TAZ+本薬群:70 例、MEPM 群:21 例)が MITT 集団※2 とされ、77 例(CTLZ/TAZ
+本薬群:58 例、MEPM 群:19 例)が CE 集団※3 とされた。
有効性について、治療判定時の臨床的治癒率は、MITT 集団では CTLZ/TAZ+本薬併用群
で 80.0%(56/70 例)※4 及び MEPM 群で 100%(21/21 例)、CE 集団では CTLZ/TAZ+本薬
併用群で 89.7%(52/58 例)及び MEPM 群で 100%(19/19 例)であった。
安全性について、有害事象及び副作用は、CTLZ/TAZ+本薬群でそれぞれ 80.0%(56/70
例)及び 18.6%(13/70 例)、MEPM 群でそれぞれ 61.9%(13/21 例)及び 14.3%(3/21 例)
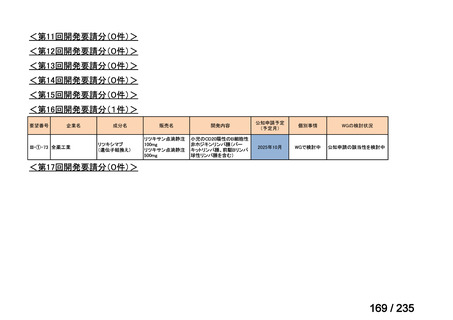
に認められ、主な有害事象及び副作用は表 2 のとおりであった。
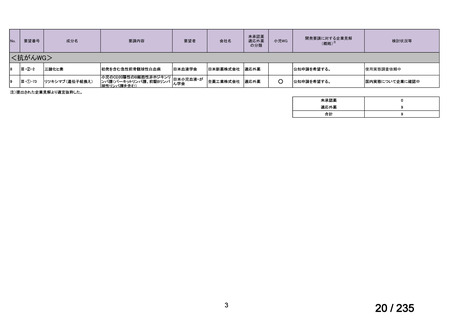
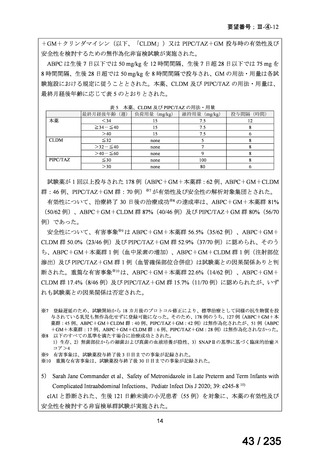
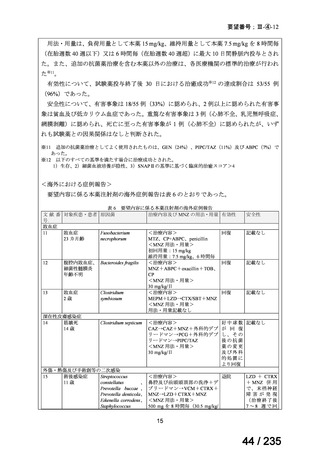
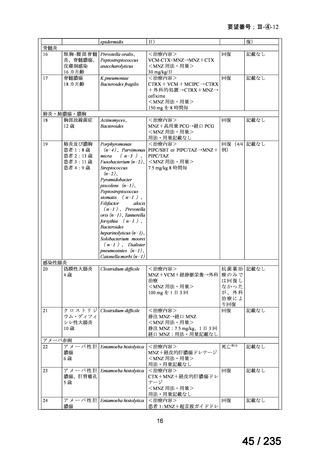
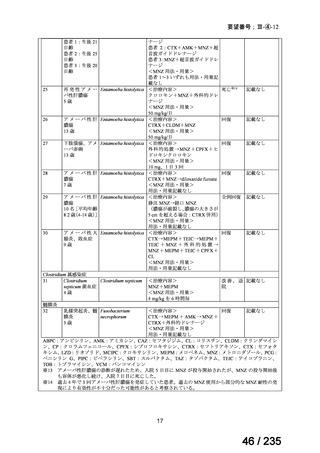
表 2 主な有害事象及び副作用
CTLZ/TAZ+本薬群(70 例)
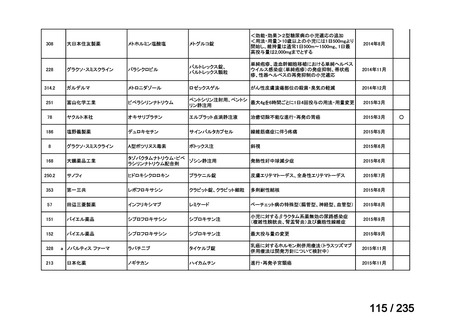
有害事象
下痢
発熱
嘔吐
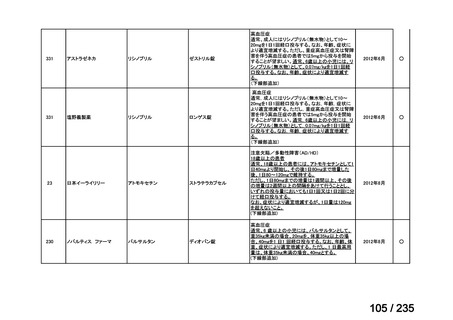
背部痛
上咽頭炎
副作用
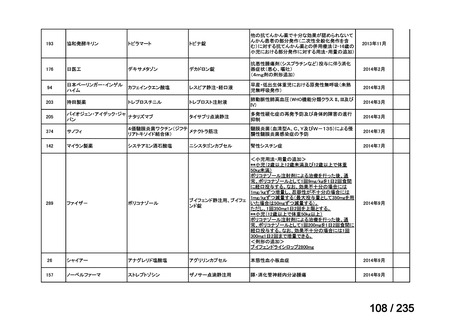
下痢
ALT 増加
AST 増加
血中 ALP 増加
外陰膣真菌感染症
味覚不全
%(例数)
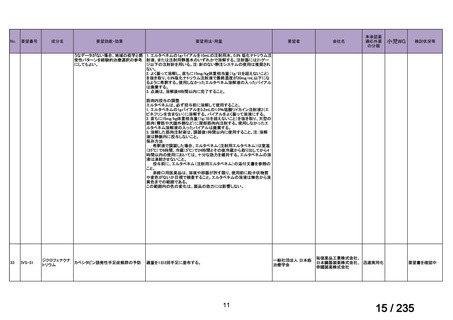
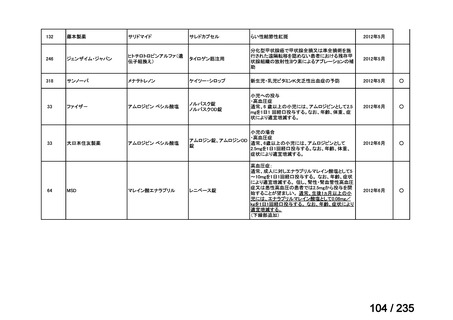
MEPM 群(21 例)
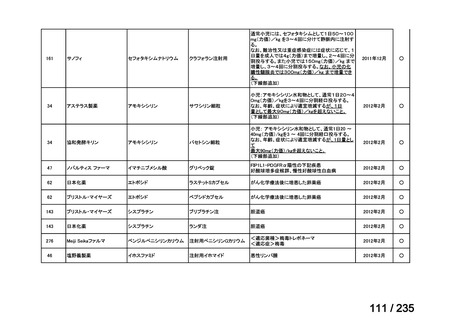
17.1(12)
12.9(9)
10.0(7)
10.0(7)
4.3(3)
23.8(5)
14.3(3)
4.8(1)
0
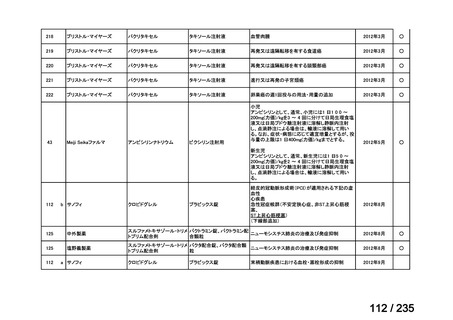
14.3(3)
5.7(4)
4.3(3)
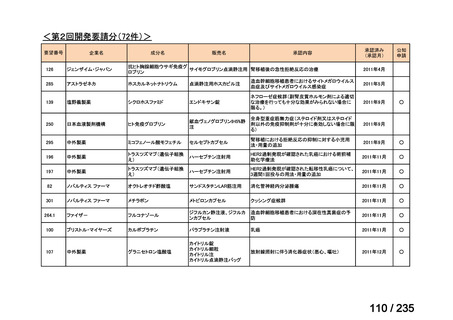
5.7(4)
2.9(2)
0
2.9(2)
4.8(1)
4.8(1)
4.8(1)
0
4.8(1)
0
重篤な有害事象及び投与中止に至った有害事象は、MEPM 群では認められず、CTLZ/TAZ
+本薬群でそれぞれ 11.4%(8/70 例)及び 2.9%(2/70 例)に認められたが、いずれも試験
薬との因果関係は否定された。死亡例はいずれの群においても認められなかった。
※2
※3
※4
ITT 集団のうち、試験薬の投与を 1 回以上受けた集団。
MITT 集団のうち、試験手順を遵守し、目的の来院時に臨床評価が行われた集団。
CTLZ/TAZ+本薬群における治癒判定時に治癒失敗と判定された 14 件のうち 6 件は、臨床的失敗が観察
されたのではなく、臨床的反応が不確定または欠落していた。
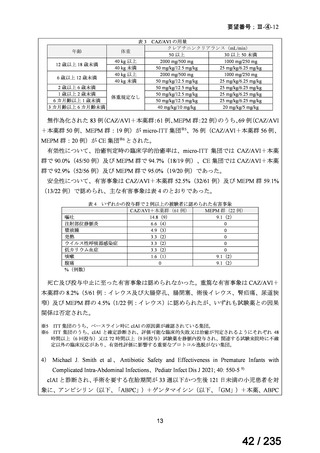
3) John S. Bradley et al、Safety and Efficacy of Ceftazidime-Avibactam Plus Metronidazole in the
Treatment of Children ≥3 Months to <18 Years With Complicated Intra-Abdominal Infection:
Results From a Phase 2, Randomized, Controlled Trial、Pediatr Infect Dis J 2019; 38: 816-24 8)
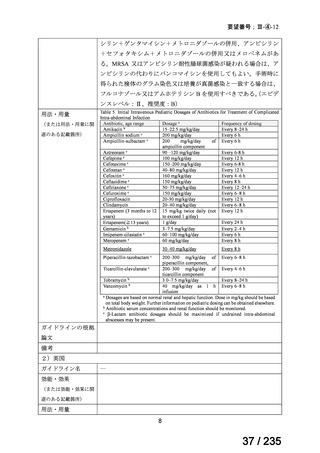
cIAI と診断され、手術を要する生後 3 カ月齢以上 18 歳未満の小児患者を対象に、セフタ
ジジム(以下、「CAZ」)/アビバクタム(以下、「AVI」)+本薬併用又は MEPM 投与時
の有効性及び安全性を検討する無作為化二重盲検試験が実施された。
用法・用量は、MEPM は 20 mg/kg を 8 時間毎、本薬は 10 mg/kg を 8 時間毎、CAZ/AVI
は表 3 の用量を 8 時間毎に 7~15 日間静脈内投与とされた。
12
41 / 235