会議資料 (66 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
れるまで増量する。
(最大量の 777 MBq/kg を投与すると正常臓器に対する総線量が耐容線量を
超えることが事前の線量評価から推察されたため,実際の最大投与量は
688.2 MBq/kg となった。
)
試 験 成 444 MBq/kg 群に 6 例、555 MBq/kg 群に 3 例、666 MBq/kg 群に 6 例が組み入
績
れられた。
安全性について、重篤な有害事象として発熱性好中球減少症 2/15 例(13.3%)、
疾患進行、上気道感染、感染、菌血症及び好中球減少性感染各 1/15 例(6.7%)
が認められた。
(その他の情報は https://clinicaltrials.gov/ct2/show/results/NCT00659984 参照)
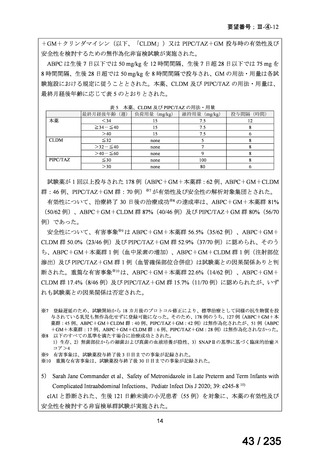
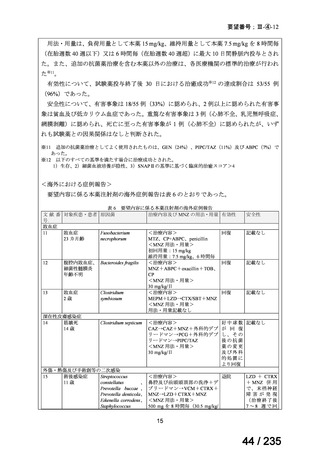
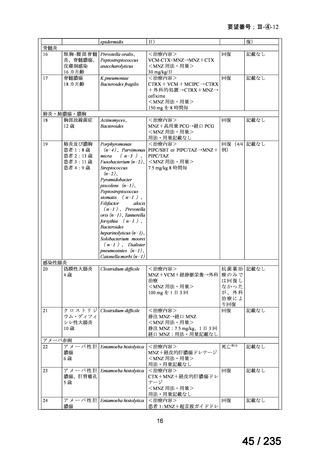
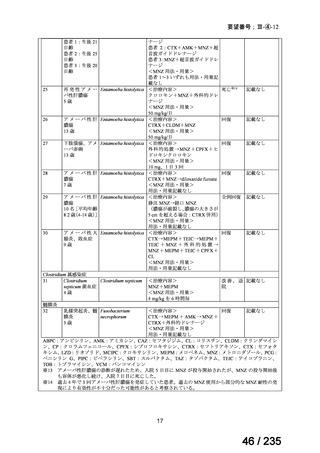
5.要望内容に係る国内外の公表文献・成書等について
(1)無作為化比較試験、薬物動態試験等の公表論文としての報告状況
<海外における臨床試験等>
単独投与
1)Matthay KK, et al. Phase II study on the effect of disease sites, age, and prior therapy on response
to iodine-131-metaiodobenzylguanidine therapy in refractory neuroblastoma. J Clin Oncol 2007; 25:
1054-60 8)
再発又は難治性の MIBG 集積陽性の神経芽腫患者 164 例(0.3~11.9 歳)を対象に、
131
I-MIBG の有効性及び安全性を検討することを目的とした第Ⅱ相試験が実施された。
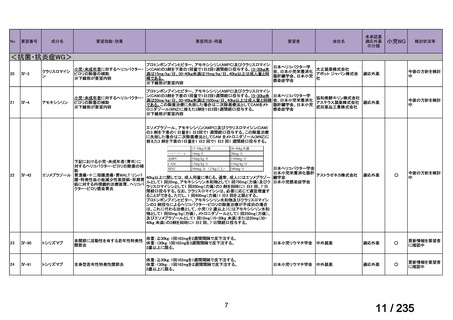
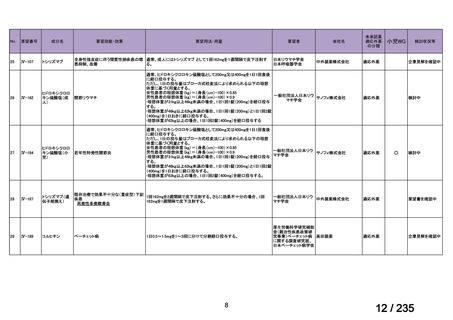
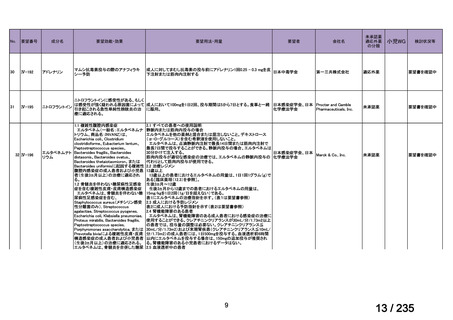
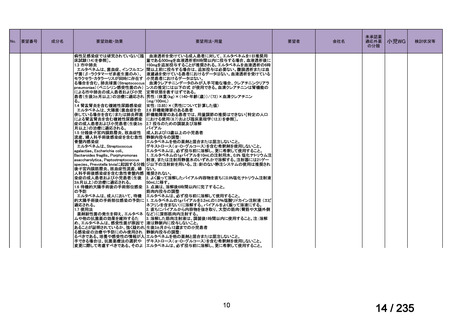
用法・用量について、造血幹細胞が準備できた 148/164 例の患者では 131I-MIBG 666 MBq/kg
が 2 時間かけて静脈内投与され、造血幹細胞が準備できなかった 16/164 例の患者では
444 MBq/kg が静脈内投与された。初回投与から 6 週間後に 2 回目投与が可能とされた。
有効性について、International Neuroblastoma Response Criteria(以下、
「INRC」)に基づく
奏効率は 444 MBq/kg 投与群で 25%(4/16 例)
、666 MBq/kg 投与群で 37%(55/147 例)であ
った。すべての患者における 1 年無イベント生存(以下、
「EFS」)率は 18%、1 年及び 2 年
全生存(以下、「OS」
)率はそれぞれ 49%及び 29%であった(観察期間の中央値:9.4 カ月
(範囲:0.5~95.6 カ月)
。
安全性について、主な事象は血液毒性であり、666 MBq/kg 投与患者の 49/148 例(33%)
で造血幹細胞移植が実施された。全患者(164 例)のうち 88%の患者で血小板輸血が必要
となり、65%は絶対好中球数が 500 /μL 未満となった。なお、444 MBq/kg 投与において、
12/16 例(75%)で血小板輸血が必要となったものの、絶対好中球数が 200/μL 未満となった
患者はいなかった。Grade 3 又は 4 の非血液毒性として、感染症 18 例、好中球減少を伴う
発熱 16 例、肝アスパラギン酸アミノトランスフェラーゼ(以下、
「AST」
)/アラニンアミノ
トランスフェラーゼ(以下、「ALT」
)上昇 6 例、二次性悪性腫瘍 5 例、高血圧、出血、肺
炎、胸水及び低酸素症各 3 例、肝ビリルビン上昇 2 例、消化管症状 1 例が認められた。
11
66 / 235