会議資料 (81 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
以上より、検討会議は以下のように考える。
国内外の臨床試験成績より、神経芽腫に対する 131I-MIBG 投与による主な有害事象は、造
血幹細胞移植が必要とされる骨髄抑制を除き、いずれも要望された医薬品(販売名:ライ
アット MIBG-I131 静注)の添付文書において既に注意喚起されている有害事象の範囲内で
あり、造血幹細胞移植併用下での骨髄抑制を含め、管理可能である。したがって、国内外
の臨床試験成績等の内容を熟知し、がん化学療法、放射線治療及び造血幹細胞移植に精通
した医師により、有害事象の観察や管理等の適切な対応がなされるのであれば、神経芽腫
に対する 131I-MIBG 投与は忍容可能である。また、要望された医薬品(販売名:ライアッ
ト MIBG-I131 静注)は再審査期間中であり、日本人における安全性情報を蓄積中であるこ
とから、医療現場に要望された医薬品(販売名:ライアット MIBG-I131 静注)の投与時に
特に注意を要する有害事象3について情報提供した上で、通常の医薬品安全性監視活動にお
いて安全性情報を収集し、これまでに得られている情報及び今後得られる情報に基づく適
切な安全対策が確実に実施されることが適切である。
(3)要望内容に係る公知申請の妥当性について
海外の承認内容、公表論文及び診療ガイドライン・教科書等への記載状況から、神経芽
腫に対する 131I-MIBG(296~666 MBq/kg)の有効性は期待できると判断した(「7.
(1)要
望内容に係る外国人におけるエビデンス及び日本人における有効性の総合評価について」
の項参照)
。
国内外の臨床試験で認められた Grade 3 以上の有害事象は、本邦の添付文書で既に注意
喚起されている事象である一方で、要望された医薬品(販売名:ライアット MIBG-I131 静
注)は再審査期間中であることを考慮すると、国内外の臨床試験成績等の内容を熟知し、
がん化学療法、放射線治療及び造血幹細胞移植に精通した医師により、有害事象の観察や
管理等の適切な対応がなされるのであれば、神経芽腫に対する 131I-MIBG 投与は忍容可能
と考える(「7.(2)要望内容に係る外国人におけるエビデンス及び日本人における安全性
の総合評価について」の項参照)。
以上より、検討会議は、MIBG 集積陽性の神経芽腫に対する 131I-MIBG 投与(296~
666 MBq/kg)の臨床的有用性は、本報告書に記載した情報により説明可能であり、要望さ
れた医薬品(販売名:ライアット MIBG-I131 静注)については引き続き日本人における安
全性の情報収集等については継続する必要はあるものの、追加の臨床試験を実施すること
なく、本検討会議の公知申請の枠組みで対応可能と判断した。
8.効能・効果及び用法・用量等の記載の妥当性について
(1)効能・効果について
3
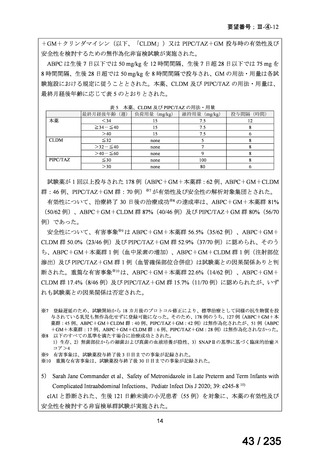
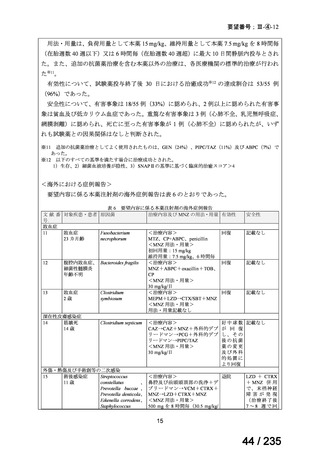
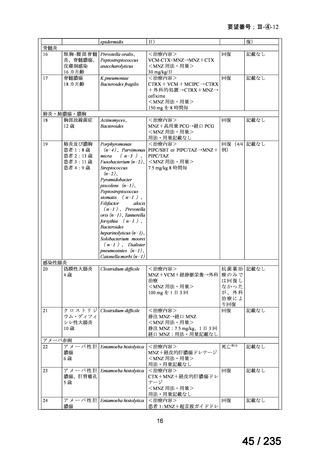
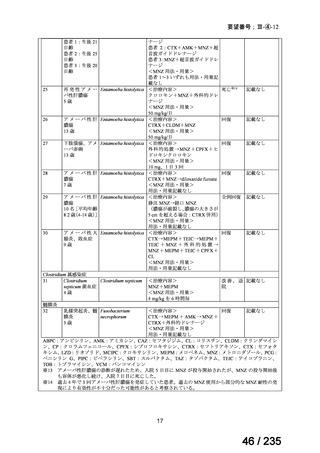
骨髄抑制、二次性悪性腫瘍及び甲状腺機能低下症
26
81 / 235