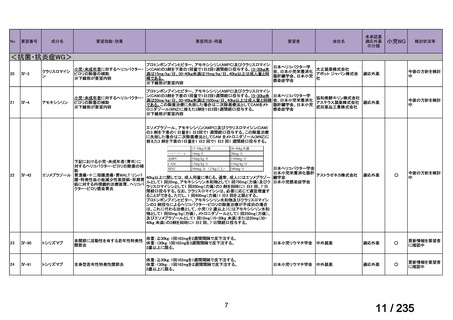
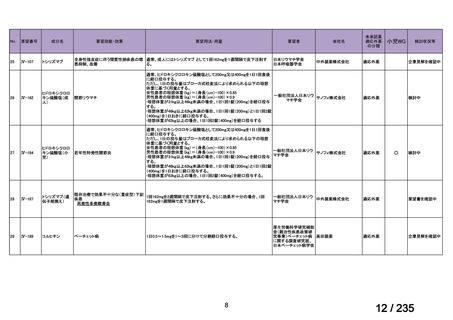
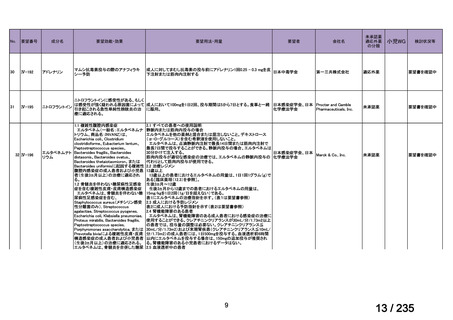
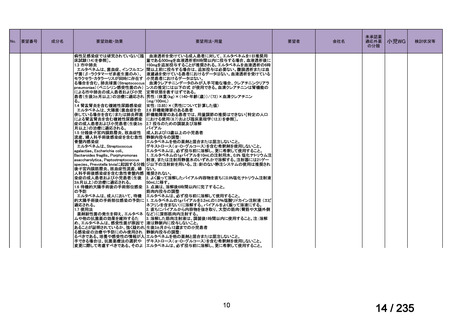
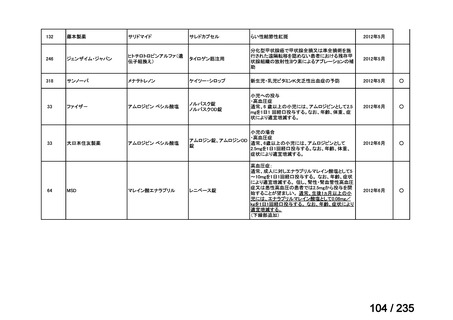
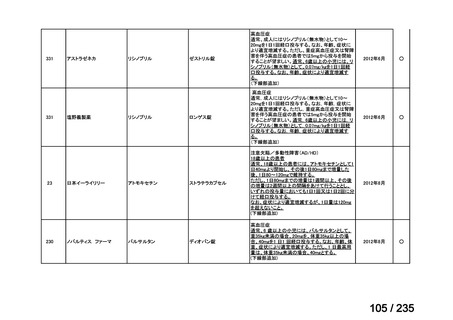
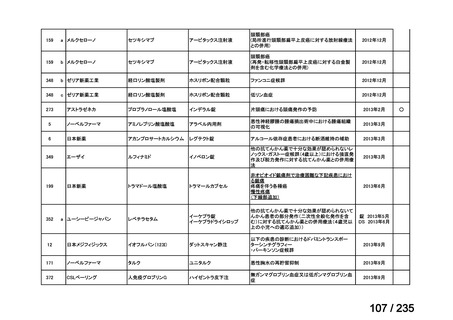
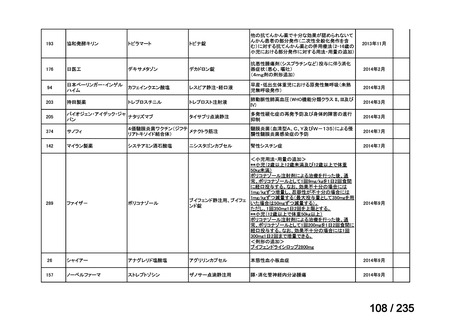
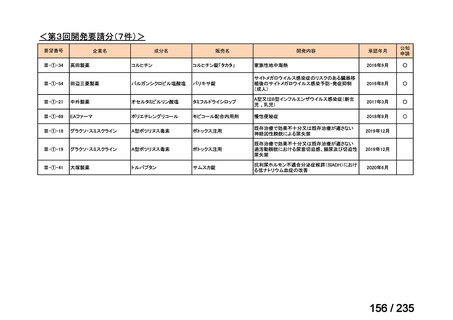
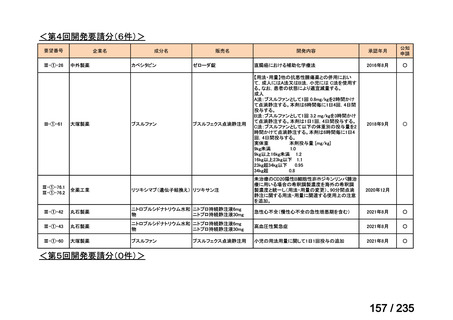
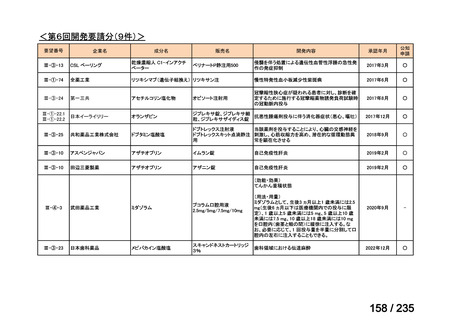
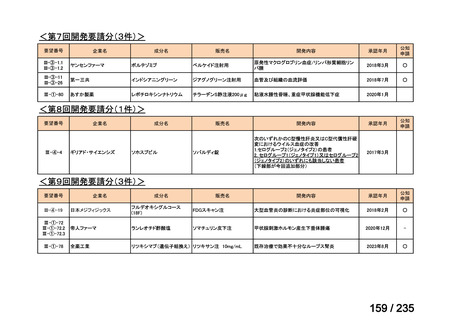
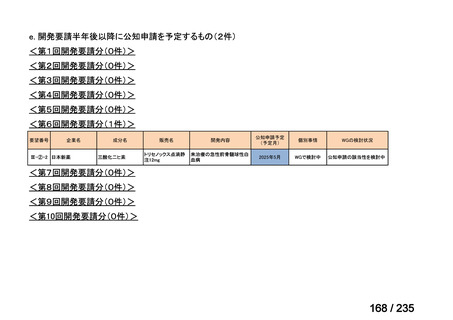
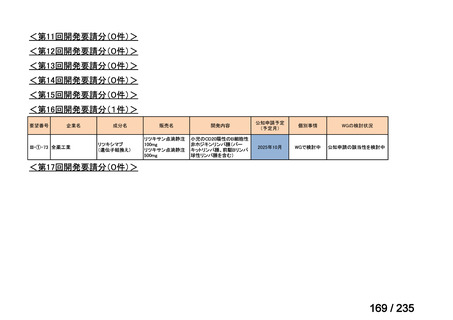
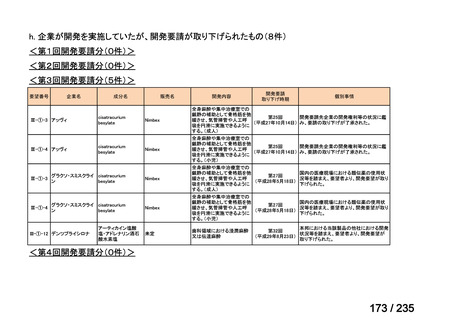
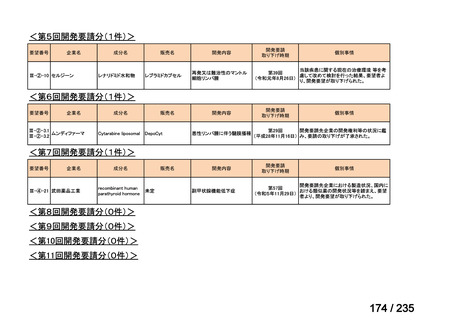
会議資料 (57 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00036.html |
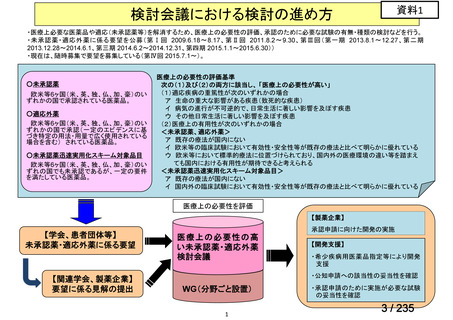
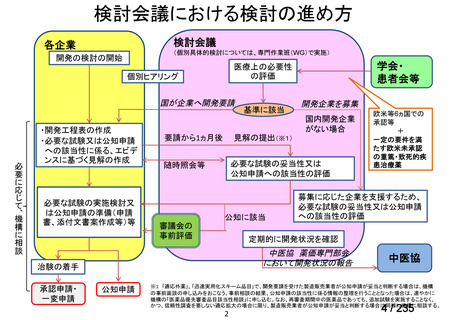
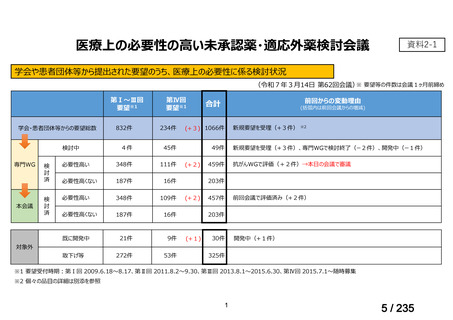
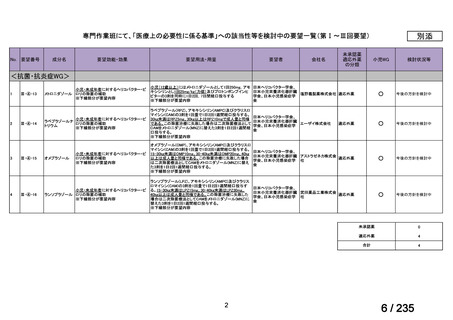
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第62回 3/13)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
AZEDRA (iobenguane I 131) injection, for intravenous use(Progenics Pharmaceuticals, Inc.)
効能・効果
神経芽腫に係る承認なし
(現在の効能・効果は褐色細胞腫・パラガングリオーマ)
用法・用量
-
承認年月(または米 褐色細胞腫・パラガングリオーマに係る承認年月:2018 年 7 月
国における開発の有 神経芽腫の開発の有無:不明*
無)
*:2018 年 7 月承認時の FDA からの「ADMINISTRATIVE and CORRESPONDENCE
DOCUMENTS」には、以下の記載がある:
Azedra is also being developed for the treatment of neuroblastoma. Currently there is one
ongoing investigation, MIP-IB13, an activity estimating study of Azedra in patients with
relapse/refractory high-risk neuroblastoma.
一方で、当該試験(ClinicalTrials.gov Identifier: NCT00659984)実施後の最新の状況
について国内開発企業は把握していない。
備考
Expanded Access Program(Compassionate Use)において難治性神経芽
腫患者に対する投与が実施されている
(ClinicalTrials.gov Identifier: NCT01370330)。
Compassionate Use Protocol における用法・用量:
296~666 MBq/kg を投与する。投与量は医師の判断により調整す
る。444 MBq/kg 以上を投与する場合は、幹細胞移植(stored stem
cells)が必要である。
30~60 分かけて静脈内投与する。
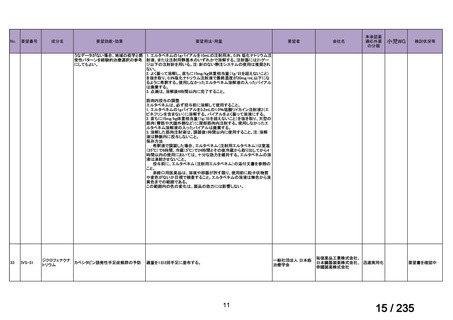
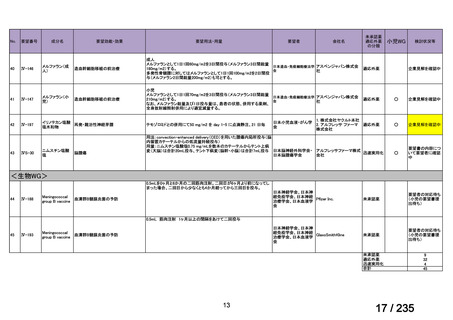
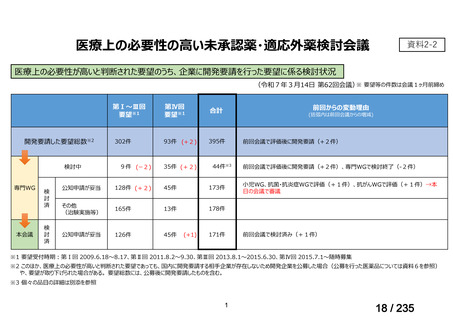
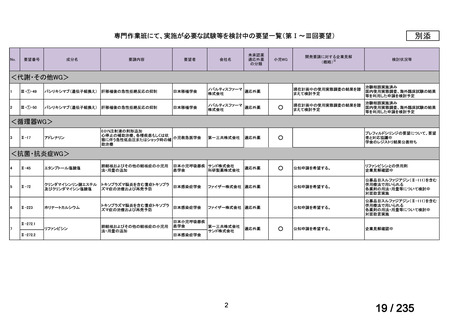
要望された医薬品(販売名:ライアット MIBG-I131 静注)の承認は
ないため、他の 131I-MIBG 製剤の承認状況について記載した。
2)英国 2)
Meta-Iodobenzylguanidine (131I) for Therapeutic Use 185-740 MBq/ml solution for infusion or
solution for injection(GE Healthcare Limited)
効能・効果
用法・用量
MIBG 集積陽性の神経芽腫
成人及び高齢者
線量評価に基づき、個々に用量を調整する。
用量及び投与間隔は、血液機能及び癌種により決定する。進行
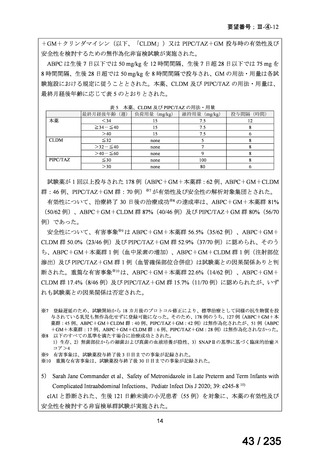
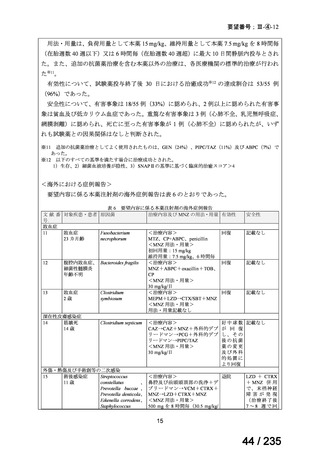
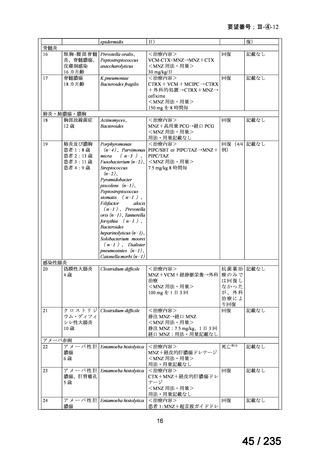
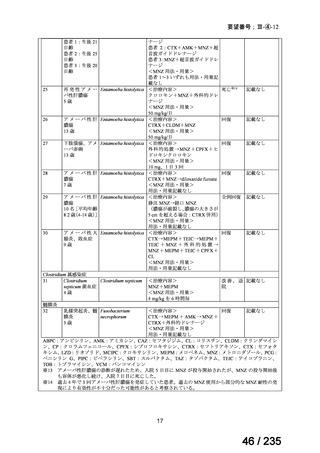
が速い腫瘍では、投与間隔を短くする。
用量を固定する場合は、3.7~7.4 GBq とする。
小児
成人と同様
未熟児又は新生児には投与しない。
投与は 1~4 時間かけて静脈内投与する。
本治療は自家幹細胞移植が可能な患者にのみ考慮されるべきで
ある。骨髄毒性(血小板減少症)は、注意深く頻繁に観察する必
2
57 / 235