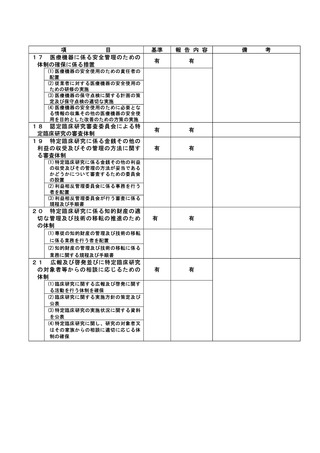
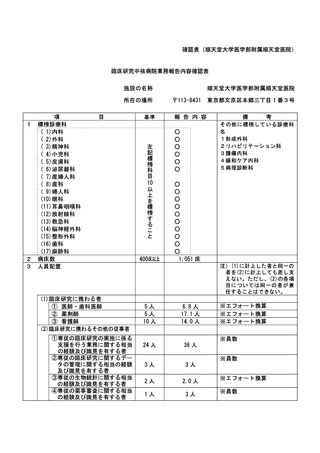
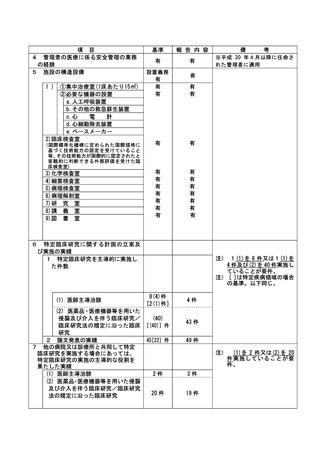
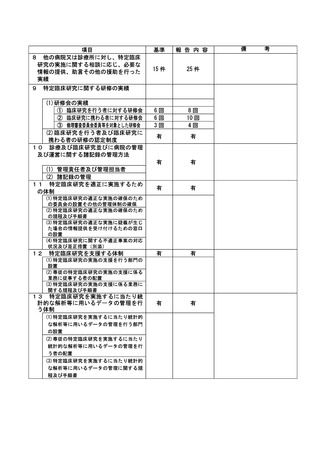
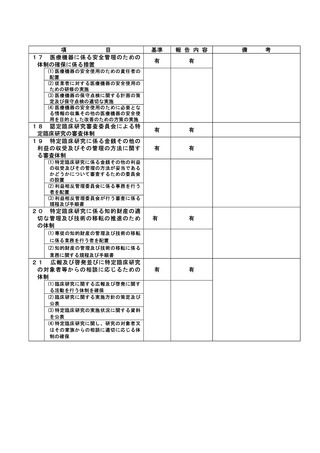
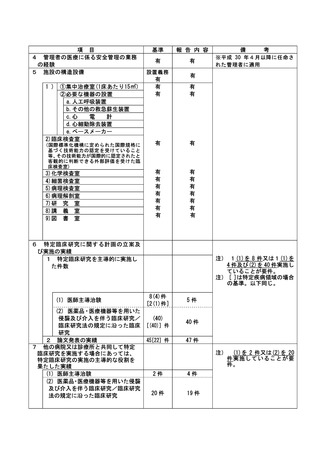
資料2:臨床研究中核病院業務報告内容確認表 (103 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
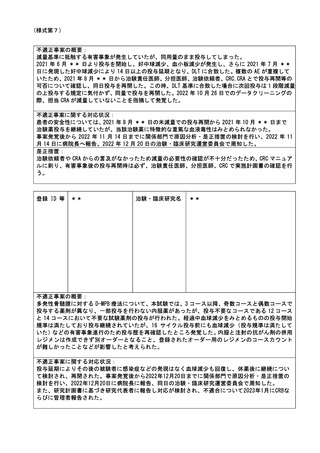
は、直近の来院時に経緯および第 3 版から第 4 版への変更点を口頭説明したうえで、最新版の ICF
第 5 版を用いて、第 4 版からの変更点について説明を実施、文書同意を取得した。
是正措置:
CRC は 3/22 に ICF が第 4 版に改訂されていたことを失念していた、改訂が 2 ヶ月連続で行われてお
り版数管理の把握ができていなかったことから、下記対策をおこない最新版を用いた同意説明が行
えるよう管理方法を修正した。
・Informed consent log(作成日と IRB 承認された日が記録された ICF 版数管理のための資料)を
タイムリーに作成し、Log に基づき最新版の ICF の版数を確認する。
・同意説明文書改訂に関する IRB 承認後、CRA は審査結果通知書を受領したことを責任医師及び
CRC へ共有する。
・IRB 後、審査結果通知書の発行が被験者の来院に間に合わない場合には、PI もしくは CRC が事務
局へ相談する。
・旧版の ICF については、最新版 ICF が承認されたことを確認し、速やかに破棄する
・同意説明実施時に、CRC は同意説明文書の版数について担当モニターと共有する。
・同意説明を実施する際は、準備している ICF が最新版の ICF であるかを CRC にてダブルチェック
を実施する。
・IRB 承認後、依頼者は通知書を受領したことを責任医師及び CRC へ共有する。
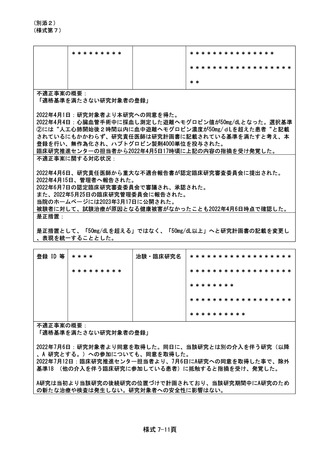
登録 ID 等
*******
治験名
******************
******************
******************
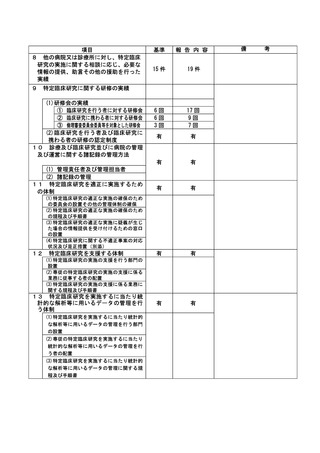
不適正事案の概要:同意説明文書第4.0版での口頭同意未取得及び文書同意取得の遅延
2022 年 7 月 6 日、同意説明文書第 4.0 版への改訂内容について、責任医師確認。その後 7 月 8 日に
CRA から ICF 修正依頼が発生したため、最終版確定後に被験者への口頭同意の対応準備(同意説明
文書の変更一覧の印刷など)が漏れてしまい、同意説明文書の改訂がおこなわれたことを失念。口
頭同意の取得漏れおよび文書同意取得の遅延について 10 月 13 日 SDV 時に判明した。
不適正事案に関する対応状況:
今回の同意説明文書の改訂内容から、被験者の安全性及び治験の継続に問題ないことを確認した。
同意説明文書第 4.0 版での文書同意を取得していない被験者については、直近の受診にて文書同意
を取得した。
是正措置:
同意説明文書改訂の最終版が確定した段階で、同意説明文書とその変更一覧を CRA から CRC に送付
してもらうように依頼する。また、CRA から CRC への通知メールを打ち出し、被験者毎の症例ファ
イル等に入れて、被験者対応時に口頭同意の取得を失念しないようにする。
今回のような責任医師確認後に同意説明文書の修正連絡が発生した場合でも、口頭同意が適切に実
施できるよう、上記の対応方法を追加して再発防止を図る。
また、文書同意については、CRA から提供される同意説明文書の搬入に依存する事なく、改訂時の
IRB の審議結果の確認をするため、変更申請リスト一覧と審議結果の連絡メールを CRC 間で回覧す
る。
登録 ID 等
*******
治験名
******************
******************
******************
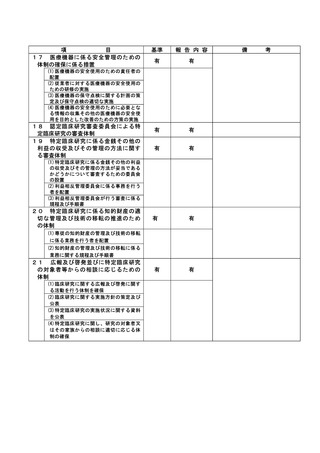
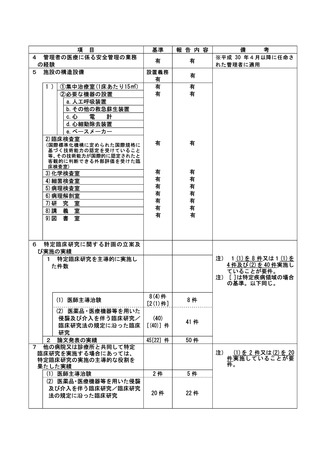
不適正事案の概要:重篤な有害事象の報告遅延
様式第 7-10
102