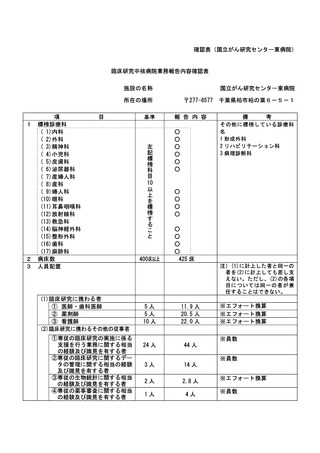
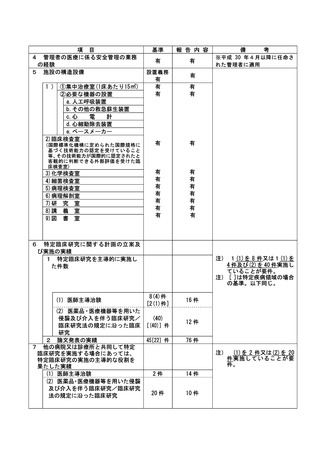
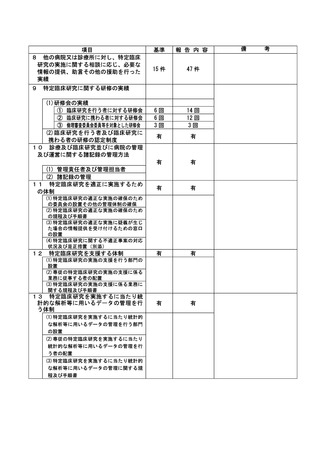
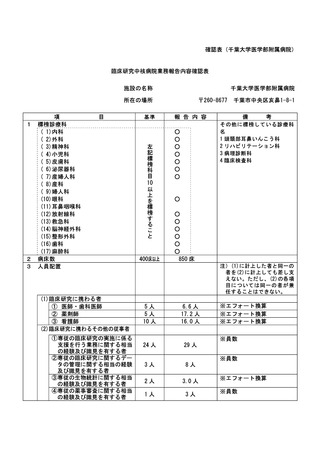
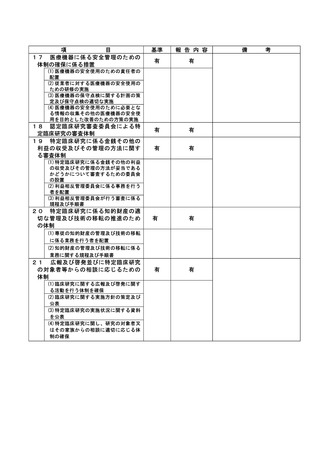
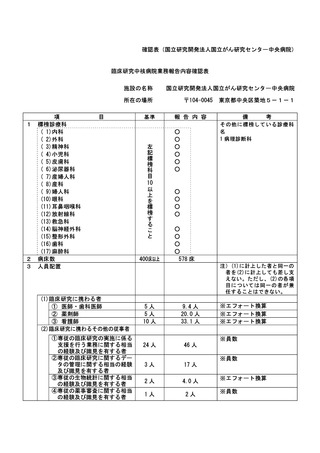
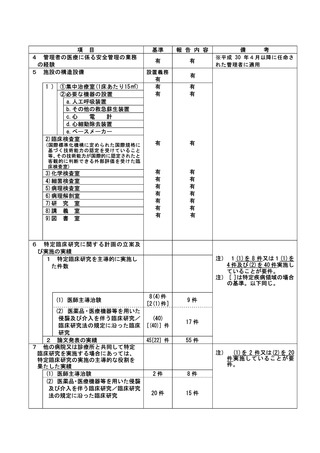
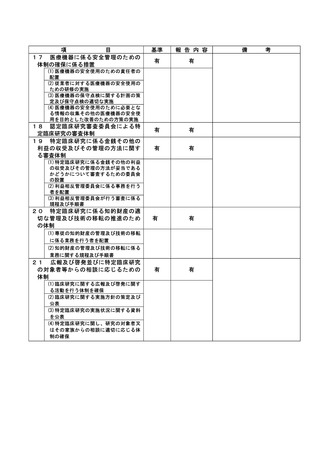
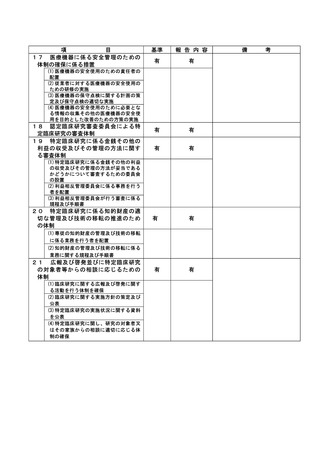
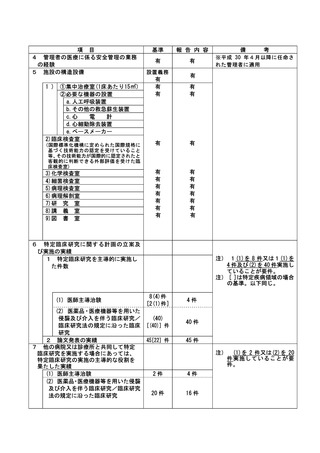
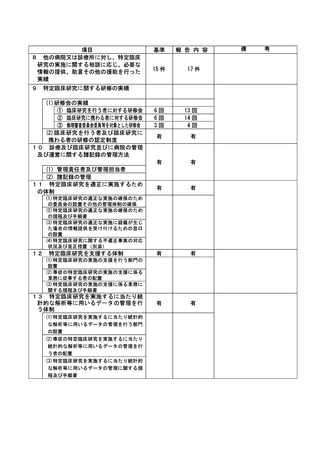
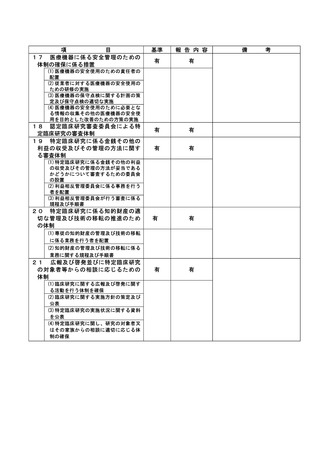
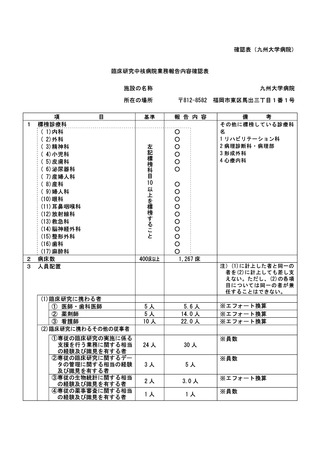
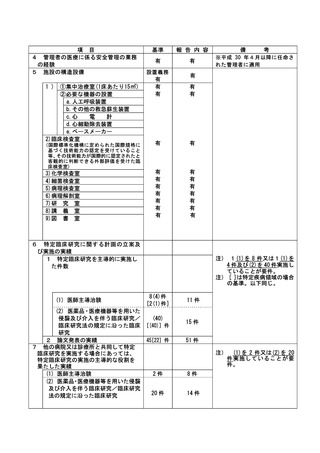
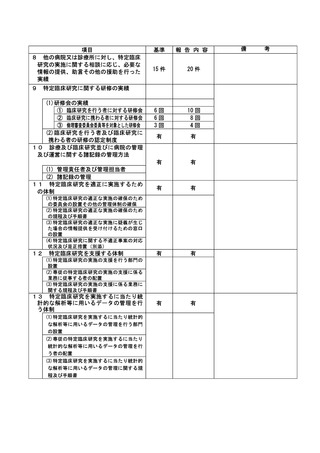
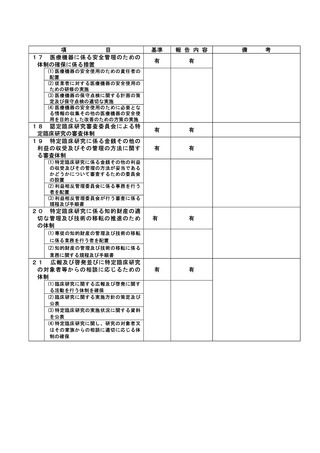
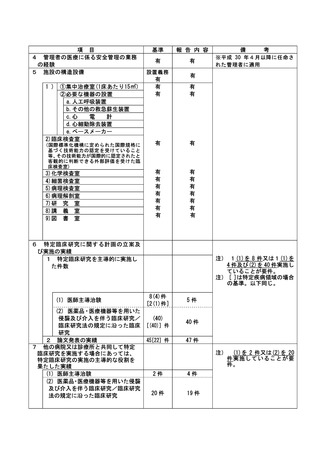
資料2:臨床研究中核病院業務報告内容確認表 (74 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
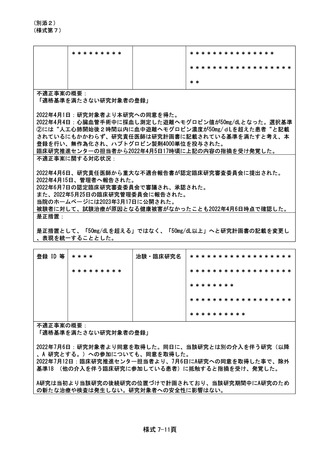
不適正事案の概要:
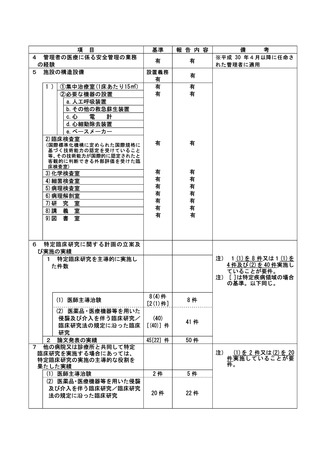
減量基準に抵触する有害事象が発生していたが、同用量のまま投与してしまった。
2021 年 6 月 ** 日より投与を開始し、好中球減少、血小板減少が発生し、さらに 2021 年 7 月 **
日に発現した好中球減少により 14 日以上の投与延期となり、DLT に合致した。複数の AE が重複して
いたため、2021 年 8 月 ** 日から治験責任医師、分担医師、治験依頼者、CRC,CRA とで投与再開等の
可否について確認し、同日投与を再開した。この時、DLT 基準に合致した場合に次回投与は 1 段階減量
の上投与する規定に気付かず、同量で投与を再開した。2022 年 10 月 26 日でのデータクリーニングの
際、担当 CRA が減量していないことを指摘して発覚した。
不適正事案に関する対応状況:
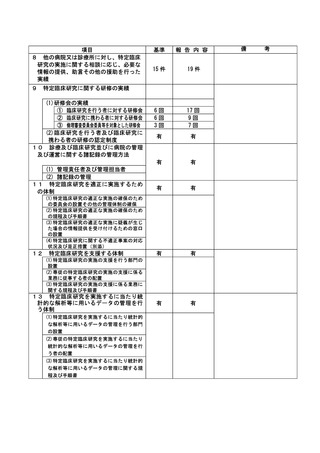
患者の安全性については、2021 年 8 月 ** 日の未減量での投与再開から 2021 年 10 月 ** 日まで
治験薬投与を継続していたが、当該治験薬に特徴的な重篤な血液毒性はみとめられなかった。
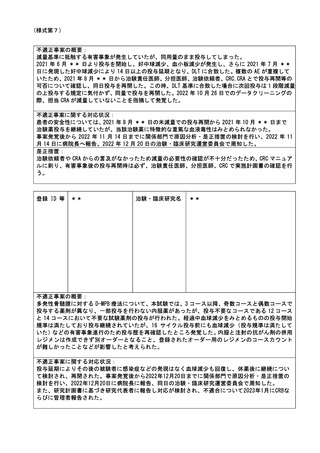
事案発覚後から 2022 年 11 月 14 日までに関係部門で原因分析・是正措置の検討を行い、2022 年 11
月 14 日に病院長へ報告、2022 年 12 月 20 日の治験・臨床研究運営委員会で周知した。
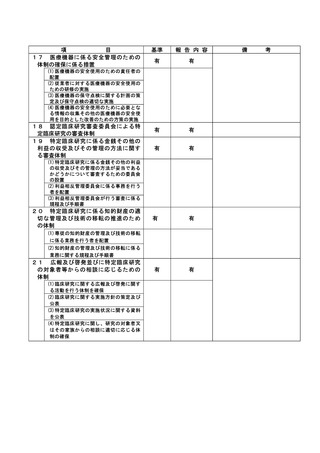
是正措置:
治験依頼者や CRA からの言及がなかったため減量の必要性の確認が不十分だったため、CRC マニュア
ルに則り、有害事象後の投与再開時は必ず、治験責任医師、分担医師、CRC で実施計画書の確認を行
う。
登録 ID 等
**
治験・臨床研究名
**
不適正事案の概要:
多発性骨髄腫に対する D-MPB 療法について、本試験では、3 コース以降、奇数コースと偶数コースで
投与する薬剤が異なり、一部投与を行わない内服薬があったが、投与不要なコースである 12 コース
と 14 コースにおいて不要な試験薬剤の投与が行われた。経過中血球減少をみとめるものの投与開始
規準は満たしており投与継続されていたが、16 サイクル投与前にも血球減少(投与規準は満たして
いた)などの有害事象進行のため投与歴を再確認したところ発覚した。内服と注射の抗がん剤の併用
レジメンは作成できず別オーダーとなること、登録されたオーダー用のレジメンのコースカウント
が難しかったことなどが影響したと考えられた。
不適正事案に関する対応状況:
投与延期によりその後の被験者に感染症などの発現はなく血球減少も回復し、休薬後に継続につい
て検討され、再開された。事案発覚後から2022年12月20日までに関係部門で原因分析・是正措置の
検討を行い、2022年12月20日に病院長に報告、同日の治験・臨床研究運営委員会で周知した。
また、研究計画書に基づき研究代表者に報告し対応が検討され、不適合について2023年1月にCRBな
らびに管理者報告された。
73