資料2:臨床研究中核病院業務報告内容確認表 (83 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
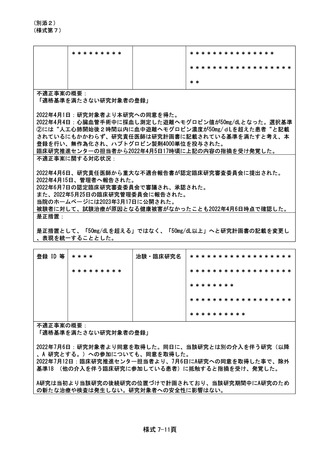
なお、いずれの症例も今回の事案に関して、対象となる患者(またはそのご家族)に説明がなされ
ており、今回の事案とその後の治療経過についても、承諾が得られていることを確認した。
令和4年7月13日及び令和5年10月12開催の特定臨床研究管理委員会にて報告した。
是正措置:
7 月 27 日開催の CRB にて研究責任医師に対して再発防止を徹底するよう注意喚起を行った。
登録 ID 等
**
治験・臨床研究名
**
不適正事案の概要:
④計画変更手続きの遅滞
不適正事案に関する対応状況:
状況:
共同研究機関(1 機関)において、2022 年 4 月に研究責任医師及び研究分担医師の変更があったが、
研究計画書等の変更手続きが 2022 年 3 月の CRB までに行われておらず、一時、計画書と異なる実施
体制によって研究が実施されていたことが、2022 年 4 月 28 日のモニタリングによって判明した。
対応:
CRB 委員長確認のもと、2022 年 6 月 28 日に病院長へ報告を行った。
当該計画変更については、2022 年 5 月 25 日開催の CRB にて承認された。なお、計画申請が承認され
るまでの間に被験者登録はなかった。
2022 年 7 月 13 開催の特定臨床研究管理委員会にて報告した。
是正措置:
CRB 事務局より研究事務局に対して、再発防止に努めることを求めるとともに、発生施設以外の実施
医療機関への周知依頼を行った。
再発防止策として、不適合についてスタッフ間で共有し、臨床研究法及び手続きのフローの再確認を
行った。
登録 ID 等
**
治験・臨床研究名
**
不適正事案の概要:
⑤計画変更後の管理者による実施許可を得ないまま研究が継続されていた共同研究機関があり、
一部の症例で研究期間を越えて登録が行われた
不適正事案に関する対応状況:
状況:
2021 年 6 月に研究期間を延長する変更申請(研究終了日:変更前 2021 年 12 月 31 日→変更後 2022
年 12 月 31 日)が承認、jRCT 公表されたが、研究事務局が調査を行ったところ、一部の共同研究機
関において管理者による承認を得ずに研究が継続されていたことが判明した。なお、変更前の研究終
了日である 2021 年 12 月 31 日以降に登録された症例が 2 例あった。
対応:
様式 7-10頁
82