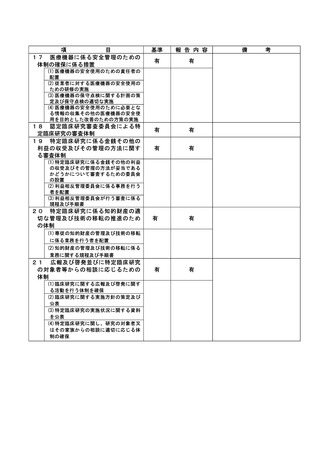
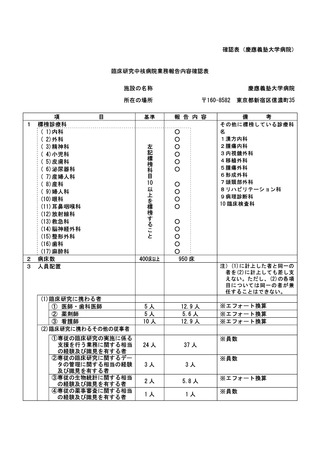
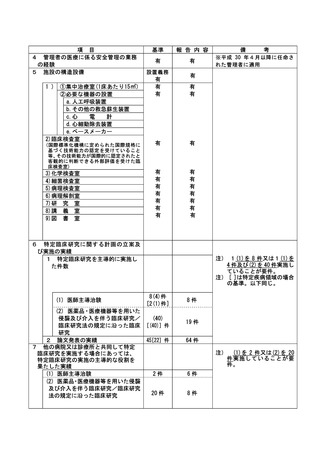
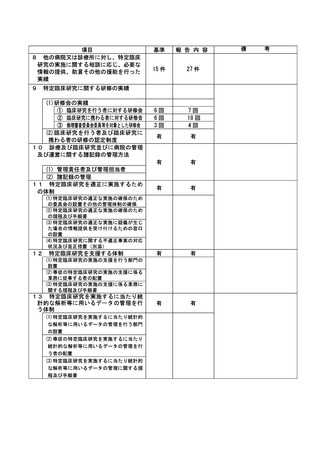
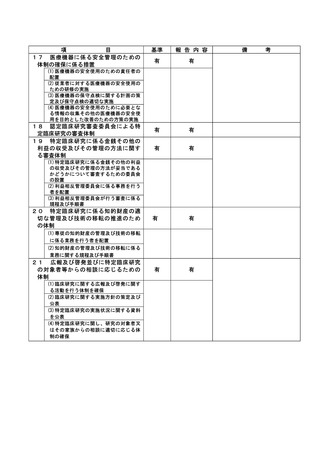
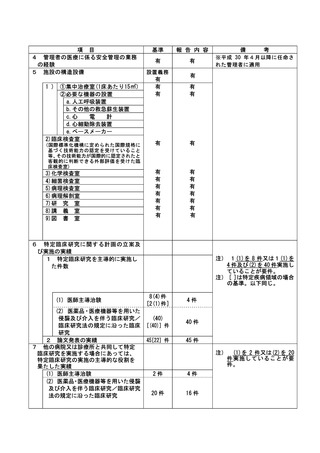
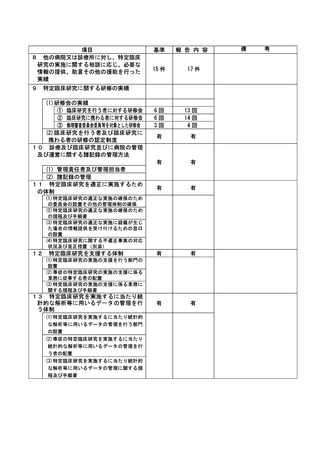
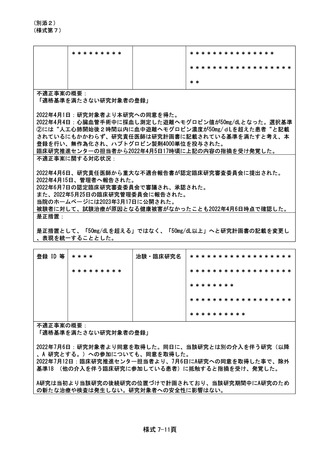
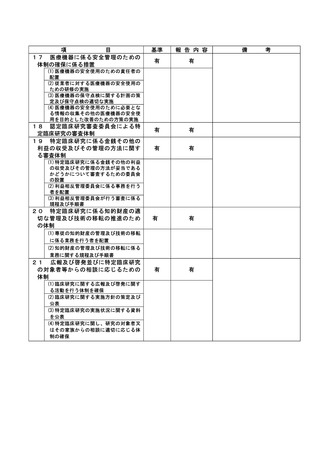
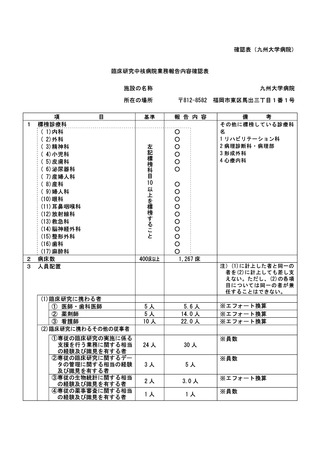
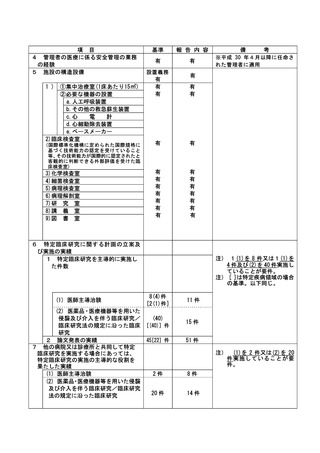
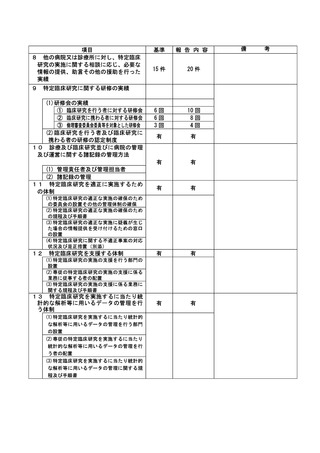
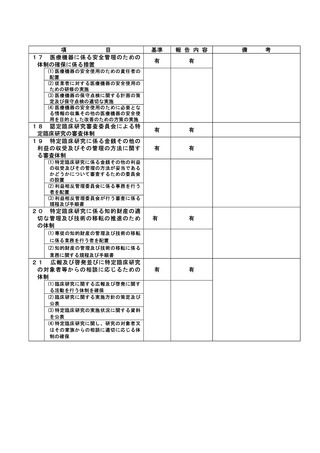
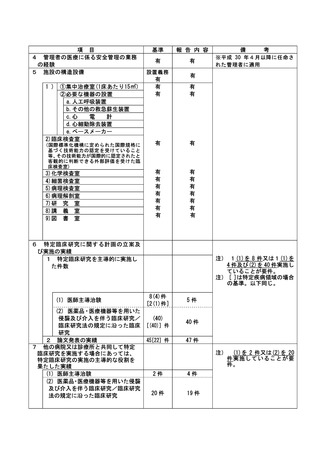
資料2:臨床研究中核病院業務報告内容確認表 (64 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(2)本件に関する経緯について適切な記録を作成し、同意書とともに保管すること。
(3)今後の研究継続にあたっては、説明文書、同意書書式ともに確実な版数管理を行い、CRBで承認
された最新版を間違いなく使用するよう、適切な予防措置をとること。
・当院研究責任医師による対応
2022年12月22日、臨床研究に関する不適合報告(2022年12月22日)を当院管理者へ提出、2023年1月
6日~13日臨床研究監理センター運営委員会(持ち回り審議)にて報告、承認された。
当院研究責任医師は、本来使用すべきであった説明同意文書と実際に使用した旧版説明同意文書の
相違点は「各実施医療機関における予定登録数上限の上方修正」のみであり、当院ではこの変更によ
る影響はなく、研究の進捗や実施結果への影響もなし、また研究対象者に及ぼす影響もなく、CRB へ
の重大不適合報告は不要との見解を示した。
#4
登録 ID 等
**
治験・臨床研究名
**
不適正事案の概要:
同意取得の不備(3名)
2020年7月25日から10月24日までの間、研究分担医師ではない医師が研究対象者3名より同意を取得
した。
当時の研究責任医師および研究分担医師は、いずれも当該同意取得に同席していなかった。
(多機関共同研究、他機関 CRB)
不適正事案に関する対応状況:
当院管理者(臨床研究監理センター)が本研究を対象に実施した「法・倫理指針適合性監査」の監
査報告書(2022年5月30日付)において、所見として指摘された。
2022年7月1日、当院管理者から研究責任医師へ研究責任医師または研究分担医師でない医師が同意
を取得したことは不適切であることを指摘し、以後行わないよう注意するとともに、以下を指示し
た。
①研究代表医師と協議の上、CRBへ「重大不適合報告」を提出し、研究対象者への対応、研究データ
の利用、並びに再発防止についてCRBの意見を聴くこと
②当該研究対象者へ、本事案について適切な説明を行うとともに、当該研究対象者より取得したデ
ータの使用についてCRBの意見に従うこと
③本事案の経緯について記録を別途作成し保管すること
2022年7月14日、当該特定臨床研究の代表医師からCRBへ「重大な不適合報告書(2022年7月14日)」
が提出され、7月21日に承認された(通知日:2022年7月25日、意見なし)。
9月22日、当院研究責任医師から当院管理者へ当該「重大な不適合報告書(2022年7月14日)」およ
びCRB審査結果通知書が提出され、10月28日の臨床研究監理センター運営委員会にて承認、10月20日
の臨床研究委員会運営会議にて報告、了承された。
なお研究分担医師は、10月22日から10月29日までの間、当該3名の研究対象者に対して、本件に関す
る説明および同意意志の確認を行い、すべての研究対象者から了承・確認を得た。
以上を確認後、当院管理者は本事案に関する対応の状況等を慶應義塾大学病院のホームページに公
表した。
是正措置:
・当院管理者による対応
2022年7月1日、研究責任医師へ以下を文書にて指導。
(1)本事案について不適合報告を行い、研究代表医師と協議の上CRBへ「重大な不適合報告」を提出
すること。
なお当該重大不適合報告においては、当該研究対象者への対応、データの利用方針、再発予防措置
様式 7-12
63