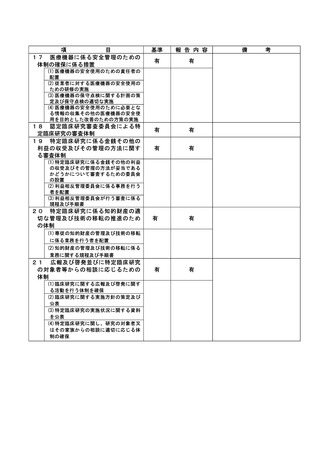
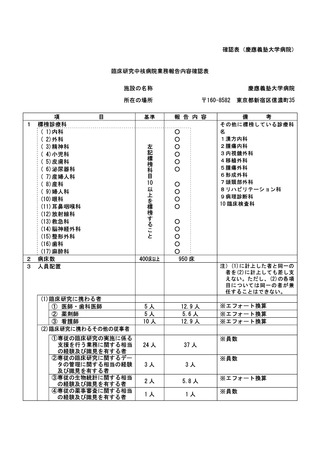
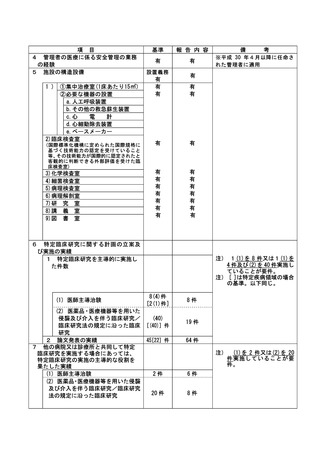
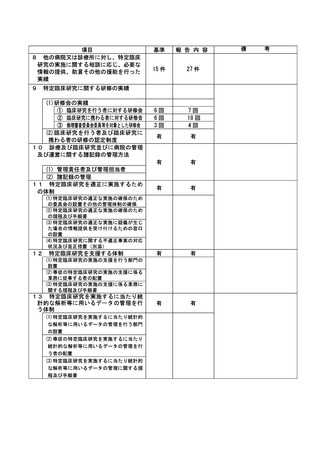
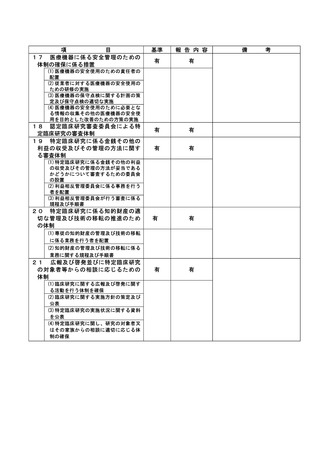
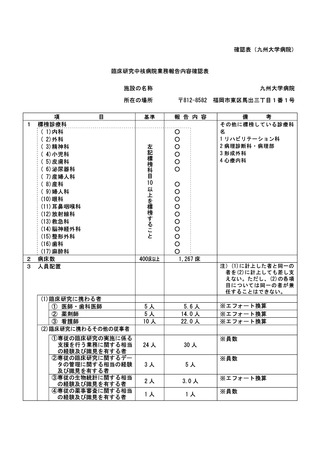
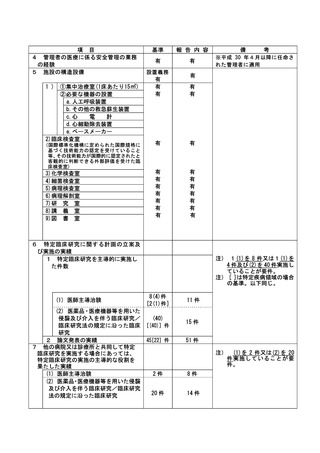
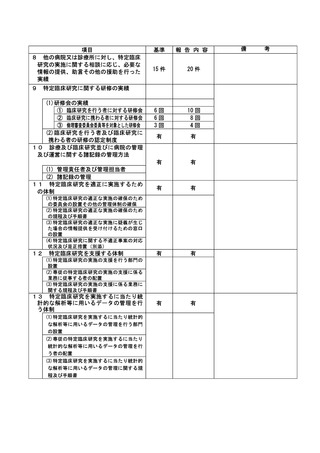
資料2:臨床研究中核病院業務報告内容確認表 (86 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
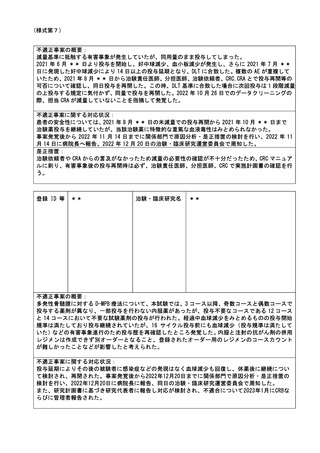
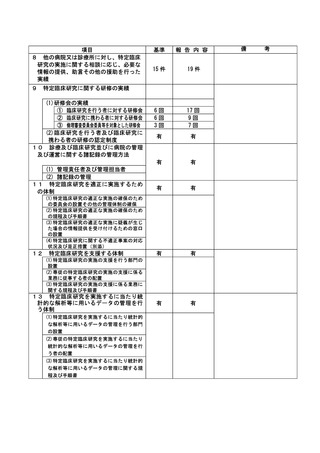
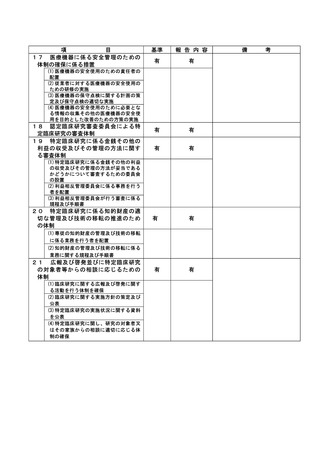
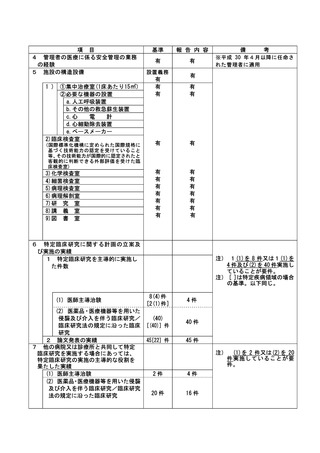
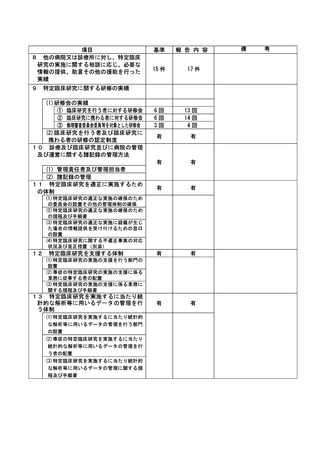
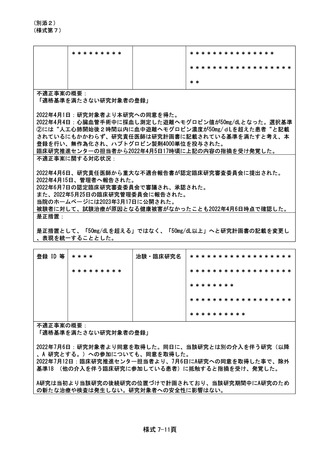
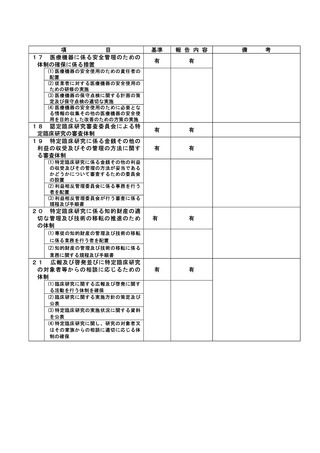
登録 ID 等
**
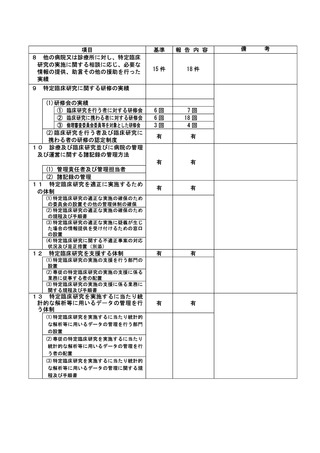
治験・臨床研究名
**
不適正事案の概要:
⑨ITI 治療・FVIII 製剤の長期休薬
不適正事案に関する対応状況:
状況:
研究対象者本人・保護者が連続してCOVID-19に罹患、かかりつけ医への来院制限が療養期間後も継
続されたことから、結果として2週間以上ITI治療・FVIII製剤を休薬されていたことが、令和4年8月
15日の患者家族からの連絡により判明した。
ITI治療・FVIII製剤投与を2週間以上行わないことはITI治療を実施しているとは言えず、研究のプ
ライマリーエンドポイントに影響が大きく、重大な不適合と判断した。
対応:
11月29日開催のCRBにて審議を行った結果、プロトコールに従い重大な不適合とされるが、薬剤投与
スケジュールの変更は、研究対象者及び保護者の都合によりやむを得ない理由によるものであり、
研究の継続については承認した。
令和5年1月11日開催の特定臨床研究管理委員会にて報告した。
なお、当該患者について、休薬期間中に治療を要する出血などの有害事象の報告はなかった。
是正措置:
研究対象者及び保護者の都合によりやむを得ない理由による逸脱であるため、是正措置は特になし。
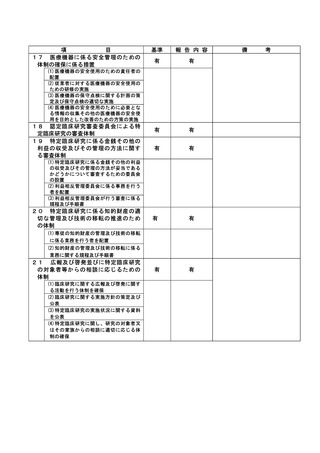
(注)1
2
不適正事案に関する調査の概要(方法、期間、結果等)を記載すること。
調査報告書その他関係書類が取りまとめられている場合は、添付すること。
様式 7-13頁
85