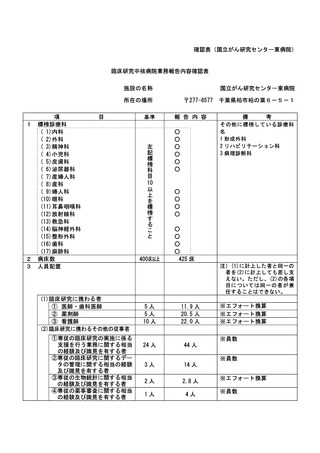
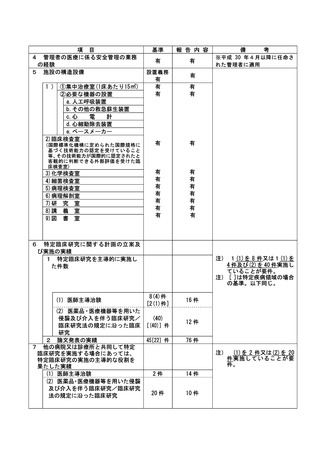
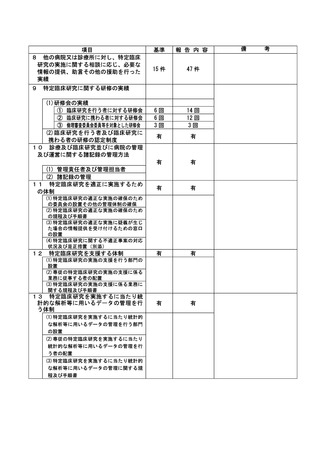
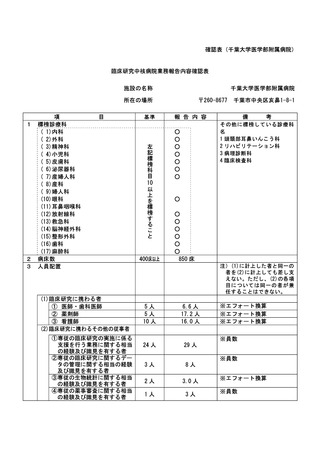
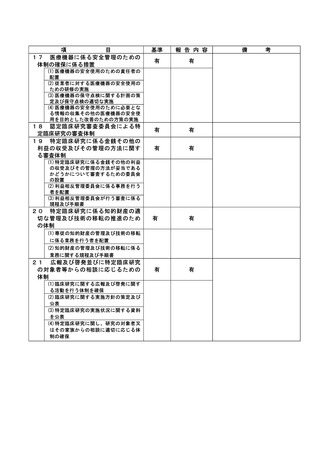
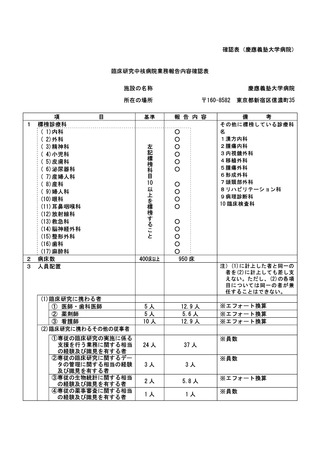
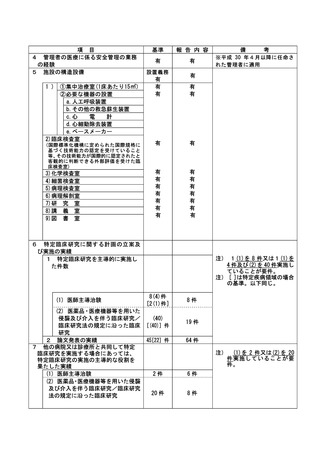
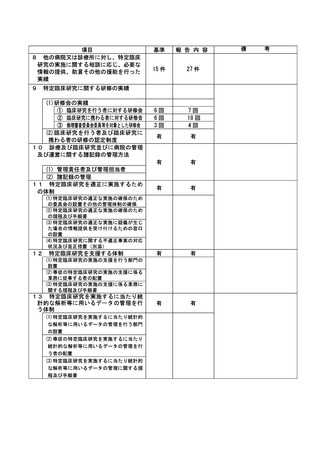
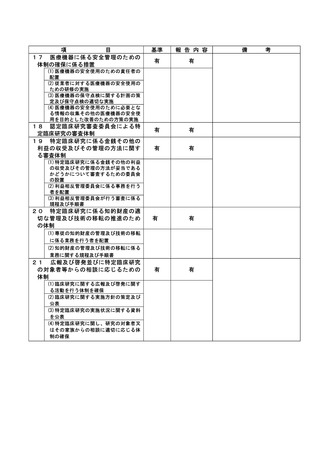
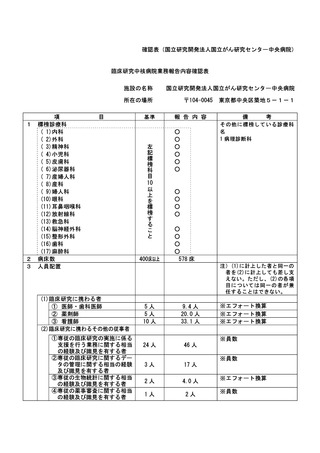
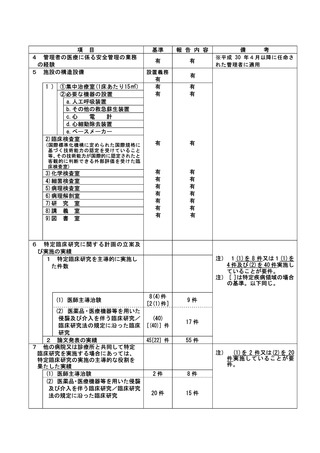
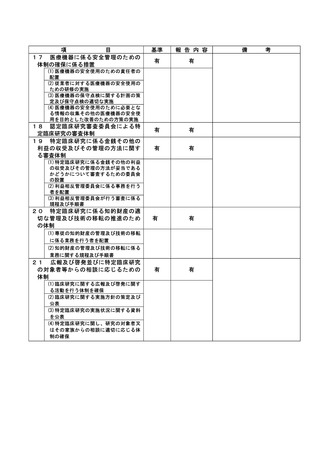
資料2:臨床研究中核病院業務報告内容確認表 (104 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
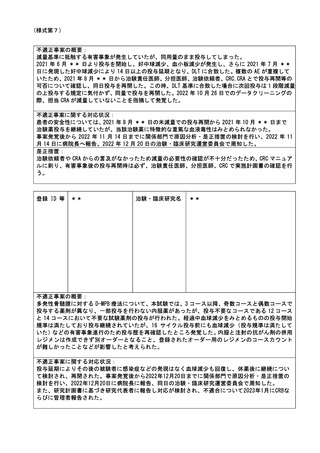
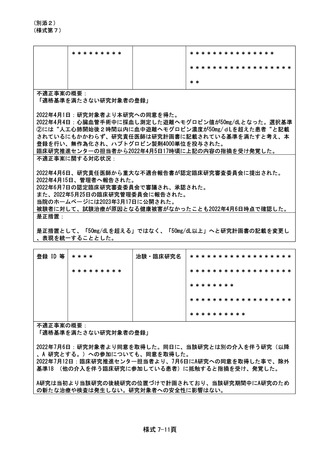
2022年5月10日に治験薬が投与終了となり次治療を開始する予定で入院調整を行なっていた。その
際、入院後、次治療開始前に貧血に対して治療(輸血)を行う方針であること、入院は翌週(5月16
日以降)の予定であることを確認していた。しかし、翌週(2022年5月16日)に入院予定を確認し
たところ、前週末に入院下で貧血の治療を行っていることがわかり、重篤な有害事象の報告遅延と
なった。
不適正事案に関する対応状況:
本事象発覚後すぐに、病院長と治験依頼者へ重篤な有害事象発生について書面にて報告を行った。
この報告の遅延に関して、治験における安全性の問題はない事を確認した。
是正措置:
入院等の重篤な有害事象が発生した場合に備え、入院時は CRC への連絡が必要である旨、カルテの
付箋機能を使用して注意喚起をおこなっていたが、治験薬投与終了後であったこともあり、機能し
なかった。そのため、今後は、担当医師や被験者及びその家族に、入院等の連絡が必要な期間につ
いて詳細に伝えることを徹底し再発防止とする。
登録 ID 等
*******
治験名
******************
******************
******************
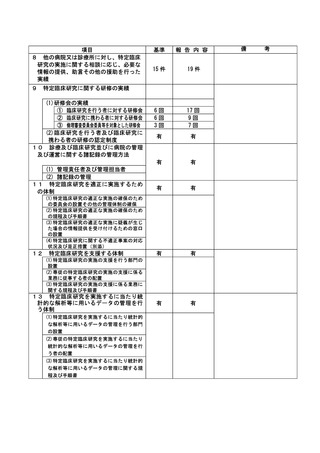
不適正事案の概要:同意説明文書の情報提供遅延
(本件は治験実施計画書からの逸脱ではないが、治験依頼者側の重大な逸脱事案であると考えるこ
とから、本書式を提出する)
治験依頼者は、担当 CRA に依頼者版 ICF 雛形の改訂情報を伝達したうえで、各施設の ICF 改訂につ
いて治験責任医師と協議の上、施設版 ICF の改訂を進めるよう指示していた。しかし、2021 年 12
月以降、治験依頼者版 ICF 雛形 3 回分の改訂情報について、担当 CRA から治験責任医師への提供が
行われなかった。
そのため、施設版 ICF に最新情報の反映がされず、結果的に、全ての被験者に最新情報が適切に提
供されなかった。当事象は、担当 CRA とは別の CRA が SDV を行った際に発覚し、2022 年 6 月 28 日
に担当 CRA より報告を受けた。
不適正事案に関する対応状況:
2021 年 12 月以降に改訂された治験依頼者版 ICF 雛形の 3 回分の改訂情報について、2022 年 7 月 1
日付で、施設版 ICF 第 5 版として改訂した。施設版 ICF 第 5 版の改訂内容について、全ての被験者
へ速やかに口頭説明を行い、治験継続の意思を確認した。施設版 ICF 第 5 版は、7 月 26 日開催の
IRB にて承認を受け、全ての被験者から速やかに文書同意を取得した。なお、この情報提供遅延に
よる被験者の安全性等に関して不利益はなく、治験の継続に問題ないと判断した。
是正措置:
治験依頼者側の再発防止策として、担当 CRA による各施設の ICF 改訂状況について、第三者による
トラッキング(ダブルチェック)を徹底し、今回のような改訂の漏れが生じないように対応される
ことを確認した。
登録 ID 等
*******
治験名
******************
******************
******************
不適正事案の概要:服薬方法の不遵守
様式第 7-11
103