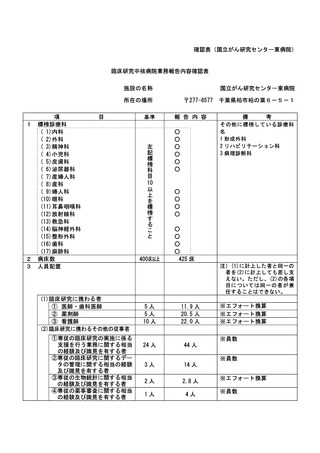
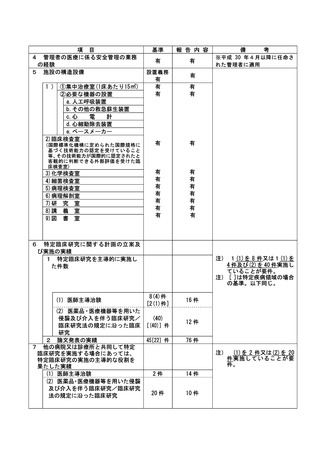
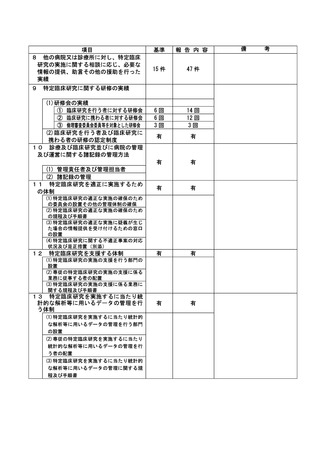
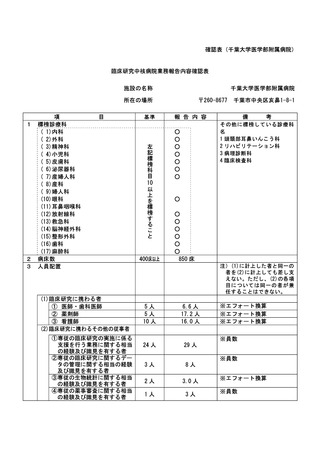
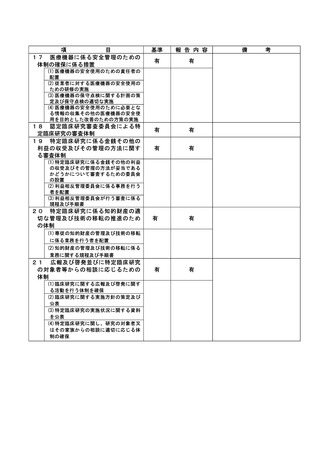
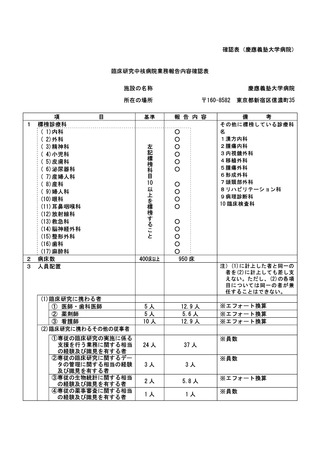
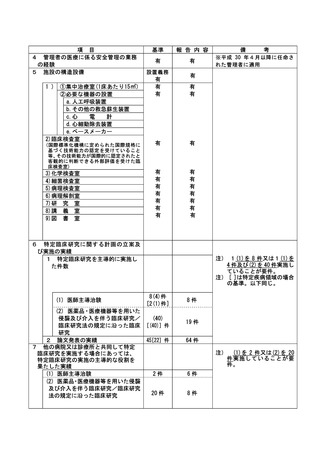
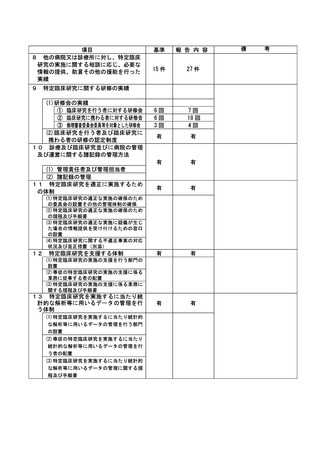
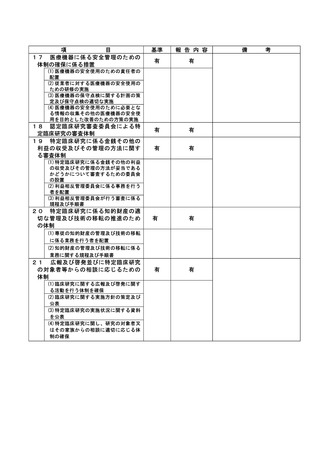
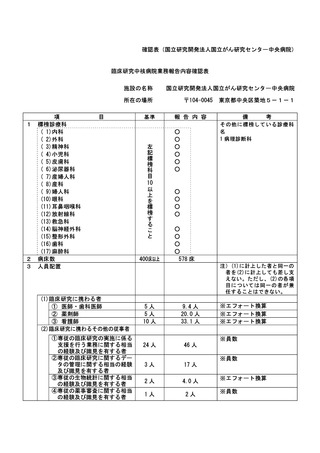
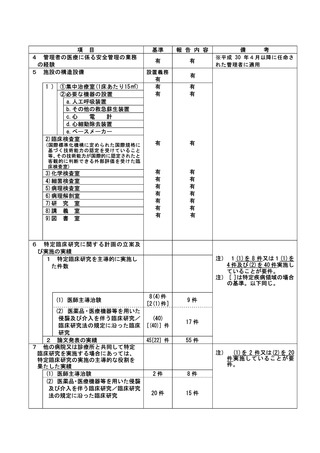
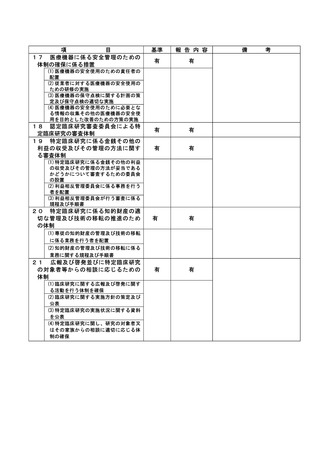
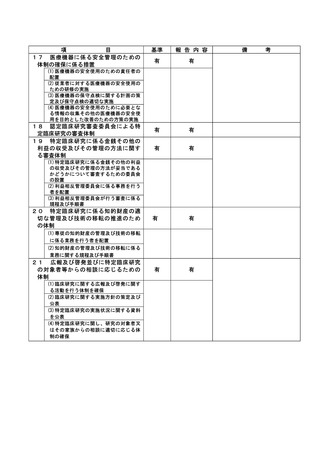
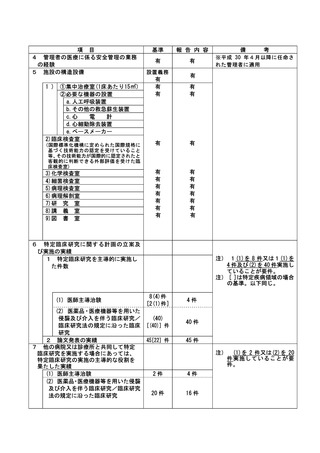
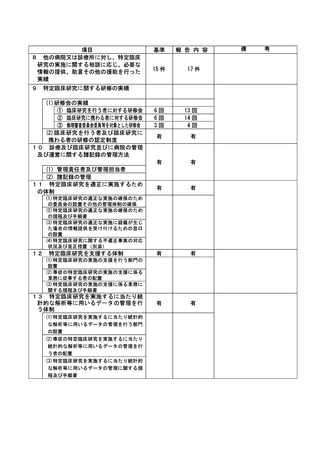
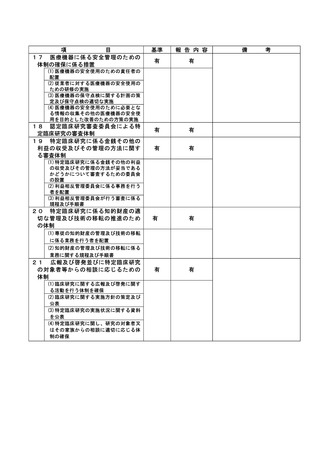
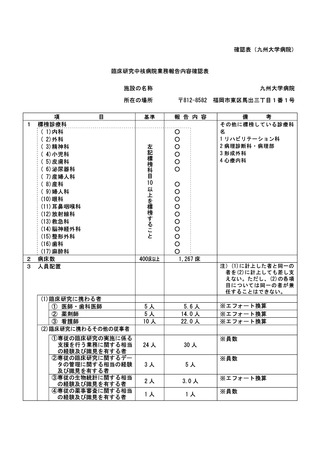
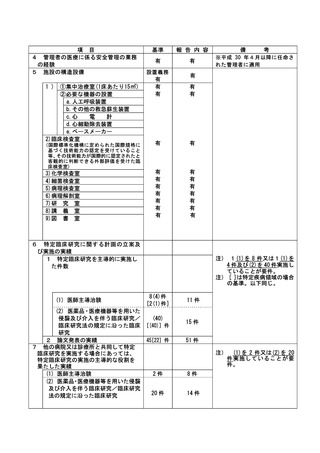
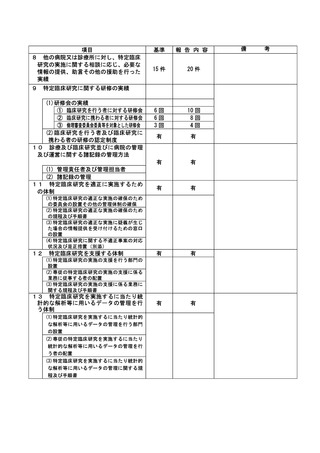
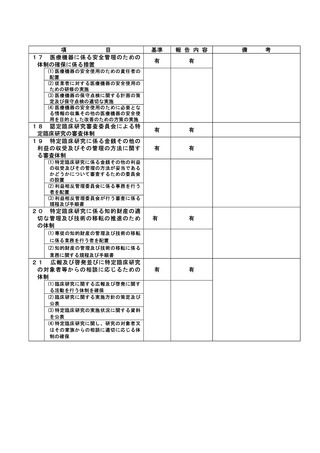
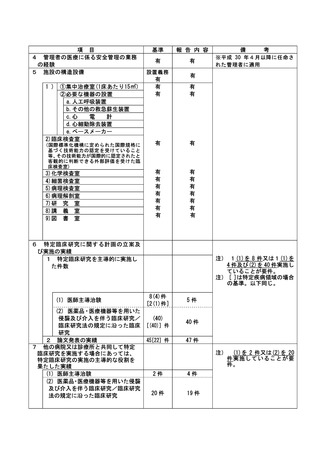
資料2:臨床研究中核病院業務報告内容確認表 (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
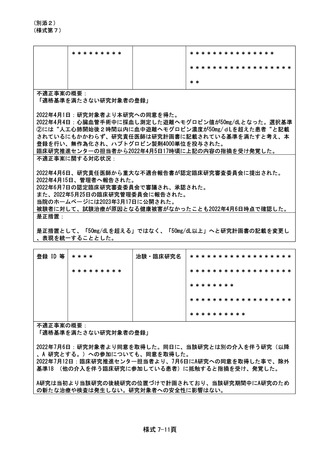
前治療の最終投与(2021 年 3 月 15 日)。2021 年 4 月 7 日に本試験へ登録。試験治療開始は 28
日以上 interval を確保し、前治療から 29 日目の 4 月 12 日に初回ドセタキセル・ラムシルマブ投与
を行った。
ドセタキセル・ラムシルマブ 15 サイクル施行後の 2022 年 2 月 21 日に浮腫の有害事象治療のための
入院で SAE 報告があったが、回復した。その後、試験治療は中止したが、増悪なく無治療経過観察さ
れている。
また、今回の事例に関して、当該患者に説明がなされており、今回の事案とその後の治療経過につ
いても、了承、承諾が得られた。
不適正事案に関する対応状況:
研究代表医師は 2022 年 7 月 8 日に CRB に重大な不適合報告書を提出、2022 年 7 月 27 日 CRB にて審
査され承認。2022 年 8 月 12 日に研究代表医師が所属する施設の管理者から実施決定通知書が発行
された。
それをもって当院研究責任医師は 2022 年 8 月 25 日に重大な不適合報告書、審査結果通知書及び研
究代表医師が所属する施設の管理者からの実施決定通知書を当院管理者に報告した
今回の事象が発生した理由として、研究代表医師は、次のように考察した。登録日を起点とした
基準であることについて研究事務局からの周知の徹底が不足していたことが想定される。研究責任
医師または研究分担医師が前治療最終投与日から試験治療開始日までのintervalを28日以上確保す
れば試験治療可と判断したことや、研究責任医師または研究分担医師による患者の前治療内容、経
過や全身状態からの判断で試験治療開始を前治療最終投与から21日以内に試験治療を開始したこと
が今回の発生の要因と考えられる。
また、当院の研究責任医師は、本試験の除外規準「前治療に抗癌治療を施⾏した場合、登録時点の
少なくとも 28⽇前に最終投与をしていること。」という記載内容が分かり難く、研究者が前治療か
ら 28 日以内に登録し、投与すると誤解したことが原因であると考察した。
是正措置:
本事案発覚時点で本試験の症例登録は終了していたため新たに同様な事例が発生することはなく、
再発防止策は策定されていないが、追跡期間中に発生した有害事象について、実施計画書に従って、
引き続き慎重に対応していく見解が研究代表医師によって示されている。
当院の研究責任医師は、研究代表施設と協議し、除外基準の明確化を図った。
登録 ID 等
**
治験・臨床研究名
(指針研究)
**
不適正事案の概要:
便検体を用いた前向き観察研究に於いて、過去(2017年)に採取された患者の便検体が、適切に
回収されずに病棟に放置されていた事案。
被験者の入院前の外来来院時、被験者に便採取を依頼し、採取キットを渡した。入院時、被験者
が検体を持参したが回収されず(経緯不明)、発泡スチロール箱に入れられたまま、病棟に放置さ
れていたのが、病棟の環境整備中に発見され、医療安全のCLIP報告されていたことが、2022年10月1
1日の臨床研究適正実施推進部会にて(臨床研究に関するCLIP報告を本部会にてチェックしている)
報告され発覚した。
29