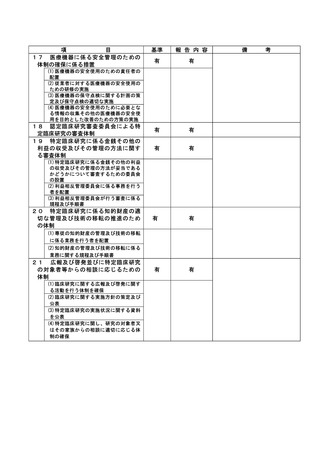
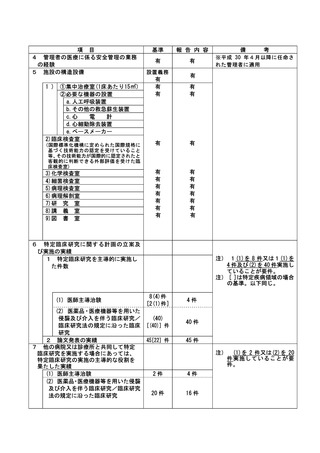
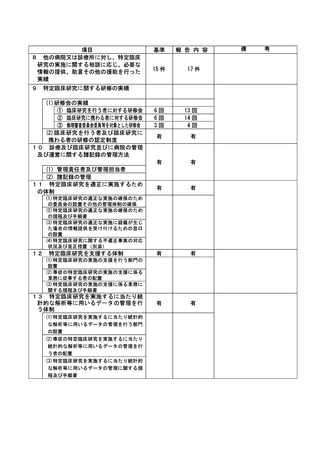
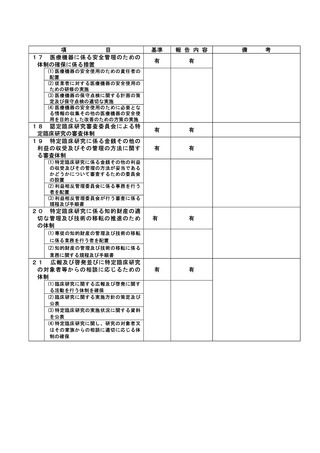
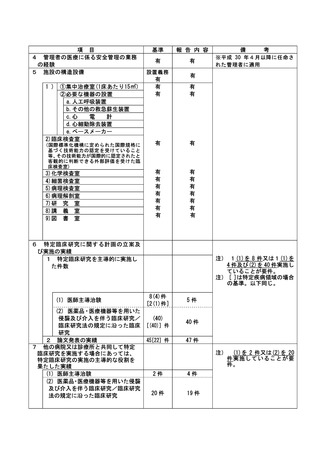
資料2:臨床研究中核病院業務報告内容確認表 (118 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_42147.html |
| 出典情報 | 厚生科学審議会 臨床研究部会(第35回 8/8)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
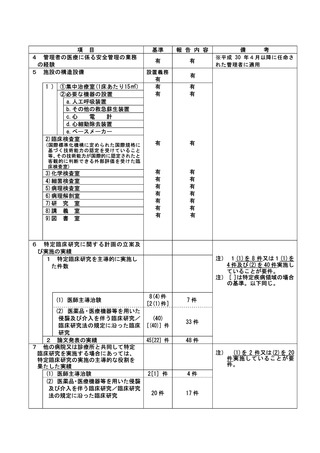
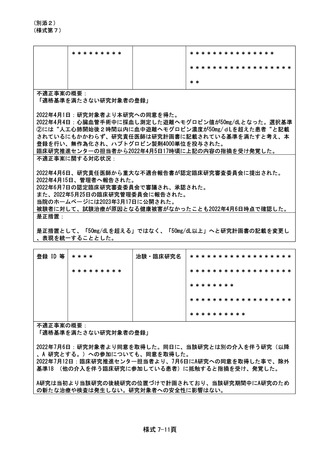
(様式第7)
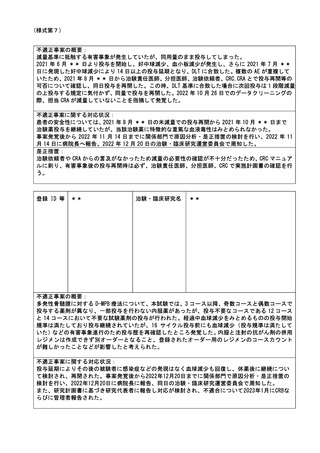
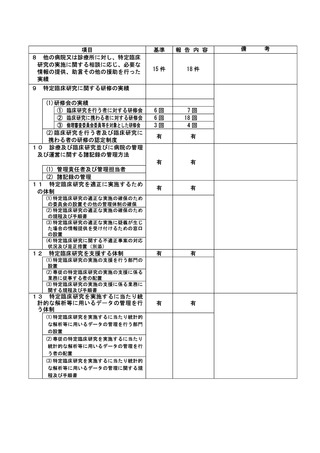
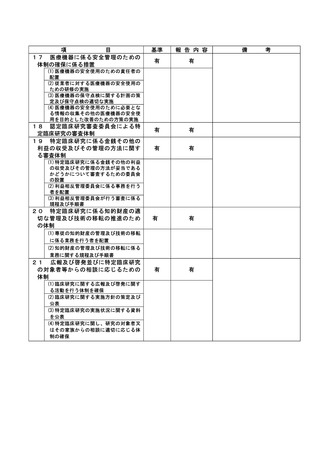
不適正事案に関する対応状況:
2022年7月19日、研究責任医師から重大な不適合報告書が認定臨床研究審査委員会に提出された。
2022年7月27日、管理者へ報告された。
2022年7月27日の臨床研究管理委員会に報告された。
また、2022年8月1日の認定臨床研究審査委員会で審議され、承認された。
2022年8月2日 責任医師の代理として研究事務局より全施設の責任医師へ本重大な不適合に関する
情報共有を一斉メールにて実施した。
当院のホームページには2023年3月17日に公開された。
研究対象者に対しての影響は無いと考え、研究中止とはせず、今後も研究継続する事とした。
是正措置:
是正措置として、除外基準18は介入を伴う研究のうちA研究は除外する事を明記し、2022年10月の認
定臨床研究審査委員会にて、審査承認された。
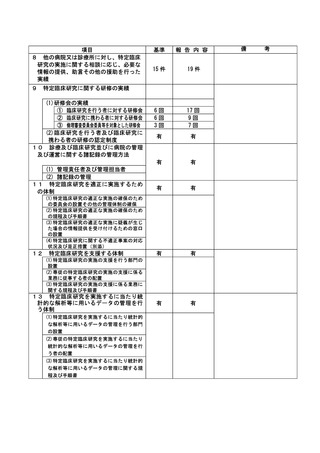
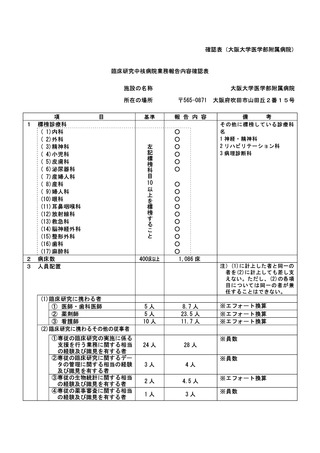
登録 ID 等
****
治験・臨床研究名
*********
******************
******************
********
******************
**********
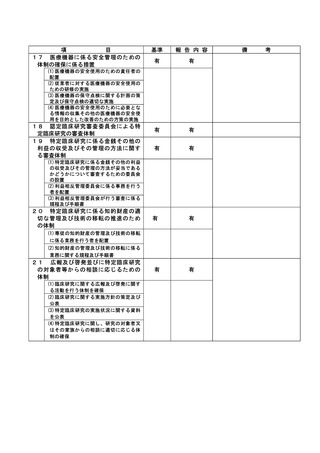
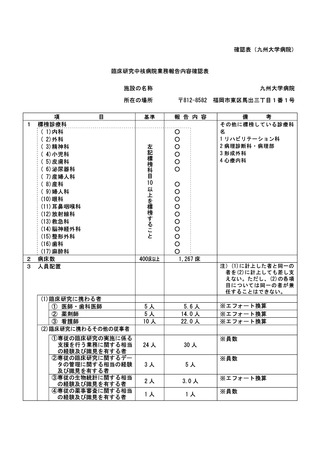
不適正事案の概要:
旧版の同意説明文書を用いた同意取得
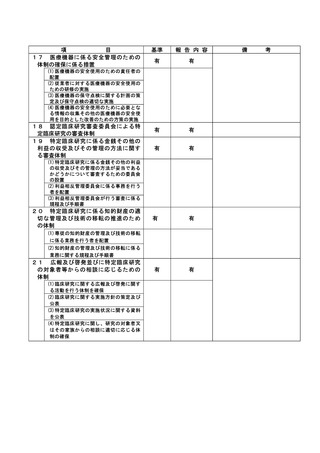
2022年8月3日:同意説明文書(第1.3版)についてCRBで承認となった。
2022年8月16日:同意説明文書(第1.3版)の改訂版がjRCT公開となった。
2022年8月17日:臨床研究推進センター(CTRC)担当者より担当医師のGmail宛てにjRCT公開された
旨の連絡があり、併せて院内文書管理システムの差し替えまではmail添付の同意説明文書(第1.3版
)を印刷の上で使用頂くよう、依頼があった。この頃、メール配達の不具合が報告されており、本
メールが担当医師に届いていなかった。
2022年8月22日:旧版である同意説明文書(第1.2版)を用いて、同意を取得した。
2022年8月23日:院内文書管理システムの差し替えが完了し、CTRC担当者より担当医師のGmail宛て
に報告した。
2022年8月24日:CTRC担当者が同意書を受領し、同意説明文書(第1.2版)での同意取得が発覚した
。
<研究対象者への影響>
同意説明文書第1.2版から第1.3版の改訂内容は一部施設が該当する内容であり、第1.2版の同意説明
文書を用いた事による当該被験者への直接的な影響は無い。
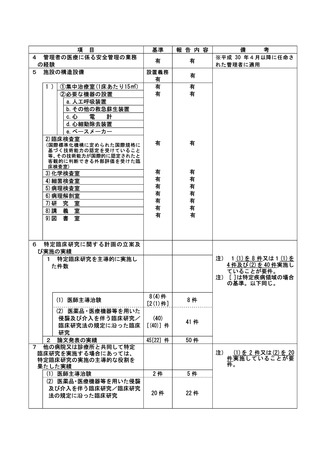
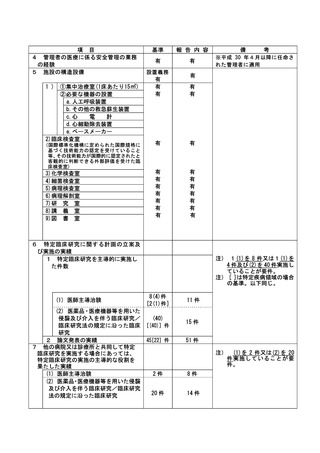
不適正事案に関する対応状況:
2022年8月29日、研究責任医師から重大な不適合報告書が認定臨床研究審査委員会に提出された。
2022年9月13日、責任医師の代理として研究事務局より全施設の責任医師へ本重大な不適合に関する
情報共有を一斉メールにて実施した。
2022年9月22日、管理者へ報告された。
2022年9月22日の臨床研究管理委員会に報告された。
また、2022年10月3日の認定臨床研究審査委員会で審議され、承認された。
様式 7-12頁
117